修回日期: 2005-07-03
接受日期: 2005-07-06
在线出版日期: 2005-10-15
目的: 克隆GRIM19基因, 并构建F3-GRIM19表达载体.
方法: 从正常人胎盘组织中克隆GRIM19的cDNA, 并构建了F3-GRIM19表达载体, 测序正确后, 表达并亲和层析纯化F3-GRIM19融合蛋白.
结果: 克隆后测序, 发现其含有约580 bp的插入片段, 基因与GenBank序列完全一致, 读码框正确. 在大肠杆菌中表达Mr 25 000的F3-GRIM19蛋白, 灰度值分析表达量约占菌体总蛋白的25%. 经纯化, 目的蛋白纯度达90%, 复性率为17.3%.
结论: 成功构建了F3-GRIM19原核表达载体, 并成功表达纯化了目的蛋白.
引文著录: 孙厚良, 刘洋, 李甲初, 曾昭淳. 人F3-GRIM19基因的克隆与表达. 世界华人消化杂志 2005; 13(19): 2306-2309
Revised: July 3, 2005
Accepted: July 6, 2005
Published online: October 15, 2005
AIM: To clone the cDNA of genes associated with retinoid-IFN-induced mortality (GRIM19), and to construct the F3-GRIM19 expression vector.
METHODS: The total RNA was extracted from normal placenta tissues, and the GRIM19 cDNA was amplified by reverse transcription polymerase chain reaction (RT-PCR). Then the pQE30-F3-GRIM19 expression vector was constructed and sequenced. Thus, the fusion protein of F3-GRIM19 was expressed in E. coli and purified using Ni2+-NTA agarose resin.
RESULTS: After sequencing, the pQE30-F3-GRIM19 contained 580 bp insert, which was consistent with the F3-GRIM19 sequence in GenBank. The expression of the fusion protein (Mr 25 000) was at the highest level 4-5 h after induced by Isopropyl-b-D-thiogalactopyranoside (IPTG), which accounted for 25% in E. coli. After purification, the purity of the target protein was above 90% and the recovery rate was 17.3%.
CONCLUSION: The F3-GRIM19 prokaryotic expression vector is successfully constructed, and the target protein was expressed and highly purified.
- Citation: Sun HL, Liu Y, Li JC, Zeng ZC. Cloning and expression of human F3-GRIM19 gene. Shijie Huaren Xiaohua Zazhi 2005; 13(19): 2306-2309
- URL: https://www.wjgnet.com/1009-3079/full/v13/i19/2306.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i19.2306
实验证明, 人类多数肿瘤细胞中均有STAT3持续表达, 且活性高于正常. 持续激活的STAT3导致细胞的恶性增生、抗凋亡、维持新血管生成和逃脱免疫监视; 阻断持续激活的STAT3信号通路能有效抑制肿瘤细胞增生、诱导其凋亡、刺激免疫应答以及抑制新血管生成. 所以STAT3被认为是癌症治疗上最有前景的分子靶点之一[1,2]. GRIM19(genes associated with retinoid-IFN-induced mortality19)能特异性与STAT3直接结合, 阻断胞质中的STAT3进入细胞核, 从而下调细胞核中STAT3转录激活活性、抑制其靶基因的表达及细胞生长[3-5]. 编码人类高迁移组蛋白2(HMGN2)N端31个氨基酸的F3肽能将其携带的噬菌体或绿色荧光蛋白特异性靶向肿瘤细胞和肿瘤血管内皮细胞, 并穿过细胞膜进入胞质和胞核[6]. 这就可以利用F3肽作为靶向肿瘤的药物载体, 用于肿瘤的靶向治疗. 为此, 把编码GRIM19的DNA连接于编码F3肽的DNA的3'端, 表达F3-GRIM19融合肽, 为研究其抑制肿瘤的机制打下基础, 为进一步开发新一代抗肿瘤药物具有重大的理论和实际意义.
胎盘组织取自正常产妇破腹手术切除的新鲜胎盘组织; 院吮泶镌豴ET32a(+)和pQE30由本室保存; Trizol RNA抽提试剂为Invitrogen公司产品; 限制性内切酶及高保真Pyrobest酶、dNTP及IPTG购于宝生物工程(大连)有限公司; T4 DNA连接酶购于Promega公司; RT试剂盒购于Qiagen公司. 根据Genebank AF286697号编码GRIM19全长序列由软件设计引物, 正向引物P1: 5'-GAGAATTCATGGCGGCGTCAAAGG-3'(EcoRⅠ)逆向引物P2: 5'-GAAAGCTT CAGGGCCTACGTGTACCACAT-3'(Hind Ⅲ). 根据F3肽全长序列设计引物, 逆向引物加6个甘氨酸作柔性连接于GRIM19的N端(黑体部分), 正向引物Pa: 5'-CGCCCTGCCCATGGACAAAGATGAACCGCAACGTC-3'(NcoⅠ)逆向引物Pb: 5'-CGGAATTCACCACCACCACCACCACCCTTCTTAGCCGGTGCTT TT-3'(EcoRⅠ).
胎盘总RNA的抽提, 取正常人胎盘组织, 按Trizol试剂的操作说明抽提总RNA, 1g/L DEPC处理的15 g/L的琼脂糖凝胶电泳鉴定其完整性. RT-PCR扩增人GRIM19的cDNA, 20 mL逆转录体系如下: 10×Buffer 2.0 mL, dNTP 2.0 mL, primer 0.8 mL, Rnase inhibitor 1.0 mL, AMV RT 1.0 mL, Rnase-free water 9.2 mL, 总RNA(Up to 2 mg)4 mL; 37 ℃水浴保温60 min之后, 直接进行PCR. 50 mL PCR体系如下: ddH2O 35.75 mL, 10×PCR buffer 5 mL, dNTP(2.5 mmol/L)5 mL, P1(25 mmol/L)1 mL, P2 1 mL, cDNA 2 mL, Pyrbest聚合酶0.25 mL, 总体积50 mL; 反应条件: 94 ℃预变性4 min; 94 ℃变性40 s, 63 ℃退火40 s, 72 ℃延伸40 s, 共30个循环; 72 ℃总延伸10 min; 反应结束后取5 mL产物在12 g/L的琼脂糖凝胶中电泳, 鉴定扩增出与预期大小的DNA片段后, 进行PCR产物纯化. 将质粒pET32a(+)及RT-PCR产物经EcoRⅠ和Hind Ⅲ双酶切后, 分别纯化回收, 4 ℃连接酶连接24 h, 将连接产物转化感受态的大肠杆菌DH5a, 氨苄抗性筛选阳性克隆, 提取质粒, 限制性内切酶酶切鉴定重组质粒, 阳性克隆命名为pET32a-GRIM19, 送上海生工测序.
1.2.1 pET32a-F3-GRIM19表达载体的构建: 以含F3全长序列的质粒pEKH-F3为模板扩增F3的DNA片断, 扩增体系和条件同上. 将质粒pET32a-GRIM19及F3的PCR产物綨coⅠ和EcoRⅠ双酶切后, 分别纯化回收, 连接、筛选、鉴定, 阳性克隆命名为pET32a-F3-GRIM19, 送上海生工测序.
1.2.2 亚克隆构建pQE30-F3-GRIM19重组载体: 将质粒pET32a-F3-GRIM19及pQE30綤pnⅠ/Hind Ⅲ双酶切后, 分别纯化回收pET32a-F3-GRIM19酶切小片段及pQE30酶切大片段, 连接、转化、筛选, 阳性克隆命名为pQE30-F3-GRIM19.
1.2.3 重组F3-GRIM19的表达及表达产物鉴定: pQE30-F3-GRIM19转化感受态大肠杆菌表达株SG13009, 挑取在卡拉霉素和氨苄平板生长良好的单克隆, 37 ℃液体振荡培养至A600至1.0, 加IPTG至终浓度1 mmol/L, 继续培养4 h, 诱导目的蛋白的表达. 收集培养上清和菌体, 菌体进行超声破碎, 离心, 分别收集上清和沉淀, SDS-PAGE(150 g/L分离胶和50 g/L积层胶), 分析目的蛋白表达的部位和含量. 因pQE30载体表达的目的蛋白N端含6个His标签, 故可用抗聚His单抗的Western blotting鉴定表达产物, 步骤如下: 表达产物SDS-PAGE, 电转移至PVDF膜, 5%脱脂奶粉封闭1 h, 抗His标签单抗孵育1 h、HRP标记的羊抗小鼠IgG孵育1 h, 每步完成后均洗膜3次, 最后DAB显色.
1.2.4 Ni2+-NTA亲和层析纯化F3-GRIM19: 融合蛋白含6个组氨酸的标签, 故表达产物可用Ni2+-NTA琼脂糖树脂进行纯化. pQE30-F3-GRIM19大量诱导表达后, 离心收集菌体, 超声破碎后, 离心沉淀包涵体. 20 mL/L TritonX-100和2 mol/L Urea洗涤包涵体4-5次, Buffer A(0.5 mol/L NaCl, 5 mmol/L imidazole, 20 mmol/L Tris-HCl, 6 mol/L Urea, pH7.9)冰浴溶解包涵体, 溶解上清用0.45 mm滤膜过滤, 滤液上Ni2+-NTA树脂层析柱. Buffer A和Buffer B(含60 mmol/L imidazole的Buffer A)洗柱, Buffer C(含1 mol/L imidazole的Buffer A)洗脱目的蛋白. 纯化蛋白经梯度透析复性后, Bradford法测定蛋白浓度, 冷冻干燥保存.
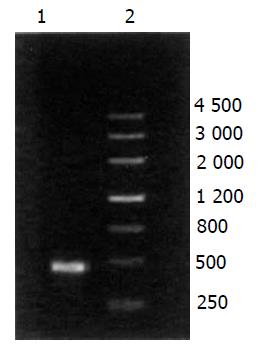
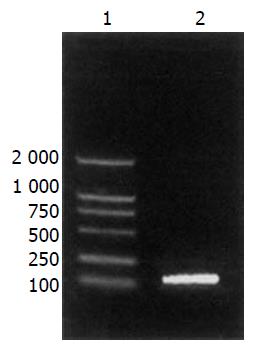
RT-PCR扩增得一长约450 bp DNA片段, 与预期GRIM19片段大小一致(图1). 质粒pEKH-F3为模板, PCR扩增得一长约130 bp DNA片段, 与预期F3片段大小一致(图2).
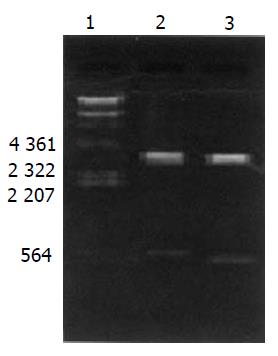
pQE30-F3-GRIM19经过鉴定(图3), 结果获得了插入片段的阳性克隆, 插入片段约为580 bp, 与预期的F3-GRIM19基本一致. 测序结果与文献报道序列一致, 而且读码框正确.
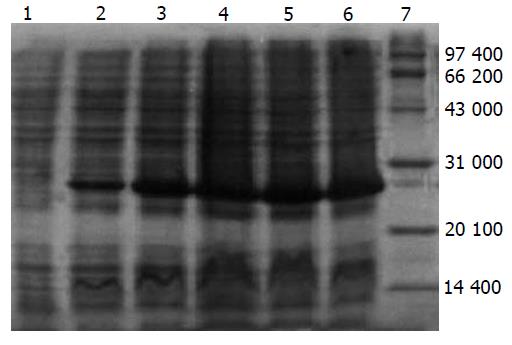
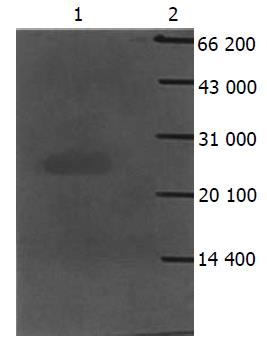
表达载体在表达菌中以37 ℃, 1 mmoL/L IPTG, 诱导表达4-5 h表达量达最大. 菌体裂解后取上清和沉淀行SDS-PAGE, 分析表明融合蛋白以包涵体形式表达; Mr 25 000. 灰度值分析表达量约占菌体总蛋白的25%(图4). Western blot只在Mr 25 000处显色, 分析表明表达产物为目的蛋白(图5).
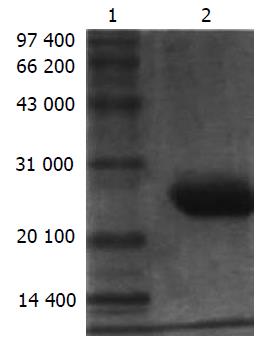
目的蛋白经Ni2+-NTA树脂纯化及稀释透析复性后进行SDS-PAGE, 结果纯度达90%以上(图6), 复性得率为17.3%.
GRIM19是2000年由Angell et al[3]筛选出的一个新死亡相关基因, 它的高表达能抑制肿瘤细胞的增殖, 促进细胞的凋亡. 2003年Zhang et al[4]发现GRIM19直接特异性作用于STAT3, 阻断STAT3的下游活性. 细胞实验显示GRIM19以剂量依赖性抑制肿瘤细胞的生长, 而对正常细胞影响甚小. 分析表明, GRIM19的36-72位氨基酸是与STAT3结合阻止其进入胞核的功能部位[5]. GRIM 19主要分布于线粒体, 少量分布于胞质和核内, 受干扰素等刺激后表达量增加, 且迅速进入胞核[7]. F3的肿瘤细胞靶向性及内在化作用为蛋白GRIM19提供了很好的肿瘤靶向载体, 所以我们将F3与GRIM19柔性连接起来, 构建F3-GRIM19表达载体. 还可进一步将GRIM19连接于F3肽的N端. 利用6个甘氨酸将F3与GRIM19柔性连接是为了使融合蛋白中F3片段和GRIM19各自都更好的保持其正确的空间构象和生物学活性. pQE30是高效的原核融合表达载体, 融合部分只有6×His标签, 一般不对目的蛋白的结构和功能产生影响, 而且便于表达产物的鉴定和纯化. 期望GRIM19在F3肽的引导下, 靶向肿瘤细胞和肿瘤血管内皮细胞, 并进入胞质和胞核内, 与STAT3结合, 发挥其抗肿瘤作用. 所以, 目的蛋白F3-GRIM19的表达为其生物学活性检测作好了物质准备, 通过对不同肿瘤的抑制, 筛选出灵敏高效的肿瘤类型, 有望开发出新型的肿瘤靶向治疗制剂.
电编: 张敏 编辑:潘伯荣 审读:张海宁
| 1. | Yu H, Jove R. The STATs of cancer--new molecular targets come of age. Nat Rev Cancer. 2004;4:97-105. [PubMed] [DOI] |
| 2. | Frank DA. StAT signaling in cancer: insights into pathogenesis and treatment strategies. Cancer Treat Res. 2003;115:267-291. [PubMed] [DOI] |
| 3. | Angell JE, Lindner DJ, Shapiro PS, Hofmann ER, Kalvakolanu DV. Identification of GRIM-19, a novel cell death-regulatory gene induced by the interferon-beta and retinoic acid combination, using a genetic approach. J Biol Chem. 2000;275:33416-33426. [PubMed] [DOI] |
| 4. | Zhang J, Yang J, Roy SK, Tininini S, Hu J, Bromberg JF, Poli V, Stark GR, Kalvakolanu DV. The cell death regulator GRIM-19 is an inhibitor of signal transducer and activator of transcription 3. Proc Natl Acad Sci USA. 2003;100:9342-9347. [PubMed] [DOI] |
| 5. | Lufei C, Ma J, Huang G, Zhang T, Novotny-Diermayr V, Ong CT, Cao X. GRIM-19, a death-regulatory gene product, suppresses Stat3 activity via functional interaction. EMBO J. 2003;22:1325-1335. [PubMed] [DOI] |
| 6. | Porkka K, Laakkonen P, Hoffman JA, Bernasconi M, Ruoslahti E. A fragment of the HMGN2 protein homes to the nuclei of tumor cells and tumor endothelial cells in vivo. Proc Natl Acad Sci USA. 2002;99:7444-7449. [PubMed] [DOI] |
| 7. | Huang G, Lu H, Hao A, Ng DC, Ponniah S, Guo K, Lufei C, Zeng Q, Cao X. GRIM-19, a cell death regulatory protein, is essential for assembly and function of mitochondrial complex I. Mol Cell Biol. 2004;24:8447-8456. [PubMed] [DOI] |