修回日期: 2005-06-06
接受日期: 2005-06-13
在线出版日期: 2005-09-28
目的: 探讨CD4+CD25+调节性T(Treg)细胞在慢性丙型肝炎患者免疫下调中的意义.
方法: 流式细胞仪检测慢性丙型肝炎患者外周血中CD4+CD25+Treg细胞的数量; 与CD4+CD25-T细胞共同培养, 检测其抑制功能; 流式细胞仪检测其对CD4+CD25-T细胞合成IFN-γ和IL-4的影响; RT-PCR检测CD4+CD25+Treg细胞中Foxp3的mRNA表达.
结果: CD4+CD25+Treg细胞约占慢性丙型肝炎患者外周血中CD4+T细胞的14.1 ± 1.6%, 显著高于正常对照5.3 ± 0.8%(P<0.01), 显著抑制CD4+T细胞的增殖(P = 0.002), 以及合成IFN-γ. CD4+CD25+Treg细胞高表达Foxp3.
结论: 持续性HCV感染患者CD4+CD25+Treg细胞表达增加, 特异性抑制Th1细胞反应.
引文著录: 杨江华, 张永祥, 苏川, 孙南雄. 慢性丙型肝炎患者 CD4+CD25+ 调节性T细胞表达增加. 世界华人消化杂志 2005; 13(18): 2201-2204
Revised: June 6, 2005
Accepted: June 13, 2005
Published online: September 28, 2005
AIM: To investigate the role of CD4+CD25+ regulatory T cells in the immune responses of patients with chronic hepatitis C.
METHODS: The number of CD4+CD25+ regulatory T cells in the peripheral blood of chronic HC patients was detected by flow cytometry. Then the CD4+CD25+ regulatory T cells were co-cultured with CD4+CD25-T cells, and their inhibitory effect was analyzed. Flow cytometry was also used to examine the effect of CD4+CD25+ regulatory T cells on the synthesis of Interferon-g and Interleukin-4 in CD4+CD25-T cells. The expression of Foxp3 in CD4+CD25+ regulatory T cells was detected by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: The percentage of CD4+CD25+ regulatory T cells in the peripheral CD4+ T cells of the chronic HC patients was significantly higher than that of the healthy controls (14.1 ± 1.6% vs 5.3 ± 0.8%, P<0.01). CD4+CD25+ regulatory T cells significantly inhibited the proliferation of CD4+CD25-T cells (P = 0.002) and the synthesis of IFN-g. Foxp3 was highly expressed in CD4+CD25+ regulatory T cells.
CONCLUSION: The level of CD4+CD25+ regulatory T cells increases in patients with chronic hepatitis C virus infection, which can specifically inhibit the response of Th1 cells.
- Citation: Yang JH, Zhang YX, Su C, Sun NX. Increase of CD4+CD25+ regulatory T cells in peripheral blood of patients with chronic hepatitis C. Shijie Huaren Xiaohua Zazhi 2005; 13(18): 2201-2204
- URL: https://www.wjgnet.com/1009-3079/full/v13/i18/2201.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i18.2201
HCV感染的显著临床特点是, 80%以上的急性患者可转变为慢性持续性感染, 而慢性HCV感染又是肝硬化和原发性肝细胞癌的重要病因[1]. 研究急性自限性HCV感染的患者和猩猩表明有效控制HCV感染需要一个持久、广泛的CD4+Th1细胞反应. 而慢性丙型肝炎患者表现为HCV特异性CD4+Th细胞数量减少, 对抗原刺激的增生能力显著降低, 主要分泌Th2型细胞因子(IL-4、IL-6和IL-10), 而分泌Th1型细胞因子能力减弱(IFN-γ)[1-5]. 近来研究显示, 在多种病原体的慢性感染中, 如疟原虫[6]、利什曼原虫[7]和HIV[8]等, 能够诱导宿主上调表达一群具有免疫抑制功能的CD4+CD25+Treg(CD4+CD25+regulatory T cell)细胞, 分泌的IL-10和TGF-β能够抑制抗原特异性CD4+T细胞反应, 下调Th1的功能. 而去除CD4+CD25+Treg细胞能够显著降低这些病原体的感染率. 现就CD4+CD25+Treg细胞在慢性丙型肝炎患者中的数量, 功能以及发病中的意义进行了探讨.
慢性丙型肝炎患者18例, 男11例, 女7例, 年龄14-60(平均48)岁. 诊断符合2004年丙型肝炎防治指南的诊断标准. 所有病例6 mo内均未使用免疫调节药物和抗病毒治疗, 不合并HBV感染以及其它病毒性肝炎. 正常对照15例, 男10例, 女5例.
细胞培养在RPMI1640中, 含有2.05 mmol/L谷氨酰胺; 105 U/L青霉素和链霉素(Hyclone), 以及100 mL/L人AB血清, 于96孔U型培养板(Costar). 流式抗体有PE-Cy5标记的CD4, PE标记的CD25, FITC标记的CD45RO(BD PharMingen), PE标记的IFN-γ抗体和IL-4抗体(eBioscience), 同型对照抗体为PE标记的大鼠IgG1和小鼠IgG1(eBioscience). 以及红细胞裂解液与抗CD3抗体(BD PharMingen). 阳性分选CD8+T细胞磁珠(Dynal), 分选CD4+CD25+T细胞的免疫磁珠(Miltenyi). RNA纯化试剂盒与RT-PCR试剂盒(QIAGEN).
1.2.1 CD4+CD25+Treg细胞计数: 取全血100 µL, 分别加入PE-Cy5标记的CD4, PE标记的CD25, FITC标记的CD45RO各10 µL于标本管中, 室温孵育20-30 min. 再加红细胞裂解液, 并振荡混匀. 洗涤一次, 重新悬浮细胞, 上流式细胞仪检测. 对于已分离的细胞用直接抗体标记后, 即可检测.
1.2.2 CD4+CD25+T细胞的分离与培养: 采患者或正常人静脉血, 用密度梯度离心法分离单个核细胞. 然后用Dynabeads阳性分选去除单个核细胞中的CD8+T细胞; 再使用Miltenyi磁珠阴性分选CD4+T细胞. 将这种去除T细胞(CD8+T和CD4+T细胞)的剩余细胞, 用Co-60照射(30 Gy), 作为APC. 对总CD4+T细胞再通过抗CD25的磁珠阳性分选, 将CD4+CD25+T细胞与CD4+CD25-T细胞分开.
分别取CD4+CD25+T细胞、CD4+CD25-T细胞, 或两者按1:1混合, 以及APC各1×105个细胞, 共同培养, 同时加入10 mg/L抗HCV抗原肽(包括C区、NS3区、NS4a区和NS5a区)共同培养5 d, 在培养结束前16 h加入3H-TdR, 收集细胞, 在液闪计数仪上测每分钟脉冲数.
1.2.3 细胞内因子检测: 检测细胞内因子IL-4和IFN-γ, 取CD4+CD25-T细胞, CD4+CD25+T细胞, 或与CD4+CD25-T细胞相混合, 加入20 mg/L HCV抗原合成肽, 37 ℃, 50 mL/L CO2培养6 h. 培养开始1h后, 每孔加入0.7 mg/L BFA. 收集培养细胞, 经Fix&Perm固定通透细胞后, 加入PE标记的IFN-γ抗体和IL-4抗体, 阴性对照管加PE标记的大鼠IgG1和小鼠IgG1同型抗体对照, 4 ℃避光放置30 min; 洗涤后, 重悬于500 µL PBS中, 经FACSCalibur流式细胞仪检测.
1.2.4 Foxp3的mRNA检测: 采用RT-PCR检测Foxp3的mRNA的表达. 取1×105个细胞, 用柱分离法抽提RNA, 用DEPC处理过的水将RNA稀释为1 mg/L. FoxP3引物为: forward, 5'-TCACCTACGCCACGCTCAT, reverse, 5'-ACTCAGGTTGTGGCGGATGG. 反应条件: 逆转录50 ℃ 30 min; 95 ℃ 15 min灭活逆转录酶; PCR循环条件为, 95 ℃ 60 s, 53 ℃ 60 s, 72 ℃ 60 s; 72 ℃ 10 min终延伸. 同时设β-actin作为内参照.
统计学处理 采用SPSS 10.1软件通过Mann-Whitney U检验分析比较丙型肝炎患者和正常对照 CD4+CD25+Treg细胞的数量的差异, 其中两组之间的关系采用非参数Speaman相关性分析.
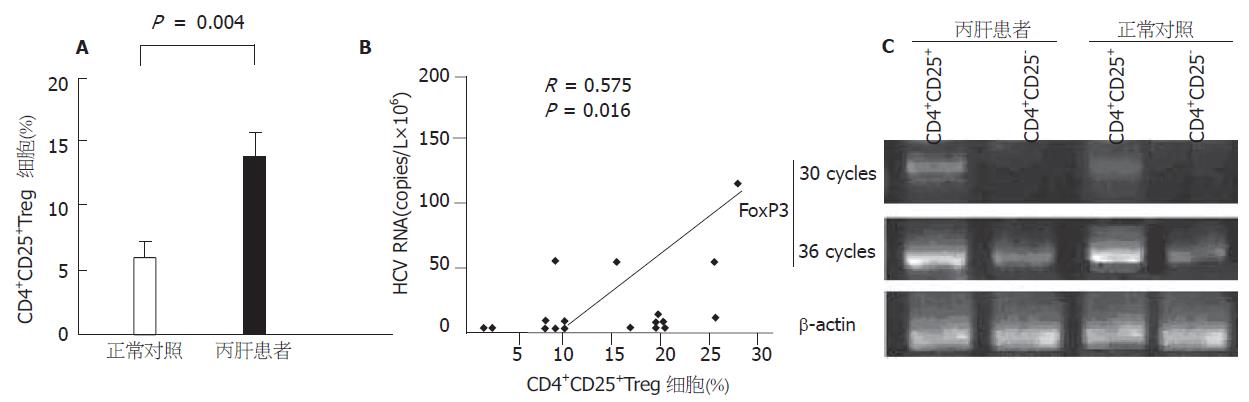
丙型肝炎患者外周血中CD4+CD25+CD45RO+T细胞约占CD4+T细胞14.1±1.6%, 明显高于正常人外周血中 CD4+CD25+CD45RO+T细胞约占CD4+T细胞的(5.3±0.8)% (P = 0.004<0.01)(图1A). 同时慢性丙型肝炎患者CD4+CD25+Treg细胞, 后者的数量与HCV RNA滴度之间呈正相关性(R = 0.575, P = 0.016<0.05)(图1B). CD4+CD25+T细胞表达一种转录因子Foxp3, 并可作为其一种较为特异性的分子标记[9]. 我们的研究证实, 用RT-PCR扩增Foxp3 mRNA后, 当循环次数降到30时, 仅见CD4+CD25+T细胞表达Foxp3, 并且丙肝患者较正常对照表达增高(图1C).
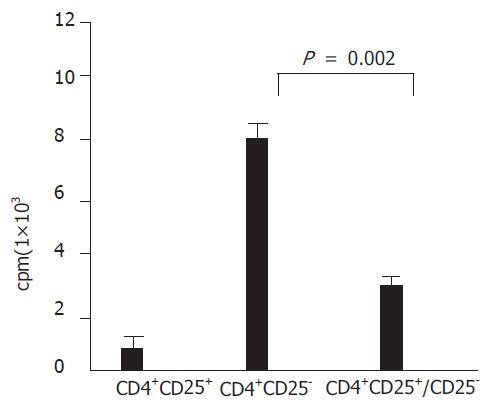
CD4+CD25+Treg细胞具有免疫低反应性, CD4+CD25+Treg细胞不发生增殖, 增殖能力显著低于CD4+CD25-T细胞. 经HCV抗原活化后, CD4+CD25+Treg细胞对CD4+CD25-T细胞的增殖功能具有显著的抑制效应(P = 0.002<0.01)(图2).
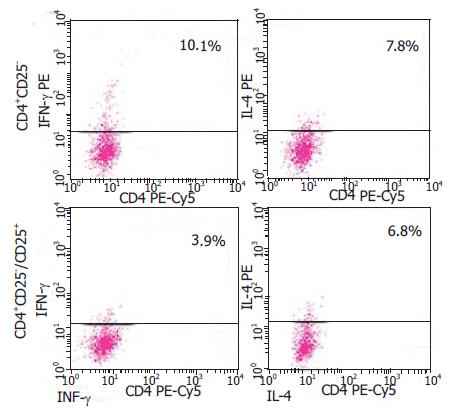
取CD4+CD25-T细胞或CD4+CD25-T细胞与CD4+CD25+T细胞相混合, 用HCV抗原刺激培养. 在加入CD4+CD25+T细胞的一组合成IFN-γ的CD4+T细胞显著减少, 而对IL-4数量影响并不明显(图3). 由此提示, 在持续性HCV感染过程中CD4+CD25+T细胞主要抑制HCV特异性Th1细胞反应.
在持续性HCV感染患者外周血中一群具有免疫抑制功能的CD4+CD25+Treg细胞表达上调, 不仅数量增加, 而且功能也较正常人CD4+CD25+Treg细胞增强, 并显著抑制CD4+T细胞的增殖, 以及HCV特异性CD4+T细胞合成IFN-γ. 由此提示, CD4+CD25+Treg细胞介导的免疫抑制作用在持续性HCV感染过程中起着重要作用. CD4+CD25+Treg细胞是一类具有免疫抑制功能抑制性T细胞群, 特征性地表达IL-2的α链(CD25). CD4+CD25+ Treg细胞主要分泌细胞因子IL-10和TGF-β, 活化后的细胞表面分子CTLA-4表达增加, 表达转录因子Foxp3[10]. CD4+CD25+Treg细胞具有免疫低反应性, 多表现为记忆细胞表型(CD45RO+). 经多克隆激活剂或特异性抗原激活后, CD4+CD25+Treg细胞能够通过依赖细胞接触的方式抑制CD4+和CD8+T细胞的增生、分化, 以及分泌细胞因子[11]. 已有研究表明, 在多种病原体的慢性感染中, 都能够诱导宿主上调表达CD4+CD25+Treg细胞, 抑制抗原特异性CD4+T细胞反应, 而去除CD4+CD25+Treg细胞能够显著降低这些病原体的感染率[6-8]. Sugimoto et al[12]研究指出, 在慢性HCV感染患者体内CD4+CD25+Treg细胞的数量明显高于恢复患者(7.3% vs 2.5%, P = 0.002), 而正常对照则为3.6%(P = 0.017). 体外研究显示, CD4+CD25+Treg细胞能够抑制HCV特异性CD8+T细胞的增殖. 以及最近研究报道, CD4+CD25+Treg细胞能够调变持续性HCV中的细胞免疫反应[13]. 多项研究表明, HCV特异性Th1细胞在控制急性HCV感染中起着重要作用, 慢性患者多表现为HCV特异性CD4+T细胞数量减少、增殖功能减弱, 以及分泌Th1型细胞因子(IFN-γ)功能降低等[3,14-17], 但尚未阐明其发生机制. 本组研究数据表明, CD4+CD25+Treg细胞不仅抑制慢性丙型肝炎患者CD4+T细胞的增殖, 并显著抑制HCV特异性Th1细胞反应(IFN-γ), 对Th2细胞反应(IL-4)的抑制作用不明显. 或许这将有助于解释为什么在慢性HCV感染以及其它慢性病原体感染中存在Th细胞极化异常现象. 当机体感染病原体时, 多种微生物的分子及其代谢产物都能够作用静止APC上的TLR(Toll-like receptors), 如作用后的APC不能分化成熟, 则诱导初始CD4+T细胞表达转录因子Foxp3, 分化为CD4+CD25+Treg细胞, 从而抑制效应T细胞的应答[18]. 本研究也表明, CD4+CD25+Treg细胞高表达Foxp3, 可作为CD4+CD25+Treg细胞一种特异性标记. 总之, 持续性HCV感染患者外周血中一群具有免疫抑制功能的CD4+CD25+Treg细胞数量增加, 显著抑制CD4+T细胞的增殖, 以及HCV特异性Th1细胞反应. 因而提示, CD4+CD25+Treg细胞在丙型肝炎慢性化过程中起着免疫调节作用. 这为进一步研究在持续性HCV感染中如何调控CD4+CD25+Treg细胞的功能奠定了基础.
电编: 李琪 编辑:潘伯荣 审读:张海宁
| 1. | Frank C, Mohamed MK, Strickland GT, Lavanchy D, Arthur RR, Magder LS, El Khoby T, Abdel-Wahab Y, Aly Ohn ES, Anwar W. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000;355:887-891. [PubMed] [DOI] |
| 2. | Chang KM. Immunopathogenesis of hepatitis C virus infection. Clin Liver Dis. 2003;7:89-105. [PubMed] [DOI] |
| 3. | Gerlach JT, Diepolder HM, Jung MC, Gruener NH, Schraut WW, Zachoval R, Hoffmann R, Schirren CA, Santantonio T, Pape GR. Recurrence of hepatitis C virus after loss of virus-specific CD4(+) T-cell response in acute hepatitis C. Gastroenterology. 1999;117:933-941. [PubMed] [DOI] |
| 4. | Tsai SL, Liaw YF, Chen MH, Huang CY, Kuo GC. Detection of type 2-like T-helper cells in hepatitis C virus infection: implications for hepatitis C virus chronicity. Hepatology. 1997;25:449-458. [PubMed] [DOI] |
| 5. | MacDonald AJ, Duffy M, Brady MT, McKiernan S, Hall W, Hegarty J, Curry M, Mills KH. CD4 T helper type 1 and regulatory T cells induced against the same epitopes on the core protein in hepatitis C virus-infected persons. J Infect Dis. 2002;185:720-727. [PubMed] [DOI] |
| 6. | Hisaeda H, Maekawa Y, Iwakawa D, Okada H, Himeno K, Kishihara K, Tsukumo S, Yasutomo K. Escape of malaria parasites from host immunity requires CD4+ CD25+ regulatory T cells. Nat Med. 2004;10:29-30. [PubMed] [DOI] |
| 7. | Mendez S, Reckling SK, Piccirillo CA, Sacks D, Belkaid Y. Role for CD4(+) CD25(+) regulatory T cells in reactivation of persistent leishmaniasis and control of concomitant immunity. J Exp Med. 2004;200:201-210. [PubMed] [DOI] |
| 8. | Aandahl EM, Michaëlsson J, Moretto WJ, Hecht FM, Nixon DF. Human CD4+ CD25+ regulatory T cells control T-cell responses to human immunodeficiency virus and cytomegalovirus antigens. J Virol. 2004;78:2454-2459. [PubMed] [DOI] |
| 9. | Fontenot JD, Gavin MA, Rudensky AY. Foxp3 programs the development and function of CD4+CD25+ regulatory T cells. Nat Immunol. 2003;4:330-336. [PubMed] [DOI] |
| 10. | Baecher-Allan C, Brown JA, Freeman GJ, Hafler DA. CD4+CD25high regulatory cells in human peripheral blood. J Immunol. 2001;167:1245-1253. [PubMed] [DOI] |
| 11. | Asseman C, von Herrath M. About CD4pos CD25pos regulatory cells. Autoimmun Rev. 2002;1:190-197. [PubMed] [DOI] |
| 12. | Sugimoto K, Ikeda F, Stadanlick J, Nunes FA, Alter HJ, Chang KM. Suppression of HCV-specific T cells without differential hierarchy demonstrated ex vivo in persistent HCV infection. Hepatology. 2003;38:1437-1448. [PubMed] [DOI] |
| 13. | Cabrera R, Tu Z, Xu Y, Firpi RJ, Rosen HR, Liu C, Nelson DR. An immunomodulatory role for CD4(+)CD25(+) regulatory T lymphocytes in hepatitis C virus infection. Hepatology. 2004;40:1062-1071. [PubMed] [DOI] |
| 14. | Ulsenheimer A, Gerlach JT, Gruener NH, Jung MC, Schirren CA, Schraut W, Zachoval R, Pape GR, Diepolder HM. Detection of functionally altered hepatitis C virus-specific CD4 T cells in acute and chronic hepatitis C. Hepatology. 2003;37:1189-1198. [PubMed] [DOI] |
| 15. | Rosen HR, Miner C, Sasaki AW, Lewinsohn DM, Conrad AJ, Bakke A, Bouwer HG, Hinrichs DJ. Frequencies of HCV-specific effector CD4+ T cells by flow cytometry: correlation with clinical disease stages. Hepatology. 2002;35:190-198. [PubMed] [DOI] |
| 16. | Kantzanou M, Lucas M, Barnes E, Komatsu H, Dusheiko G, Ward S, Harcourt G, Klenerman P. Viral escape and T cell exhaustion in hepatitis C virus infection analysed using Class I peptide tetramers. Immunol Lett. 2003;85:165-171. [PubMed] [DOI] |