修回日期: 2005-07-20
接受日期: 2005-07-28
在线出版日期: 2005-09-15
自身免疫性肝炎是一种慢性进行性炎症性肝病, 女性多见, 免疫抑制剂治疗有效.临床上主要分为两型: 抗平滑肌抗体和(或)抗核抗体阳性为1型, 抗肝肾微粒体抗体1阳性为2型.发病机制目前尚不完全清楚.其遗传易感性可能与特异性人类白细胞抗原等位基因HLADRB1*0301、*0401 、*0404和*0405等有关.触发肝细胞免疫反应的机制以交叉反应性分子模拟机制为主: 外来抗原如病毒等与肝自身抗原结构相似而发生交叉反应, 免疫调节受损.近来报道自身免疫性肝炎也可继发于肝移植后, 其机制尚待进一步研究.
引文著录: 鲍启德, 崔东来, 杨兰兰. 自身免疫性肝炎发病机制研究进展. 世界华人消化杂志 2005; 13(17): 2119-2121
Revised: July 20, 2005
Accepted: July 28, 2005
Published online: September 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2119-2121
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2119.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2119
自身免疫性肝炎(AIH)是一种病因未明的慢性进行性炎症性肝病, 组织学表现为汇管区大量单核细胞浸润, 血清学表现为非肝特异性循环自身抗体的出现, 转氨酶升高, γ球蛋白或IgG升高.目前临床上主要分成两大类型: 抗核抗体(ANA)和(或)抗平滑肌抗体(SMA)阳性为1型, 抗肝肾微粒体抗体1(LKM1)阳性为2型.AIH的诊断需综合临床表现、血清学和免疫学特征并排除其他肝损伤的因素后方能得出, 诊断一经明确必须治疗, 免疫抑制剂通常有效.本病以女性多见.目前其发病机制尚不完全清楚, 我们综述AIH发病机制的研究现状与进展.
早在1965年, Mackay就提出AIH可能存在遗传基础, 这种设想被后来的学者证实.最近研究表明1型AIH有很强的遗传易感性, 氨基酸序列分析发现: 人类白细胞抗原(HLA)DR3(DRB1﹡0301)和HLADR4(DRB1﹡0401)是北欧白种人1型AIH的两个独立易感等位基因, 其β链在67-72位的氨基酸序列相同, 均为LLEQKR, 在第71位为一个赖氨酸(K)残基.日本、阿根廷和墨西哥人的易感等位基因是DRB1﹡0405和DRB1﹡0404, 其第71位氨基酸是精氨酸(R)而非赖氨酸, 但两类人种享有共同的氨基酸基序LLEQ-R, 因此在第71位的K或R就成为1型AIH的重要危险因子[1].
目前初步的资料显示2型AIH的发生可能与HLADR7有关.但相关研究资料较少.
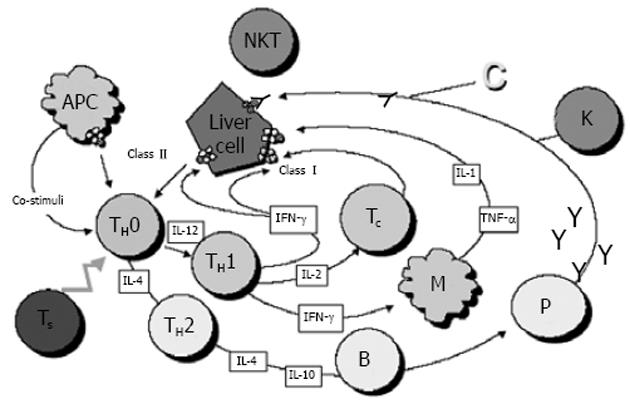
免疫组织化学研究证实AIH患者肝组织中炎症细胞的类型主要是表达α/β受体的T细胞, 其中多数是CD4阳性的辅助型/诱导型, 少数是CD8阳性的细胞毒型/抑制型.次要的炎症细胞有杀伤/自然杀伤细胞(CD16/CD56)、巨噬细胞和B细胞等.炎症细胞介导的免疫攻击性肝损伤的可能途径是: 特异性自身抗原肽被HLA2型分子识别并结合成复合物, 被抗原提呈细胞(APC)提呈给未分化的TH0细胞, 并将其激活, 活化的TH0随后分化为TH1和TH2两个亚型, TH2主要分泌白细胞介素-4(IL-4)和IL-10, 并促进B细胞生成抗体; TH1分泌IL-2和γ-干扰素、刺激细胞毒型T细胞、增强HLA1型并诱导HLA2型分子在肝细胞的表达、刺激巨噬细胞并促使其释放IL-1和肿瘤坏死因子-α(TNF-α)等细胞因子.如果此时抑制性T细胞功能缺陷, 则多种效应器机制被触发: 细胞毒性T细胞被活化后杀伤肝细胞; TH1细胞分泌细胞因子并募集巨噬细胞, 通过附着于肝细胞表面的自身抗体, 补体被激活, 杀伤性淋巴细胞参与反应(图1)[2].
该图归纳了参与AIH免疫病理损伤机制的一些因子, 由TH1和TH2组成的细胞因子网络调节着机体的免疫反应, 同样影响着自身免疫的发病、临床表现及预后.免疫调节受损成为自身免疫性肝损伤过程中的重要机制.研究显示[3], AIH患者的T细胞亚群存在着抗原特异性缺陷, 尤其是抗原特异性抑制型T细胞(Ts)功能缺陷, 虽然非抗原特异性Ts功能缺陷也见于其他非器官和器官特异性自身免疫性疾病, 但是抗原特异性Ts缺陷似乎对AIH的免疫损伤更为重要.
与正常肝细胞不同, AIH患者的肝细胞可表达HLA2型分子, 虽然缺乏APC典型的抗原处理机制, 但可通过其他途径呈递抗原肽.因此, 免疫调节机制受损, 肝细胞异常表达HLA2型分子, 自身抗原肽被呈递给辅助型/诱导型T细胞, 使T细胞被激活, 这些被激活的T细胞呈CD4阳性, 在疾病活跃期数量最多.虽然目前尚缺乏自身抗原肽被呈递和识别的证据, 但已有T细胞被激活的报道[4].
研究发现[5], 来自AIH患者肝活检的表达γ/δ受体的T细胞克隆, 对多种靶细胞具有杀伤作用, 但与其他器官细胞株相比, 对肝细胞具有优先杀伤力.最近自然杀伤性T细胞(NKT)已被认为是一个特殊的细胞群, 同时表达NK细胞标志CD56和T细胞标志CD3.虽然NKT出现于正常肝中, 但可能参与了肝脏的病理反应过程.其在肝脏的分布状态及在AIH发生中的作用尚待进一步研究.在伴刀豆素蛋白诱导的小鼠AIH模型, NKT表达的Fas配体与肝损伤有关, 而缺乏Fas配体, 疾病发展迟滞.
肝特异性膜蛋白(LSP)是肝细胞膜上的一类大分子复合体, 作为其主要特征性成分之一的去唾液酸糖蛋白受体(ASGPR)可能是吸引致敏肝浸润淋巴细胞的主要靶抗原.各型AIH均可见其抗体(抗-ASGPR), 其滴度与AIH严重性相关; 最近发现LSP的另一特征性成分乙醇脱氢酶(ADH)亦出现在AIH的发生过程中[6].对AIH患者的肝细胞单分散悬液进行免疫荧光研究, 发现所有细胞均被抗体包被, 细胞毒性实验显示将被抗体包被的肝细胞与同源或异源的淋巴细胞一起孵育时, 肝细胞被杀伤.自身抗体在AIH发生中的作用于此可见一斑[7], 其中的效应细胞被证实为Fc受体阳性的单核细胞[8].
AIH细胞株的建立和克隆显示, 来源于外周血的多数T细胞克隆和肝脏的部分T细胞克隆是CD4阳性并表达α/β受体[9], 进一步研究发现, 这些CD4阳性T细胞克隆与LSP、ASGPR或CYP2D6二聚体的反应被HLA2型分子限制.鉴于CD4是辅助型T细胞的表现型, Wen et al[9,10]为证实是否这些克隆有助于同源B细胞产生免疫球蛋白, 将CD4阳性T细胞克隆与B细胞一起培养, 发现自身抗体的产生大量增加.
适应性免疫系统的核心问题是产生T、B淋巴细胞, 二者可特异性的识别大量潜在的非自身性抗原.这种随机产生的大量的特异性T、B细胞经克隆扩增和募集效应器机制而识别其特异性抗原.尽管已经清楚该系统并不能完全应对外来抗原的多样性, 但是过去10年的研究表明, 交叉反应作为免疫发生的本质属性发挥了重要作用.关于交叉反应首先是对T细胞的研究, T细胞的修饰肽配体(APL)结构与初次遇到的肽抗原的结构相似, 既能诱导刺激性又能诱导抑制性T细胞反应.事实上, 正是APL主导着胸腺内T细胞库的选择.这意味着单个T细胞不仅只对单一抗原发生特异性反应, 而且能够对大量抗原发生交叉反应.免疫系统抗原特异性的扩展已足以反映外部环境抗原多样性水平.
2型AIH的特征是血清LKM1抗体阳性, LKM1抗体的靶抗原是细胞色素P4502D6, 是细胞色素P450酶家族成员之一.由于LKM1抗体与2型AIH联系紧密, 且最近报道肝细胞膜表达CYP2D6, 因此LKM1抗体被认为是AIH的一个重要的致病因子[11].值得注意的是LKM1抗体同样在至少10%的丙型肝炎病毒(HCV)感染者中被发现, 与疾病的严重性相关, 干扰素疗效差[12], 且少数LKM1抗体阳性的2型AIH患者同时合并有HCV感染, 目前尚不清楚HCV感染在AIH发生中的作用, 但是二者在临床上有可区别之处: 作为AIH首选治疗的免疫抑制剂, 如用于HCV感染有害无益, 而干扰素用于治疗AIH, 反而有诱发加重自身免疫性疾病的危险.在1型AIH患者中, LKM1抗体识别CYP2D6的线性表位主要在第257-269之间(85%).有人报道[13]CYP2D6193-212作为B细胞的主要表位被93%的2型AIH患者和50%的LKM1抗体阳性的HCV感染者识别.又有研究显示[14], HCV和巨细胞病毒(CMV)的交叉反应抗体的识别同源区在LKM1抗体阳性的HCV感染者所识别的区域内(CYP2D6204-209).因此有人试图用交叉反应机制来阐述LKM1抗体的产生.Manns et al[15]推测LKM1抗体识别CYP2D6的活动来源于与HCV或单纯疱疹病毒(HSV)的交叉反应, 其理由是E1HCV的310-324和IE175HSV1的156-170氨基酸序列与CYP2D6免疫决定区254-271氨基酸序列享有序列同源.该假设虽有吸引力, 但仍缺少实验室证据.最新研究[16]显示LKM1抗体阳性的HCV感染者同时存在着对CYP2D6254-271和E1HCV的310-324高度特异性的刺激性抗体活动, 对比研究提示这种"倍增"活动是交叉反应.
由于LKM1抗体可与CYP2D6、HCV、HSV和CMV的同源区发生交叉反应, 因此有关LKM1抗体产生和AIH发生的"复合攻击"机制逐渐受到重视: 最初的CMV或HSV等病毒感染触发T细胞发生交叉反应的某一环节, 在易感者体内建立起一种"免疫许可"状态, 一旦合并慢性HCV感染则通过交叉反应机制致LKM1抗体产生, 依赖于遗传易感性的强度, 免疫反应被触发的程度及病原体抗原的剂量, 少数人可能发展为自身免疫性疾病, 因此,推测一个目前尚不为人知的病毒感染构成了免疫攻击的起源, 这与Aich et al[17]提出的自身免疫性疾病是一种暂不知道的病毒性疾病的概念是一致的.
对于1型AIH, 由于疾病特异性自身抗体尚未阐明, 故无法研究其交叉反应.
1998年Kerkar et al[18]首次报道了肝移植后肝功能失调的表现: 自身抗体出现(如ANA、SMA、LKM)、IgG升高、慢性肝炎的组织学表现(如静脉周围细胞坏死, 桥接性纤维化和塌陷), 与典型的AIH表现一致, 按AIH的标准疗法治疗有效, 抗排斥反应治疗无效等.随后又有一些研究证实了该现象.但至今尚无一个对此确切的定义和命名.有人称之为"移植后免疫性肝炎", 也有人称为"模拟AIH移植功能失调", 我们暂称为肝移植后继发性AIH(De novo autoimmune hepatitis after liver transplantation).
该病的发生机制尚不清楚, 相关的解释也较多.除受损组织抗原释放外, 另一可能机制是分子模拟: 感染病毒抗原与自身抗原享有同源氨基酸序列, 发生交叉反应性模拟[14], Salcedo et al[19]观察到他们的所有继发性AIH患者都合并有CMV、EB病毒、麻疹病毒感染, 支持后一解释.此外, 病毒感染作为肝移植后的常见现象, 可能还有一些其他的致自身免疫的机制, 如多克隆刺激、MHC1型和2型抗原膜表达的增强和诱导、干扰免疫调节细胞和(或)独特型/抗独特型网络等.与之相呼应的动物实验[19]表明, 给予钙调磷酸酶阻断剂, 易发生自身免疫和自身免疫性疾病, 可能与干扰T细胞成熟、干扰自身反应性T细胞克隆的发生与活化有关.钙调磷酸酶诱导的自身免疫有一个较强的未被MHC编码的基因成分[20].
最近发现, 肝移植后继发性AIH患者体内出现针对谷胱甘肽-S-转移酶T1的抗体[21], 由于五分之一的高加索人存在编码该酶的基因缺陷, 继发AIH患者体内先天缺失该基因编码的酶, 而所有供者体内该酶阳性, 据此推测, 移植性功能失调可能来源于患者将获得的谷胱甘肽-S-转移酶T1作为异物的识别反应.肝移植后继发性AIH究竟是免疫攻击还是排斥反应的一种形式, 尚待进一步研究确定.
编辑: 王谨晖 审读: 张海宁
| 1. | Czaja AJ, Donaldson PT. Genetic susceptibilities for immune expression and liver cell injury in autoimmune hepatitis. Immunol Rev. 2000;174:250-259. [PubMed] [DOI] |
| 2. | Vergani D, Mieli-Vergani G. Mechanisms of autoimmune hepatitis. Pediatr Transplant. 2004;8:589-593. [PubMed] [DOI] |
| 3. | Vento S, Hegarty JE, Bottazzo G, Macchia E, Williams R, Eddleston AL. Antigen specific suppressor cell function in autoimmune chronic active hepatitis. Lancet. 1984;1:1200-1204. [PubMed] [DOI] |
| 4. | Senaldi G, Portmann B, Mowat AP, Mieli-Vergani G, Vergani D. Immunohistochemical features of the portal tract mononuclear cell infiltrate in chronic aggressive hepatitis. Arch Dis Child. 1992;67:1447-1453. [PubMed] [DOI] |
| 5. | Takeda K, Hayakawa Y, Van Kaer L, Matsuda H, Yagita H, Okumura K. Critical contribution of liver natural killer T cells to a murine model of hepatitis. Proc Natl Acad Sci USA. 2000;97:5498-5503. [PubMed] [DOI] |
| 6. | Ma Y, Gaken J, McFarlane BM, Foss Y, Farzaneh F, McFarlane IG, Mieli-Vergani G, Vergani D. Alcohol dehydrogenase: a target of humoral autoimmune response in liver disease. Gastroenterology. 1997;112:483-492. [PubMed] [DOI] |
| 7. | Vergani D, Mieli-Vergani G, Mondelli M, Portmann B, Eddleston AL. Immunoglobulin on the surface of isolated hepatocytes is associated with antibody-dependent cell-mediated cytotoxicity and liver damage. Liver. 1987;7:307-315. [PubMed] [DOI] |
| 8. | Vergani GM, Vergani D, Jenkins PJ, Portmann B, Mowat AP, Eddleston AL, Williams R. Lymphocyte cytotoxicity to autologous hepatocytes in HBsAg-negative chronic active hepatitis. Clin Exp Immunol. 1979;38:16-21. [PubMed] |
| 9. | Wen L, Peakman M, Lobo-Yeo A, McFarlane BM, Mowat AP, Mieli-Vergani G, Vergani D. T-cell-directed hepatocyte damage in autoimmune chronic active hepatitis. Lancet. 1990;336:1527-1530. [PubMed] [DOI] |
| 10. | Lohr H, Treichel U, Poralla T, Manns M, Meyer zum Buschenfelde KH. Liver-infiltrating T helper cells in autoimmune chronic active hepatitis stimulate the production of autoantibodies against the human asialoglycoprotein receptor in vitro. Clin Exp Immunol. 1992;88:45-49. [PubMed] [DOI] |
| 11. | Muratori L, Parola M, Ripalti A, Robino G, Muratori P, Bellomo G, Carini R, Lenzi M, Landini MP, Albano E. Liver/kidney microsomal antibody type 1 targets CYP2D6 on hepatocyte plasma membrane. Gut. 2000;46:553-561. [PubMed] [DOI] |
| 13. | Kerkar N, Choudhuri K, Ma Y, Mahmoud A, Bogdanos DP, Muratori L, Bianchi F, Williams R, Mieli-Vergani G, Vergani D. Cytochrome P4502D6(193-212): a new immunodominant epitope and target of virus/self cross-reactivity in liver kidney microsomal autoantibody type 1-positive liver disease. J Immunol. 2003;170:1481-1489. [PubMed] [DOI] |
| 14. | Bogdanos DP, Choudhuri K, Vergani D. Molecular mimicry and autoimmune liver disease: virtuous intentions, malign consequences. Liver. 2001;21:225-232. [PubMed] [DOI] |
| 15. | Manns MP, Griffin KJ, Sullivan KF, Johnson EF. LKM-1autoantibodies recognize a short linear sequence in P450IID6, a cytochrome P-450 monooxygenase. J Clin Invest. 1991;88:1370-1378. [PubMed] [DOI] |
| 16. | Bogdanos DP, Lenzi M, Okamoto M, Rigopoulou EI, Muratori P, Ma Y, Muratori L, Tsantoulas D, Mieli-Vergani G, Bianchi FB. Multiple viral/self immunological cross-reactivity in liver kidney microsomal antibody positive hepatitis C virus infected patients is associated with the possession of HLA B51. Int J Immunopathol Pharmacol. 2004;17:83-92. [PubMed] [DOI] |
| 17. | Aichele P, Bachmann MF, Hengartner H, Zinkernagel RM. Immunopathology or organ-specific autoimmunity as a consequence of virus infection. Immunol Rev. 1996;152:21-45. [PubMed] [DOI] |
| 18. | Kerkar N, Hadzic N, Davies ET, Portmann B, Donaldson PT, Rela M, Heaton ND, Vergani D, Mieli-Vergani G. De-novo autoimmune hepatitis after liver transplantation. Lancet. 1998;351:409-413. [PubMed] [DOI] |
| 19. | Salcedo M, Vaquero J, Banares R, Rodriguez-Mahou M, Alvarez E, Vicario JL, Hernandez-Albujar A, Tiscar JL, Rincon D, Alonso S. Response to steroids in de novo autoimmune hepatitis after liver transplantation. Hepatology. 2002;35:349-356. [PubMed] [DOI] |
| 20. | Sakaguchi S, Sakaguchi N. Role of genetic factors in organ-specific autoimmune diseases induced by manipulating the thymus or T cells, and not self-antigens. Rev Immunogenet. 2000;2:147-153. [PubMed] |
| 21. | Aguilera I, Wichmann I, Sousa JM, Bernardos A, Franco E, Garcia-Lozano JR, Nunez-Roldan A. Antibodies against glutathione S-transferase T1 (GSTT1) in patients with de novo immune hepatitis following liver transplantation. Clin Exp Immunol. 2001;126:535-539. [PubMed] [DOI] |