修回日期: 2005-07-25
接受日期: 2005-08-03
在线出版日期: 2005-09-15
目的: 研究去甲基化5-氮杂2'-脱氧胞苷(5-Aza-CdR)对SW48结肠腺癌细胞株生长周期及凋亡的影响, 探讨其临床治疗的可能性.
方法: 分别使用浓度为0.4, 1.6, 6.4, 25.6, 102.4 μmol/L特异型DNA甲基转移酶抑制剂5-Aza-CdR处理大肠腺癌细胞株.通过MTT来检测5-Aza-CdR对大肠癌细胞株存活率的影响. 应用流式细胞检测甲基化5-Aza-CdR对SW48结肠腺癌细胞株生长周期及凋亡的影响. RT-PCR检测处理前后抑癌基因RASSF1A mRNA表达的改变.
结果: 5-氮杂2'-脱氧胞苷在1.6 μmol/L就可以明显的抑制SW48结肠腺癌细胞的增殖, 细胞周期中处于G0/G1期的细胞明显的增多, 阻滞于G1期, 凋亡率增高, 而且以上作用与药物作用浓度, 时间在一定范围内呈正相关. 5-Aza-CdR处理后, 无RASSF1A表达的SW48结肠腺癌细胞株可检测出基因RASSF1A的重新表达.
结论: 5-氮杂2'-脱氧胞苷可消除某些抑癌基因启动子甲基化状态, 使其重新表达而抑制SW48结肠腺癌细胞株的生长, 并促进其凋亡.
引文著录: 李秀梅, 刘南植, 倪志, 张庆, 洪玮. 5-氮杂-2'-脱氧胞苷对SW48结肠腺癌细胞生物学行为的影响. 世界华人消化杂志 2005; 13(17): 2094-2097
Revised: July 25, 2005
Accepted: August 3, 2005
Published online: September 15, 2005
AIM: To explore the effect of demethylating agent 5-Aza-2'-deoxycytidine (5-Aza-CdR) on the growth of human colonic carcinoma cell line SW48, and to investigate the possibility of its application in clinical treatment.
METHODS: Human colonic carcinoma SW48 cells were treated with 0.4, 1.6, 6.4, 25.8, and 102.4 µmol/L 5-Aza-CdR, respectively. Then the growth of the cells was observed by MTT assay. The cell cycle and apoptosis were analyzed by flow cytometry. The expression of the tumor suppressor gene RASSF1A mRNA was detected by reverse transcription polymerase chain reaction (RT-PCR).
RESULTS: 5-Aza-CdR inhibited the proliferation of SW48 cells in a time- and concentration-dependent manner (1-5 d, 0.4-102.4 µmol/L). After 5-Aza-CdR treatment, the number of G0/G1 cells was increased, and 5-Aza-CdR blocked the cell cycle at G1 phase. The apoptotic rate was also increased significantly. RASSF1A gene was reactivated by 5-Aza-CdR in SW48 cells not expressing RASSF1A.
CONCLUSION: 5-Aza-CdR can inhibit the growth, and promote the apoptosis of SW48 cells by eliminating the methylation status of RASSF1A promoter.
- Citation: Li XM, Liu NZ, Ni Z, Zhang Q, Hong W. Effect of demethylating agent 5-Aza-2'-deoxycytidine on human colonic carcinoma cell line SW48. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2094-2097
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2094.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2094
大肠癌的发生发展中DNA甲基化调节基因表达与某些抑癌基因高甲基化失活已得到广泛证实[1-4].在癌变过程中,使异常甲基化逆转,特别是癌变早期的转变对肿瘤的防治尤为重要. 体外实验已证实甲基转移酶抑制剂5-氮杂2′-脱氧胞苷(5-Aza-2′-deoxycytidine)通过去甲基化作用可使多种CpG 岛高甲基化的抑癌基因重新表达, 从而恢复抑癌功能. RASSF1A是2000年报道从3号染色体短臂克隆出来的肺癌新型候选抑癌基因[5-6],我们采用MTT,及流式细胞仪来分别观察甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷对人结肠腺癌细胞的成活率, 及细胞周期、凋亡率的影响.并对RASSF1A转录本的表达情况进行了研究, 探讨5-氮杂-2′-脱氧胞苷应用于结肠癌临床治疗的可能性.
人结肠腺癌细胞株SW48由华中科技大学同济医学院附属协和医院普外科惠赠, 用含100 mL/L小牛血清、100 kU/L链霉素和青霉素的RPMI1640培养基, 在37℃,50 mL/L的CO2,湿度饱和的条件下培养.5-Aza-CdR(Sigma, USA)用三蒸水充分溶解成储存液, -70℃保存.取对数生长期的结肠腺癌细胞, 用2.5 g/L胰蛋白酶消化癌细胞成单细胞悬液, 于显微镜下记数, 按2×106/L培养传代, 24 h后分别用0.4,1.6,6.4,25.6,102.4 µmol/L(实验组1-5)浓度的特异型DNA甲基转移酶抑制剂5-氮杂-2′-脱氧胞苷(5-Aza-CdR)处理, 24 h后弃去药液并重新更换含新鲜培养液的药液, 浓度同前, 连续作用3 d后弃去药液, 用完全培养液继续培养4 d后进行实验, 以同体积的不含药液的培养液处理的细胞作对照组.培养过程中用相差显微镜观察细胞形态变化.
1.2.1 MTT法绘制生长曲线: 药液处理前后的细胞继续培养4 d, 按每孔3×103个细胞接种于96孔板, 每孔200 µL, 每4个孔为一组, 共接种5个板, 阴性对照组只换液, 不加药.空白对照组是不含细胞的.放入培养箱中继续培养, 每天取出一板, 每孔加入5 g/L MTT溶液20 µL, 37℃作用4 h后弃去, 用PBS漂洗2次, 加入DMSO 150 µL, 振荡器振荡15 min充分溶解结晶,置酶标免役检测仪上测定波长为570 nm下的A值(OD值), 最后以细胞生存率为纵坐标, 以时间(d)为横坐标, 绘制不同浓度的5-Aza-CdR作用下的生长曲线.按以下公式计算细胞生存率.细胞生存率(%)=(试验组A值-空白对照组A值)/(阴性对照组-空白对照组)×100%.
1.2.2 细胞周期和凋亡率检测: 收集经药物处理前后培养的细胞, PBS漂洗2次, 调整细胞密度为每1×109/L个细胞, 700 ml/L的冰已醇5mL-20℃固定24 h以上,加入RNaseA至终浓度为1 g/L, 37℃温育30 min, 加入碘化丙啶(PI)至终浓度50 mg/L, 1 h内测定, 以流式细胞仪进行细胞周期和凋亡率的分析.
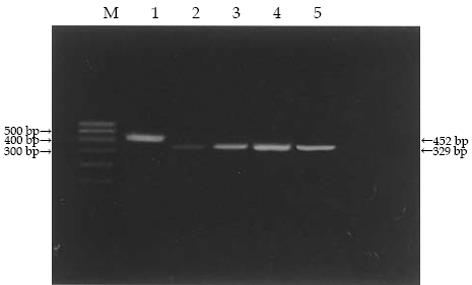
1.2.3 RT-PCR检测用药前后RASSF1A基因mRNA表达: 用TRIzol试剂一步法提取经5-Aaz-CdR处理和未经处理细胞的总RNA, 以OligodT为引物逆转录(Promega,USA),取2 µg总RNA进行纯化: 1 µL 10×reaction Buffer with MgCl2 , 1 µL DNaseI,DEPC水加到10 µL, 37℃ 30 min , 1 µL 2.5 mmol/L EDTA,65℃ 10 min, 1 µL OligodT18轻混, 70℃孵育5 min,离心, 收集到管底, 置冰上依次加入5×M-MLV Buffer 5 µL,dNTPmix 1.25 µL,M-MLV 1 µL,RNasin 0.5 µL,DEPC水至25 µL, 42℃ 60 min,72℃孵育15 min. 25 µL的PCR体系: 10×PCR Buffer 2.5 µL,dNTPmix 0.5 µL,MBI TaqDNA polymerase 0.625 µL,灭菌蒸馏水至20.5 µL, primer1(10 µmoL/L) 1 µL, primer2(10 µmoL/L) 1 µL ,Mgcl2 1.5 µL,cDNA 1 µL. 以RASSF1A特异引物进行PCR扩增, 因为GAPDH在组织中稳定表达[7],所以以GAPDH 为内参照.RASSF1A引物序列参考[8]: 5'-GGCGTCGTGCGCAAAGGCC-3′(sense)和5'-GGGTGGCTTCTTGCTGGAGGG-3′(antisense).扩增片断为329 bp,内参照GAPDH的上游引物序列为: 5'-ACCACAGTCCATGCCATCAC-3′;下游引物序列为: 5'-TCCACCACCCTGTTGCTGTA-3′;产物长度452 bp, 反应条件: 在95℃变性5 min后, 按94℃变性30 s,56℃退火30 s,72℃延伸60 s ,共35个循环.最后72℃延伸5 min .扩增产物于20 g/L琼脂糖凝胶电泳,观察.
统计学处理 试验数据分析采用SPSS软件对相关数据行F检验, 及t检验.
在倒置显微镜下观察5-AZA-CDR处理前后癌细胞的变化, 可见癌细胞体积缩小, 死亡, 细胞密度减少.经MTT检测,发现5-Aza-CdR对SW48腺癌细胞增殖的抑制作用呈剂量和时间依赖性, 经方差分析同一作用时间的不同药物浓度组之间的细胞生存率差异均有显著性意义(P<0.01);同一药物浓度的不同作用时间组之间的细胞生存率差异也有显著性意义(P<0.01).在一定范围内随着剂量的增高和作用时间的延长, 对SW48结肠腺癌细胞增殖的抑制作用越明显(表1).
| 药物溶度(µmoL/L) | 1 d | 2 d | 3 d | 4 d | 5 d |
| 0.4 | 98 | 95 | 93 | 92 | 91 |
| 1.6 | 90 | 84 | 75 | 66 | 53 |
| 6.4 | 80 | 74 | 69 | 56 | 40 |
| 25.8 | 72 | 43 | 30 | 12 | 6 |
| 102.4 | 49 | 40 | 9 | 8 | 5 |
2.2 5-AZA-CDR使细胞生长停滞在G0/G1期, 增高癌细胞凋亡的发生率, 以上作用呈剂量依赖性, 经流式细胞仪检测分析, 对照组0 µmoL/L的凋亡率为1.78%, 而6.4 µmoL/L5-AZA-CDR处理组的凋亡率为49.25%, 两者间有明显的统计学差异(aP<0.05)(表2).当浓度达到102.4 µmoL/L时, 更多的细胞表现为细胞坏死而不是凋亡, 因为成活细胞过少未能做流式细胞术检测.
RASSF1A基因mRNA的表达 经5-AZA-CDR处理培养后, 没有RASSF1A mRNA表达的SW48大肠癌细胞株可检测到RASSF1A mRNA的重新表达(图1).
5-AZA-CDR治疗复发性和顽固性急性白血病和慢性髓性白血病危象具明显疗效,在实体瘤中的作用尚不清楚[9].肿瘤中基因组甲基化改变常见两种方式: 一方面DNA广泛性低甲基化导致染色体不稳定性,从而引起基因突变; 另一方面,位于抑癌基因启动子区CPG 岛高甲基化异常,引起基因表达沉默,细胞异常增殖导致恶化.同时基因甲基化异常可通过一种凋亡途径对化疗药物产生耐受,作用机制可能为甲基化腺嘌呤影响蛋白质-DNA相互作用而抑制基因转录.由于DNA的甲基化不涉及DNA序列本身的改变, 所以这种改变是可逆的, 因此可以通过消除基因启动子区域的甲基化状态, 使被封闭的基因尤其是肿瘤抑制基因重新表达,从而抑制肿瘤生长, 达到治疗肿瘤的目的[10-14].我们选用去甲基化制剂处理结肠癌细胞株, 结果显: 5-Aza-CdR在浓度为0.4 µmoL/L时即可抑制结肠癌细胞增殖, 随着浓度的提高其抑制作用也增高(P<0.01),同一浓度5-Aza-CdR随着作用时间的延长, 其生长抑制作用也越明显(P<0.01).倒置显微镜下观察,可见癌细胞体积缩小, 死亡, 细胞密度减少.近一步研究发现, 5-Aza-CdR使细胞生长停滞在G0/G1期, 增高癌细胞凋亡的发生率, 以上作用呈剂量依赖性, 在浓度达到6.4 µmoL/L时效果最明显,倒置显微镜下观察,可见当浓度102.4 µmoL/L时, 更多的细胞表现为破碎, 形态不完整, 呈坏死的表现,这和其他的化疗药物相似, 即在低浓度时引起细胞的凋亡, 而高浓度引起细胞的坏死.无RASSF1A基因mRNA表达的大肠癌细胞使用5-Aza-CdR处理后, 均检出基因的重新表达.并连续培养5代以上仍可检测出RASSF1A基因mRNA的表达, 究其原因, 5-Aza-CdR具有诱发因高甲基化封闭的基因重获表达的去甲基化功能, 从而导致其抑制肠癌细胞生长的作用.不可否认, 药物本身如存在细胞毒效应也可产生抑制作用.为确切证实5-AZA-CdR抑制细胞生长的内在机制, Bender et al[15-17]应用具有同等细胞毒性作用的药物Ara-C(无去甲基化作用)作用于膀胱癌细胞,结果并未显示出抑制肿瘤细胞生长的可遗传性, 细胞毒效应均存在着时效性, 因而提示5-Aza-CdR抑制肿瘤细胞生长并非由于其本身的毒性作用.
RASSF1A作为抑癌基因的具体机制还不大清楚, Dammann et al[18-22]目前已证实, Ras-GTPase是调节增殖与凋亡的分子开关超家族一员, 它的不同功能取决于细胞外信号分子的不同, 由此活化的Ras可能因与一系列不同的下游效应分子相互作用而发挥2种截然不同的功能: 即可以促进细胞生长和分化, 又可通过诱发细胞休眠, 诱导终末分化和凋亡来抑制细胞生长.Lee et al[23-24]用甲基化特定PCR方法, 检测正常结肠组织(n = 24), 结肠腺瘤(n = 95),结直肠癌(n = 149),结果发现RASSF1A CpG岛甲基化在结直肠癌灶很频繁, 远比癌灶旁及癌远隔部位的甲基化概率高.KurokiT et al[25-26]和Byun et al[27-29]先后用甲基化特定的PCR对22个食管癌细胞株、47列食管癌组织标本、对15个胃癌细胞株、90例原发性胃癌组织以及膀胱癌细胞株进行分析后发现RASSF1A明显甲基化(有统计学意义), 并且甲基化程度与临床分期显著相关, 进一步表明RASSF1A的表达失活部分是由RASSF1A启动子区CpG岛的高甲基化所引起的.
大量研究表明RASSF1A表达缺失和启动子高甲基化有着广泛的肿瘤谱, Muller et al[30]在研究乳腺癌患者血清中DNA异常甲基化的意义时, 发现有血清RASSF1A DNA异常甲基化或APC血清DNA异常甲基化的患者预后很差, 并指出该基因有望在多种肿瘤的早期诊断、预后指标评估中发挥重大作用.针对肿瘤细胞中区域性高甲基化存在的广泛性, 去甲基化制剂5-AZA-CDR具有广阔的抗肿瘤治疗前景.
编辑: 潘伯荣 审读: 张海宁
| 1. | Zhang Y, Ng HH, Erdjument-Bromage H, Tempst P, Bird A, Reinberg D. Analysis of the NaRD subunits reveals a histone deacetylase core complex and a connection with DNA methylation. Genes. 1999;13:1924-1935. [PubMed] |
| 2. | Prokhortchouk A, Hendrich B, Jorgensen H, Ruzoo A, Wilm M, Georgiev G, Bird A, Prokhortchouk E. The p120 catenin partner kaiso is a DNA methylation-dependent transcriptional repressor. Genes. 2001;15:1613-1618. [PubMed] [DOI] |
| 3. | Bird AP. The relationship of DNA methylation to cancer. Cancer Surv. 1996;28:87-101. [PubMed] |
| 5. | Dammann R, Li C, Yoon JH, Chin PL, Bates S, Pfeifer GP. Epigenetic inactivation of a RAS association domain family protein from the lung tumor suppressor locus 3p21.3. Nature Genet. 2000;25:315-319. [PubMed] [DOI] |
| 6. | Dammann R, Takahashi T, Pfeifer GP. The CpG island of the novel tumor suppressor gene RASSF1A is intensely methylated in primary small cell lung carcinomas. Oncogene. 2001;20:3563-3567. [PubMed] [DOI] |
| 7. | Bartling B, Hoffmann J, Holtz J, Schulz R, Heusch G, Darmer D. Quantification of cardioprotective gene expression in porcine short-term hibernating myocardium. J Mol Cell Cardiol. 1999;31:147-158. [PubMed] [DOI] |
| 8. | Burbee DG, Forgacs E, Zochbauer-Muller S, Shivakumar L, Fong K, Gao B, Randle D, Kondo M, Virmani A, Bader S. Epigenetic Inactivation of RASSF1A in Lung and Breast Cancers and Malignant Phenotype Suppression. J Natl Cancer Inst. 2001;93:691-699. [PubMed] [DOI] |
| 9. | Zochbauer MS, Fung KM, Virmani AK, Geradts J, Gazdar AF, Minna JD. Aberrant promoter methylation of multiple genes in nonsmall cell lung cancers. Cancer Res. 2001;61:249-255. [PubMed] |
| 10. | Daskalakis M, Nguyen TT, Nguyen C, Guldberg P, Kohler G, Wijermans P, Jones PA, Lubbert M. Demethylation of a hypermethylated P15/INK4Bgene in patients with myelodysplastic syndrome by 5-Aza-2'-deoxycytidine (decitabine) treatment. Blood. 2002;100:2957-2964. [PubMed] [DOI] |
| 11. | Bae SI, Lee HS, Kim SH, Kim WH. Inactivation of O6-methylguanine-DNA methyltransferase by promoter CpG island hypermethylation in gastric cancers. Br J Cancer. 2002;86:1888-1892. [PubMed] [DOI] |
| 12. | Esteller M, corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] |
| 13. | Lubbert M, Tobler A, Daskalakis M. Cytosine demethylation of the proteinase-3/myeloblastin primary granule protease gene during phagocyte development. Leukemia. 1999;13:1420-1427. [PubMed] [DOI] |
| 14. | Kim SH, Bae SI, Lee HS, Kim WH. Alteration of O6-methylguanine-DNA methyltransferase in colorectal neoplasms in sporadic and familial adenomatous polyposis patients. Mol Carcinog. 2003;37:32-38. [PubMed] [DOI] |
| 15. | Bender CM, Pao MM, Janes PA. Inhibition of DNA methylation by 5-Aza-2'-deoxycytidine suppresses the growth of human tumor cell lines. Cancer Res. 1998;58:95-101. [PubMed] |
| 16. | Gonzalgo ML, Hayashida T, Bender CM, Pao MM, Tsai YC, Gonzales FA, Nguyen HD, Nguyen TT, Jones PA. The role of DNA methylation in expression of the p19/p16 locus in human bladder cancer cell lines. Cancer Res. 1998;58:1245-1252. [PubMed] |
| 17. | Xiong Z, Wu AH, Bender CM, Tsao JL, Blake C, Shibata D, Jones PA, Yu MC, Ross RK, Laird PW. Mismatch repair deficiency and CpG island hypermethylation in sporadic colon adenocarcinomas. Cancer Epidemiol. 2001;10:799-803. [PubMed] |
| 18. | Dammann R, Schagdarsurengin U, Strunnikova M, Rastetter M, Seidel C, Liu L, Tommasi S, Pfeifer GP. Epigenetic inactivation of the Ras-association domain family 1 (RASSF1A) gene and its function in human carcinogenesis. Histol Histopathol. 2003;18:665-677. [PubMed] |
| 19. | Liu L, Tommasi S, Lee DH, Dammann R, Pfeifer GP. Control of microtubule stability by the RASSF1A tumor suppressor. Oncogene. 2003;22:8125-8136. [PubMed] [DOI] |
| 20. | Strunnikova M, Schagdarsurengin U, Kehlen A, Garbe JC, Stampfer MR, Dammann R. Chromatin inactivation precedes de novo DNA methylation during the progressive epigenetic silencing of the RASSF1A promoter. Mol. Cell. Biol. 2005;25:3923-3933. [PubMed] [DOI] |
| 21. | Chow LS, Lo KW, Kwong J, To KF, Tsang KS, Lam CW, Dammann R, Huang DP. RASSF1A is a target tumor suppressor from 3p21.3 in nasopharyngeal carcinoma. Int J Cancer. 2004;109:839-847. [PubMed] [DOI] |
| 22. | Tommasi S, Dammann R, Zhang Z, Wang Y, Liu L, Tsark WM, Wilczynski SP, Li J, You M, Pfeifer GP. Tumor susceptibility of Rassf1a knockout mice. Cancer Res. 2005;65:92-98. [PubMed] |
| 23. | Lee s, Hwang KS, Lee HJ, Kim JS, Kang GH. Aberrant CpG island hypermethylation of multiple genes in colorectal neoplasia. Lab Invest. 2004;87:884-893. [PubMed] |
| 24. | Kang GH, Lee HJ, Hwang KS, Lee S, Kim JH, Kim JS. Aberrant CpG island hypermethylation of chronic gastritis, in relation to aging, gender, intestinal metaplasia, and chronic inflammation. Am. J. Pathol. 2003;163:1551-1556. [PubMed] [DOI] |
| 25. | Kuroki T, Trapasso F, Yendamuri S, Matsuyama A, Alder H, Mori M, Croce CM. Allele loss and promoter hypermethylation of VHL, RAR-beta, RASSF1A, and FHIT tumor suppressor genes on chromosome 3p in esophageal squamous cell carcinoma. Cancer Res. 2003;63:3724-3728. [PubMed] |
| 26. | Kuroki T, Trapasso F, Yendamuri S, Matsuyama A, Alder H, Mori M, Croce CM. Promoter hypermethylation of RASSF1A in esophageal squamous cell carcinoma. Clin Cancer Res. 2003;9:1441-1445. |
| 27. | Byun DS, Lee MG, Chae KS, Ryu BG, Chi SG. Frequent epigenetic inactivation of RASSF1A by aberrant promoter hypermethylation in human gastric adenocarcinoma. Cancer Res. 2001;61:7034-7038. [PubMed] |
| 28. | Lee MG, Kim HY, Byun DS, Lee SJ, Lee CH, Kim JI, Chang SG, Chi SG. Frequent epigenetic inactivation of RASSF1A in human bladder carcinoma. Cancer Res. 2001;61:6688-6692. [PubMed] |
| 29. | Chan MW, Chan LW, Tang NL, Lo KW, Tong JH, Chan AW, Cheung HY, Wong WS, Chan PS, Lai FM. Frequent hypermethylation of promoter region of RASSF1A in tumor tissues and voided urine of urinary bladdercancer patients. Int J Cancer. 2003;104:611-616. [PubMed] [DOI] |
| 30. | Muller HM, Widschwendter A, Fiegl H, Ivarsson L, Goebel G, Perkmann E, Marth C, Widschwendter M. DNA methylation in serum of breast cancer patients: an independent prognostic marker. Cancer Res. 2003;63:7641-7645. [PubMed] |