修回日期: 2005-06-10
接受日期: 2005-06-13
在线出版日期: 2005-09-15
目的: 观察乙肝疫苗联合CpG ODN和卡介苗免疫小鼠, 对小鼠抗HBs水平和细胞免疫的影响.
方法: 不同剂量乙肝疫苗单用或联合CpG ODN或卡介苗免疫小鼠, 用ELISA方法检测抗HBs水平, 流式细胞仪检测外周血CD4+和CD8+T淋巴细胞亚群的百分比和比值.
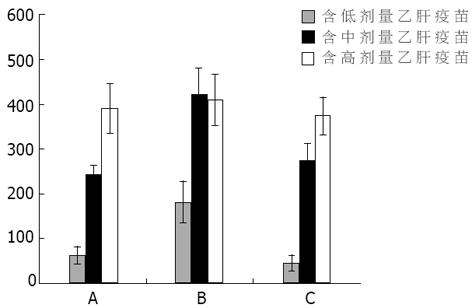
结果: 免疫4 wk后, 中、高剂量乙肝疫苗联合CpG ODN组抗HBs水平显著高于低剂量乙肝疫苗组(420.56±55.66 vs 181.62±41.25, t = 0.013, P<0.05;403.38±63.85 vs 181.62±41.25;t = 0.024, P<0.05).但中、高组间无差别.CpG ODN联合组与单用乙肝疫苗组比较, 联合低、中剂量乙肝疫苗抗HBs水平较单用乙肝疫苗明显升高(181.62±41.25 vs 59.16±18.43, t = 0.022, P<0.05;420.56±55.66 vs 241.82±23.84, t = 0.018, P<0.05).但高剂量乙肝疫苗联合组与单用乙肝疫苗比较两组间未显示明显差别.且以CpG ODN联合中等量乙肝疫苗产生的抗HBs水平最高.卡介苗联合组与单用乙肝疫苗组无差别, 但在联合低、中剂量乙肝疫苗抗HBs水平低于CpG ODN联合组.CpG ODN联合组CD4+T淋巴细胞百分比和CD4+/CD8+比值明显高于单用乙肝疫苗组和卡介苗联合组(CD4+: 38.30±1.68 vs 31.47±2.15, t = 0.018, P<0.05;38.30±1.68 vs 29.31±2.97, t = 0.013, P<0.05;CD4+/CD8+: 9.01±0.38 vs 6.45±0.39, t = 0.000, P<0.05;9.01±0.38 vs 6.99±0.79, t = 0.029, P<0.05).
结论: CpG ODN联合乙肝疫苗不仅能诱导出高水平的抗HBs, 而且对细胞免疫也有调节作用.
引文著录: 王甦, 陈群, 王兴, 张燕, 马丽, 汪中强. 乙肝疫苗联合含CpG基序寡脱氧核苷酸和卡介苗对小鼠的免疫应答影响. 世界华人消化杂志 2005; 13(17): 2078-2081
Revised: June 10, 2005
Accepted: June 13, 2005
Published online: September 15, 2005
AIM: To investigate the effects of hepatitis B vaccine with CpG oligodeoxynucleotide (ODN) or Bacilli Calmette Guerin on the immune responses in mice.
METHODS: BALB/c mice were subcutaneously injected with different doses of hepatitis B vaccine (0.25, 0.75, 1.0 μg) combined with CpG ODN or BCG. The levels of serum hepatitis surface antibody (anti-HBs) were detected by ELISA assays two and four weeks after injection. The changes of peripheral blood T lymphocyte subsets CD4+, CD8+ and CD4+/CD8+ ratio were detected by flow cytometry.
RESULTS: Four weeks after injection, the levels of serum anti-HBs in the mice injected with the combination of CpG ODN and hepatitis B vaccine (0.75 and 1.0 μg, respectively) were significantly higher than that with CpG ODN and 0.25 μg hepatitis B vaccine (420.56±55.66 vs 181.62±41.25, t = 0.013, P <0.05; 403.38±63.85 vs 181.62±41.25; t = 0.024, P <0.05). Compared with that in the mice only injected with hepatitis B vaccine, the serum anti-HBs levels in the ones injected with the combination of CpG ODN and hepatitis B vaccine (0.25 and 0.75 μg, respectively) were markedly higher (181.62±41.25 vs 59.16±18.43, t = 0.022, P <0.05; 420.56±55.66 vs 241.82±23.84, t = 0.018, P <0.05). The serum anti-HBs levels in the mice injected with the combination of BCG and hepatitis B vaccine were not significantly different from that with hepatitis B vaccine only. Whereas compared with that in the CpG ODN combination groups, the serum anti-HBs levels were lower in the mice injected with the combination of BCG and 0.25 or 0.75 μg hepatitis B vaccine. The percentages of CD4+ and the CD4+/CD8+ ratio in the mice immunized by CpG ODN combined with hepatitis B vaccine increased significantly as compared with those with hepatitis B vaccine only and the BCG combination group (CD4+: 38.30±1.68% vs 31.47±2.15%, t = 0.018, P <0.05; 38.30±1.68 vs 29.31±2.97, t = 0.013, P <0.05; CD4+/CD8+: 9.01±0.38 vs 6.45±0.39, t = 0.000, P <0.05; 9.01±0.38 vs 6.99±0.79, t = 0.029, P <0.05).
CONCLUSION: CpG ODN combined with hepatitis B vaccine not only induces high level of anti-HBs, but also enhances the cellular immune responses.
- Citation: Wang S, Chen Q, Wang X, Zhang Y, Ma L, Wang ZQ. Effect of hepatitis B vaccine with CpG oligodeoxynucleotide or Bacilli Calmette Guerin on immune responses in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2078-2081
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2078.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2078
乙型肝炎病毒(HBV)感染呈全球范围广泛流行.HBV感染可引起急性、慢性和重型肝炎, 并与肝硬化、肝癌的发生密切相关, 是严重危害人类健康的感染性疾病, 且目前尚缺乏可靠的治疗方法.因而人们不断寻求新的预防和治疗措施来控制乙型病毒性肝炎.近年来, 发现细菌DNA中含非甲基化CpG基序具有免疫刺激作用, 人工合成含非甲基化CpG基序的寡脱氧核苷酸(CpG oligodeoxynucleotide, CpG ODN)也有同样免疫作用[1,2].大量研究表明CpG ODN不仅能诱导出高水平的保护性抗体, 而且能诱导出强烈的TH1型细胞免疫应答[3,4].我们探讨含CpG基序的寡脱氧核苷酸(CpG ODN)和卡介苗联合乙肝疫苗对小鼠抗HBs水平和细胞免疫的影响, 为乙肝的预防与特异性免疫治疗提供新的方案.
雌性BALB/c小鼠45只, 6-8周龄, 清洁级, 每只20-25 g, 购于扬州大学实验动物中心.CpG ODN碱基序列为5'-TCCATGACGTTCCTGACGTT-3', 由上海博亚生物技术有限公司合成.乙肝疫苗为北京天坛生物制品股份有限公司生产.卡介苗为成都生物制品研究所提供.FITC标记的抗小鼠CD4 mAb和PE标记的抗小鼠CD8 mAb, 对照试剂分别为FITC标记的抗鼠IgG2b, PE标记的抗鼠IgG2a, 购自eBioscience公司.定量检测乙肝病毒表面抗体(抗HBs)试剂盒购自解放军总医院东亚免疫所.流式细胞仪为美国Becton-Dickon公司FACSCalibur.
经小鼠尾根部皮下免疫BALB/c小鼠.乙肝疫苗与CpG ODN混合液配制: 乙肝疫苗分低、中、高剂量(0.25, 0.75, 1.0 μg), 分别溶于20 μg CpG ODN.乙肝疫苗与卡介苗混合液配制: 乙肝疫苗低、中、高剂量(0.25, 0.75, 1.0 μg), 分别与0.1 mg卡介苗溶于注射用水.实验小鼠共分3大组9小组(每小组5只).其中, A组单用乙肝疫苗组分: (A1)乙肝疫苗0.25 μg, (A2)乙肝疫苗0.75 μg, (A3)乙肝疫苗1.0 μg;CpG ODN联合乙肝疫苗联合组为B组分: (B1)乙肝疫苗0.25 μg+CpG ODN 20 μg, (B2)乙肝疫苗0.75 μg+CpG ODN 20 μg, (B3)乙肝疫苗1.0 μg+CpG ODN 20 μg;卡介苗联合乙肝疫苗联合组为C组分: (C1)乙肝疫苗0.25 μg+卡介苗0.1 mg, (C2)乙肝疫苗0.75 μg+卡介苗0.1 mg, (C3)乙肝疫苗1.0 μg+卡介苗0.1 mg.免疫后2及4 wk采小鼠眼球血, 分离血清, -20 ℃保存.由专人用同一批号的ELISA检测抗-HBs, 操作按说明书进行, 测定吸光度值A450nm.肝素抗凝血, 供T淋巴细胞亚群分析用.方法: 50 μL抗凝全血, 加FITC标记的抗小鼠CD4 mAb 1.5 μL, 加PE标记的抗鼠CD8 mAb 2.5 μL, 室温孵育15 min, 避光, 然后用NH4C1低渗溶液2 mL, 室温放置8 min, 裂解红细胞;低速离心, 去上清, 沉淀加PBS 2 mL重悬, 再低速离心, 去上清;沉淀加PBS 200 μL重悬上机, 开窗于淋巴细胞区域, 计数10000个细胞.机带软件分析CD4+, CD8+ T淋巴细胞百分比.
统计学处理 采用SPSS 11软件统计, 两组间数据比较采用t检验.
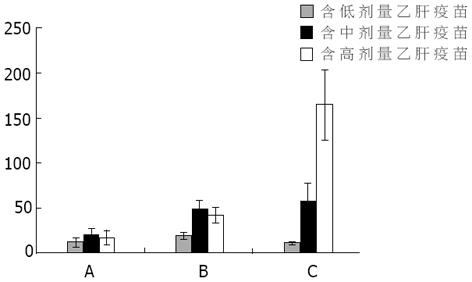
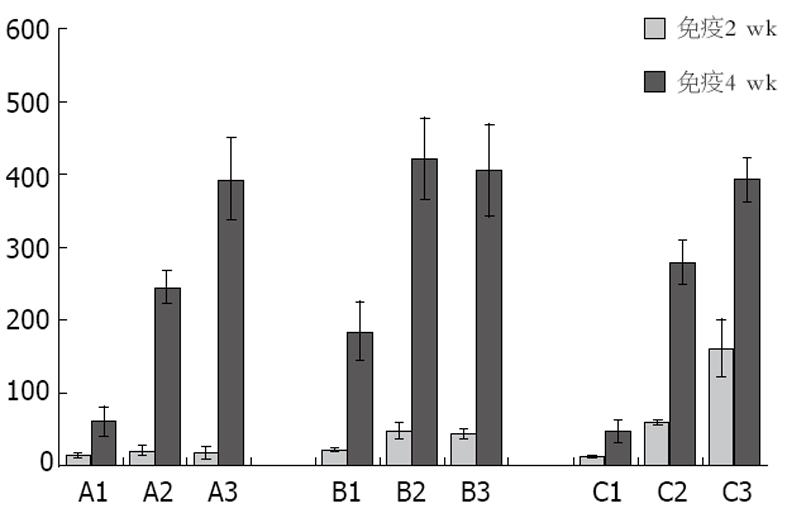
单用乙肝疫苗组在接种后2 wk不同剂量产生的抗体产生水平没有明显差别.CpG ODN联合乙肝疫苗组接种2 wk后显示: CpG ODN联合中、高剂量乙肝疫苗其抗HBs水平高于联合低剂量乙肝疫苗组, 也高于单用乙肝疫苗组高(P<0.05).卡介苗联合乙肝疫苗组接种2 wk后显示: 随着乙肝疫苗的剂量增加, 抗体水平逐渐升高(P<0.05), 且卡介苗联合高剂量乙肝疫苗组明显高于单用乙肝疫苗组和CpG ODN联合组(P<0.05, 图1).接种后4 wk后, 单用乙肝疫苗组, 随着疫苗量的增加, 抗体水平逐渐升高, 各组间有显著差异(P<0.05).CpG ODN联合乙肝疫苗组显示联合中、高剂量乙肝疫苗组抗HBs水平显著高于联合低剂量乙肝疫苗组(P<0.05).但中、高组间无差别.卡介苗联合乙肝疫苗组也显示抗体水平逐渐升高, 且各组间也有差异(P<0.05, 图2).同时比较各组间接种4 wk后抗体水平时发现: CpG ODN联合低、中剂量乙肝疫苗抗HBs水平较单用乙肝疫苗明显升高(P<0.05).但高剂量乙肝疫苗联合组与单用乙肝疫苗比较时, 两组间未显示明显差别.卡介苗联合组与单用乙肝疫苗组未显示差别, 但在联合低、中剂量乙肝疫苗组低于CpG ODN联合组(P<0.05, 图2).单用乙肝疫苗组、CpG ODN联合乙肝疫苗组以及BCG联合乙肝疫苗组免疫小鼠2 wk和4 wk后抗HBs水平的比较均显示各组免疫4 wk后抗体明显高于2 wk时抗体水平(图3).
免疫4 wk后, CpG ODN联合乙肝疫苗组CD4+T淋巴细胞百分比较单用乙肝疫苗组和卡介苗联合组明显升高, CD4+/CD8+比例升高(P<0.05).CD8+T淋巴细胞百分比与两组无差别.卡介苗联合组
CD4+、CD8+T淋巴细胞百分比、CD4+/CD8+比例与单用乙肝疫苗组无明显差别(表1).
CpG ODN对机体各种免疫细胞都具有免疫刺激作用.CpG ODN是一些含有CpG二核苷酸, 并且具有免疫激活作用的寡核苷酸.它通过内吞作用和/与Toll样受体9(TLR9)相互作用能直接影响B细胞、巨噬细胞和树突状细胞.能引起B细胞分化, 直接刺激B细胞分泌IL6, IL10等细胞因子和免疫球蛋白, 诱导B细胞表面共刺激分子的表达, 包括MHCⅡ, B7-1和B7-2.能直接激活抗原递呈细胞(APC), 包括单核细胞、巨噬细胞和树突状细胞, 诱导其产生IL12, TNF-α等TH1型为主的细胞因子, 并可上调MHC和共刺激分子的表达[3,6,7].大量动物实验证明[8], CpG 0DN作为佐剂可增强多种外源性抗原, 包括HBsAg的免疫原性, 诱发HBsAg低反应动物(C57BL6小鼠, 新生小鼠)对HBsAg产生体液及细胞免疫反应, 是一种强的Thl型免疫.我们选取雌性BALB/c小鼠, 采用CpG ODN和卡介苗联合不同剂量乙肝疫苗免疫小鼠.结果显示CpG ODN具有明显的免疫刺激作用.在免疫2 wk后, 联合组在联合中、高剂量乙肝疫苗免疫小鼠其抗HBs水平较单用乙肝疫苗组高(P<0.05), 表明CpG ODN能早期提高抗体水平.在免疫4 wk后, 将单用乙肝疫苗组与联合组比较发现, CpG ODN联合低、中剂量乙肝疫苗较单用乙肝疫苗明显升高(P<0.05).但CpG ODN联合高剂量乙肝疫苗与单用乙肝疫苗(1.0 μg)比较时, 两组间未显示明显差别.同时免疫4 wk后, 联合组显示CpG 0DN联合中、高剂量乙肝疫苗组显著高于联合低剂量乙肝疫苗组(P<0.05).但中、高组间无差别.而且我们发现CpG ODN联合中等剂量乙肝疫苗(0.75 μg)产生的抗体水平最高.肖昕 et al[5]在用不同剂量CpG ODN(10, 20, 40 μg)联合乙肝疫苗免疫小鼠, 同样也观察到抗体水平不随CpG ODN剂量的增加而增加.Davis[1]研究发现, 少至10 μg量的CpG 0DN就可以获得很完全的免疫刺激效果.因此, 如果CpG 0DN剂量太少, 刺激强度不够, 则会影响免疫效力;而如果CpG 0DN剂量太大, 则可能会增加不良反应, 且造成不必要的浪费.提示CpG ODN与疫苗需有适当比例, 才能产生较好的免疫作用.我们从另一角度(通过改变乙肝疫苗的量)阐明CpG ODN与乙肝疫苗适当比例可能产生较好的免疫效果.
目前大多研究显示卡介苗联合乙肝疫苗对HBsAb的产生, 有增强和优化作用[9,10].本研究显示, 卡介苗联合乙肝疫苗组与单用乙肝疫苗组比较, 免疫2 wk后, 高剂量乙肝疫苗联合卡介苗组抗体水平较单用高剂量乙肝疫苗高, 但其它两组间无差别;且免疫4 wk后, 联合组与单用组无差别.在与CpG ODN联合组比较时, 4 wk后, 低、中剂量联合组抗体水平低于CpG ODN联合组(P<0.05).说明卡介苗联合乙肝疫苗, 没有明显增加抗体水平, 有待进一步研究.应用流式细胞对T淋巴细胞CD4+和CD8+亚群分析显示: CpG ODN联合组CD4+T淋巴细胞百分比明显高于单用乙肝疫苗组和卡介苗组(P<0.05), CD8+T淋巴细胞百分比两组无明显差别.CD4+/CD8+比值CpG ODN联合组也明显高于单用乙肝疫苗组和卡介苗组(P<0.05).因而可以看出, 乙肝疫苗联合CpG ODN不仅能诱导出高水平的抗HBs, 而且对细胞免疫也有调节作用.这种体液/细胞免疫均衡应答对治疗慢性乙型肝炎可能是很有价值的: 抗体能降低病毒载量和防止HBV对未感染细胞的感染;细胞免疫的激活可以通过凋亡机制或分泌炎症因子杀伤病毒感染的细胞或抑制感染细胞中的病毒复制, 使细胞破裂, 病毒释放出来, 可以通过特异性的抗体与之中和, 使其失去再感染的能力, 从而可以达到清除病毒的目的.
本研究进一步证明CpG 0DN对免疫激活作用, 同时显示CpG 0DN联合乙肝疫苗在适当的比例时, 可产生最好的免疫效果(CpG 0DN联合0.75 μg乙肝疫苗).因此, 如何调整CpG 0DN与疫苗的比例, 对更好地激活机体的免疫反应是非常重要的, 也是今后研究的方向.因此, 随着对CpG 0DN研究的深入, CpG 0DN不仅可用于乙肝疫苗良好的佐剂, 而且也可能是低反应个体的有效预防性疫苗.CpG 0DN联合乙肝疫苗还可能成为一种潜在的HBV持续感染患者的治疗性疫苗.
编辑: 潘伯荣 审读: 张海宁
| 1. | Davis HL, Weeratna R, Waldschmidt TJ, Tygrett L, Schorr J, Krieg AM. CpG DNA is a potent enhancer of specific immunity in mice immunized with recombinant hepatitis B surface antigen. J Immunol. 1998;160:870-876. [PubMed] |
| 3. | Krieg AM, Yi AK, Matson S. Waldschmidt TJ, Bishop GA, Teasdale R, Koretzky GA, Klinman DM. CpG motifs in bacterial DNA trigger direct B-cell activation. Nature. 1995;374:546-549. [PubMed] [DOI] |
| 4. | 马 艳琴, 李 光富. CpG DNA 的免疫学作用及其应用. 国外医学·免疫学分册. 2003;26:318-321. |
| 6. | Bauer M, Heeg K, Wagner H, Lipford GB. DNA activates human immune cells through a CpG sequence-dependent manner. Immunology. 1999;97:699-705. [PubMed] [DOI] |
| 7. | Hemmi H, Takeuchi O, Kawai T, Kaisho T, Sato S, Sanjo H, Matsumoto M, Hoshino K, Wagner H, Takeda K. A Toll-like receptor recognizes bacterial DNA. Nature. 2000;408:740-745. [PubMed] [DOI] |