修回日期: 2005-07-10
接受日期: 2005-07-15
在线出版日期: 2005-09-15
目的: 探讨三氧化二砷(As2O3)对小鼠H22肝癌细胞增殖的抑制作用.
方法: 建立小鼠H22肝癌实体型及腹水型移植瘤模型, 腹腔应用As2O3治疗后, 通过瘤体生长及生存时间的比较, PCNA及cyclinD1免疫组化检测, 腹水细胞周期的流式术检测, 电镜观察等指标反映细胞增殖改变.
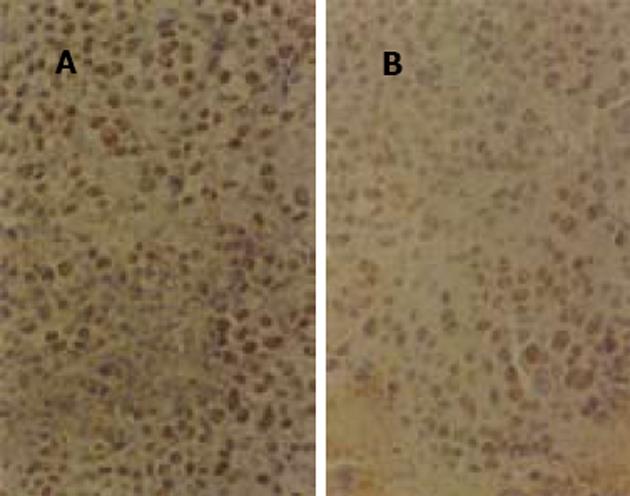
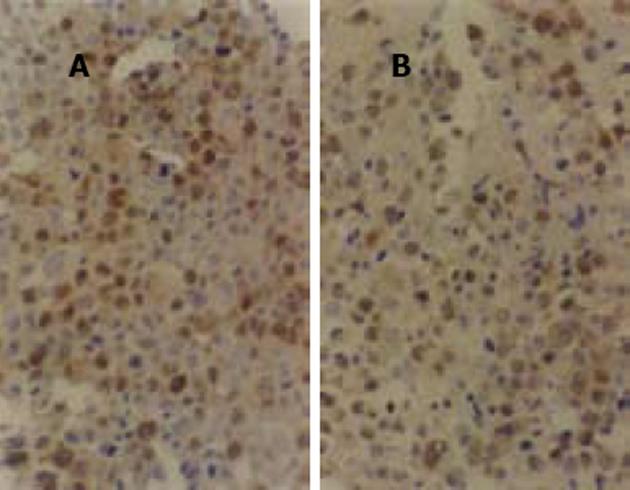
结果: As2O3高剂量及低剂量组均有效地抑制实体瘤组荷瘤鼠皮下肿瘤的生长, 抑瘤率分别为39.1%和45.7%, 且明显延长腹水瘤组荷瘤鼠的生存时间, 延命率分别为57.2%和97.7%, 其作用呈一定的量效关.PCNA及cyclinD1阳性表达率均明显降低, 分别由57.9%±6.6%降为44.0%±5.0%(P<0.01), 由49.2±9.3%降为37.6±6.3%(P<0.01).腹水流式细胞术可见细胞周期发生明显变化, 主要作用于G0/G1期及G2/M期, 电镜观察可见细胞发生典型的凋亡形态学改变, 并可见早期凋亡小体形成.
结论: As2O3对小鼠肝癌细胞的增殖具有明显的抑制作用, 具有治疗肝癌的潜在价值.
引文著录: 唐印华, 田永刚, 刘铁夫, 徐洪雨, 庄丽维, 梁桃, 姜爱民. 三氧化二砷抑制小鼠体内肝癌细胞增殖的实验研究. 世界华人消化杂志 2005; 13(17): 2074-2077
Revised: July 10, 2005
Accepted: July 15, 2005
Published online: September 15, 2005
AIM: To explore the arsenic trioxide(As2O3)-induced inhibition of the proliferation of mouse hepatoma cells in vivo.
METHODS: The mice bearing H22 solid and ascetic hepatoma cells were treated with different concentrations of arsenic trioxide. The growth of the solid tumor and the survival of the ascetic tumor-bearing mice were observed. The expression of proliferating cell nuclear antigen (PCNA) and cyclinD1 of the tumor cells were examined by immunohistochemical methods. The changes of cell cycle were measured by flow cytometry. The ultra-structural changes of the cells were observed under electron microscope.
RESULTS: Both high and low concentration of As2O3 inhibited the growth of the solid tumor and prolonged the survival time of ascetic-tumor-bearing mice, and the inhibitory rates were 39.1% and 45.7%, respectively. The life prolonging rates were 57.2% and 97.7%, respectively. The positive rates of PCNA and cyclinD1 expression in the As2O3-treated groups were significantly decreased from 57.9±6.6% to 44.0±5.0% (P <0.01), and from 49.2±9.3% to 37.6±6.3% (P <0.01), respectively. Flow cytometry showed that the percentage of G0/G1 phase cells was decreased and the percentage of G2/M phase cells was increased. Electron microscopy showed the typical characteristics of cell apoptosis.
CONCLUSION: As2O3 can significantly inhibit the proliferation of mouse hepatoma cells.
- Citation: Tang YH, Tian YG, Liu TF, Xu HY, Zhuang LW, Liang T, Jiang AM. Inhibitory effect of arsenic trioxide on proliferation of hepatoma cells in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(17): 2074-2077
- URL: https://www.wjgnet.com/1009-3079/full/v13/i17/2074.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i17.2074
恶性肿瘤细胞具有无限增殖的特点, 抑制肿瘤细胞生长是治疗肿瘤的重要途径之一.砷剂是治疗恶性肿瘤的化疗药物.近年来, As2O3在急性早幼粒细胞白血病(APL)治疗的临床和基础研究上已取得很大进展[1-4].国内体外研究证实, As2O3能抑制多种消化道肿瘤细胞株增殖, 诱导其凋亡[5-11], 其中对肝癌作用研究最广泛[12-16], 但As2O3的体内抗癌抑癌作用研究尚少.我们研究As2O3对小鼠肝癌的抑制作用, 来探讨其用于消化道肿瘤的治疗的可能性.
健康成年昆明系小鼠, 质量18-22 g, 雌雄兼用, 由哈尔滨医科大学第一临床医学院动物室提供; H22小鼠肝癌细胞株由黑龙江省肿瘤医院检验科宋晓时老师惠赠; 1 g/L As2O3溶液由哈尔滨医科大学第一临床医学院提供; PCNA, cyclinD1mAb购于武汉博士德生物工程公司.取H22小鼠肝癌细胞株(荷H22肝癌小鼠腹水), 活瘤细胞>90%, 调整细胞密度为1×1010个/L, 分别接种于小鼠前肢外侧皮下制成实体型荷瘤鼠模型, 接种于小鼠腹腔内制成腹水型荷瘤鼠模型.
次日实验随机分为3组, 分别腹腔注射.对照组, 生理盐水0.2 mL; 低剂量给药组, As2O3 2 mg/kg约0.2 mL; 高剂量给药组, As2O3 4 mg/kg约0.2 mL.每组10只, 每天给药1次, 连续10 d.实体瘤组于停药后2 d处死, 取瘤体, 称质量, 计算抑制率=(1-给药组平均瘤质量/对照组平均瘤质量)×100%.腹水瘤给药组与对照组小鼠比较生存时间, 计算延命率=(给药组平均存活时间/对照组平均存活时间-1)×100%.实体瘤标本做石蜡切片, 经二甲苯脱蜡, 入水, 血清封闭, 依次加入抗PCNA及抗cyclinD1抗体、生物素标记的二抗、ABC试剂, DAB显色, 苏木素复染, 显微镜观察.腹水瘤组于停药后2 d, 分别自每组随机挑选小鼠8只抽取腹水, 离心, 700 mL/L乙醇固定12 h以上, 离心, 除去乙醇, 加入10 g/L RNA酶溶液200 μL, 37℃水浴15 min, 加入碘化丙啶(PI)染色, 上流式细胞仪(美国BD公司, 型号FACSC alibur)检测细胞周期并用Lysis软件分析.实体瘤标本用戊二醛固定, 脱水, 浸透, 环氧树脂812包埋, 醋酸铀和柠檬酸铅双重染色, 超薄切片, 透射电镜下观察瘤细胞超微结构变化.
统计学处理 结果用平均数±标准差(mean±SD)表示, 所有资料经LYSIS Ⅱ软件收集处理, 采用两组均数t检验.
在实验过程中, 对照组荷瘤鼠活动减少, 步态不稳, 毛发稀疏, 进食水少, 形体消瘦呈恶病质, 其中一只在用药后5 d死亡, 而治疗组小鼠活动基本正常, 饮食状况无明显改变, 质量未见明显减轻.As2O3低剂量组及高剂量组平均瘤质量低于对照组平均瘤质量, 有显著性差异(1.93±0.36 g, 1.72±0.42 g vs 3.17±0.75 g, P<0.01), 其抑瘤率分别为39.1%和45.7%, 说明As2O3能有效抑制肿瘤生长.但高剂量组与低剂量组平均瘤重比较, 无明显差异(P>0.05).同样, 腹水瘤治疗组平均生存时间明显长于对照组(17.50±1.85 d, 22.0±4.10 d vs 11.13±2.64 d, P<0.01), 延命率分别为57.2%和97.7%, 但高剂量组与低剂量组有显著性差异(P<0.05), 说明As2O3能明显延长肝癌小鼠的生命, 高剂量AS2O3作用更明显.
阳性细胞为细胞核着棕黄色, 染色深度与其表达量有相关性(图1、图2).每张切片选染色最强、最集中的10个高倍视野(×400)共计数4000个肿瘤细胞中的阳性细胞数, 得出阳性细胞的百分数(表1).治疗组肿瘤细胞的PCNA阳性表达率及cyclinD1阳性表达率均低于对照组(P<0.01), 有显著差异.说明As2O3能下调PCNA及cyclinD1蛋白, 抑制小鼠H22肝癌细胞的增殖.
应用As2O3(高)后, 小鼠腹水细胞周期发生了明显变化, G0/G1期细胞从35.8%下降到18.2%(P<0.05), S期细胞从59.4%上升到63.5%(P>0.05), 变化不明显, 而G2/M期细胞由4.8%上升到19.3%(P<0.05).(低剂量As2O3作用后, 小鼠腹水细胞周期没有明显变化)说明As2O3(高)主要作用于G0/G1期及G2/M期, 抑制细胞增殖作用.
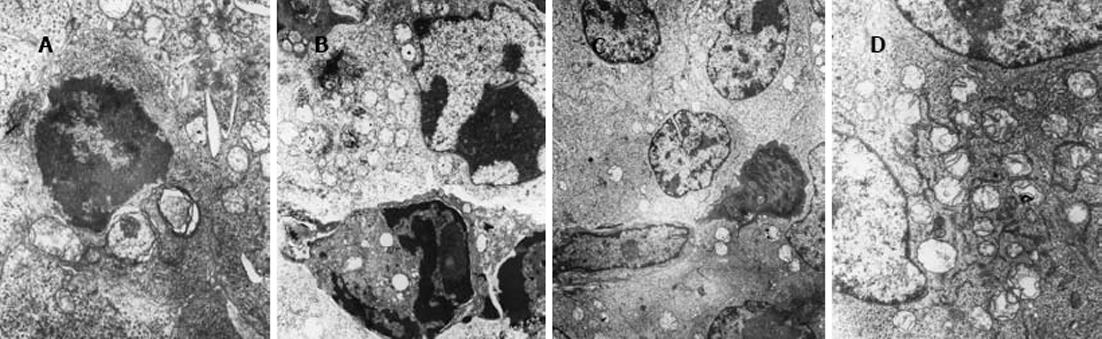
As2O3高剂量及低剂量组均可见细胞变小, 细胞间隙增宽, 细胞表面微绒毛显著减少; 细胞核内染色质浓缩聚集, 呈团块状或花瓣状, 位于核膜内侧; 核中央可见低电子密度的染色质, 部分细胞可见核膜破裂, 胞核崩解, 形成早期凋亡小体; 胞质内线粒体轻微肿胀, 部分空泡样变, 其它细胞器结构基本正常(图3).总的来说, 以细胞核及线粒体的变化为主, 这种变化以高剂量组更明显.
三氧化二砷诱导人白血病细胞株及其它肿瘤细胞株凋亡已有诸多报道[17].目前, 人们已把重点转移到As2O3在动物体内抗肿瘤作用的实验研究上[18-21].我们用As2O3对小鼠H22肝癌进行体内抑癌研究, 结果表明, As2O3可有效地抑制实体瘤组荷瘤鼠皮下肿瘤的生长, 并明显延长腹水瘤组荷瘤鼠的生存时间, 其作用呈一定的量效关系.整个实验过程中, 治疗组无质量变化等明显毒副作用.PCNA及cyclinD1在细胞周期的调控中起关键作用[22], 肿瘤细胞增殖越活跃, 其表达越高, 我们发现, 对照组PCNA及cyclinD1阳性表达率分别为57.9%和49.2%, 而As2O3低剂量组二者的阳性表达率下降, 分别为49.0%和42.8%, As2O3高剂量组二者的阳性表达率下降的更明显, 分别为44.0%和37.6%.结果表明, As2O3通过下调PCNA及cyclinD1蛋白的表达, 来抑制肿瘤细胞的增殖, 从而达到治疗肿瘤的目的.应用高剂量As2O3作用后, 小鼠腹水细胞周期变化明显, G0/G1期细胞从35.8%下降到18.2%, G2/M期细胞则从4.8%上升到19.3%, 说明As2O3主要作用于G0/G1期, 使其比率下降, 这种作用方式与众多S期抑制药物不同.G1期是转录过程的开始, 是细胞周期运行的关键时刻, 抑制这一时期, 能明显抑制细胞周期的正常运行.As2O3这种抑制G1期的作用方式, 与Stephan et al[23]应用hexahydrocolupulone(HHC, 25 mmol/l)抑制乳腺癌细胞MCF-7所报道的作用方式一致.我们看到, As2O3还作用于G2/M期, 使细胞堆积于S期及G2/M期, 阻滞细胞由S期-G2期及G2-M期的进程, 从而减慢癌细胞的增殖生长速度.在实验中, 由于腹水里可能有一些吞噬细胞对肿瘤细胞有吞噬作用, 又由于一些坏死细胞在崩解之前难于与活的肿瘤细胞区别, 因此, FCM显示S期细胞比率比G0/G1期细胞比率高, 这并不能代表癌细胞的DNA合成总量增多.电镜观察下我们发现As2O3主要作用于细胞核及线粒体, 使其基本符合细胞凋亡的形态学特征, 且见到早期凋亡小体, 说明As2O3可诱导肝癌细胞凋亡.
本实验结果显示As2O3具有: (1)抑制实体型荷肝癌小鼠皮下肿瘤的生长; (2)延长腹水型荷肝癌小鼠的生存时间; (3)下调PCNA及cyclinD1蛋白的表达; (4)减少细胞周期中G0/G1期百分率, 提高G2/M期百分率; (5)形成早期凋亡小体.这些方面均有力地证实了As2O3对体内肝癌细胞的作用, 为临床应用As2O3治疗肝癌提供了可靠依据.至于As2O3这种体内抗肝癌作用的机制有待于我们进一步研究.
编辑: 潘伯荣 审读: 张海宁
| 1. | 张 鹏, 王 树叶, 胡 龙虎, 施 福东, 邱 凤琴, 洪 珞珈, 韩 雪英, 杨 惠芬, 宋 颖昭, 刘 艳平. 三 氧化二砷注射液治疗72例急性早幼粒细胞白血病. 中华血液学杂志. 1996;17:58-60. |
| 2. | Shen ZX, Chen GQ, Ni JH, Li XS, Xiong SM, Qiu QY, Zhu J, Tang W, Sun GL, Yang KQ. Use of arsenic trioxide (As2O3) in the treatment of acute promyelocytic leukemia (APL): II. Clinical efficacy and pharmacokinetics in relapsed patients. Blood. 1997;89:3354-3360. [PubMed] |
| 3. | Jing Y, Dai J, Chalmers-Redman RM, Tatton WG, Waxman S. Arsenic trioxide selectively induces acute promyelocytic leukemia cell apoptosis via a hydrogen peroxide-dependent pathway. Blood. 1999;94:2102-2111. [PubMed] |
| 4. | 高 飞, 易 静, 史 桂英, 李 慧, 金 慧芳, 石 学耕, 汤 雪明. 活性氧水平决定白血病细胞对三氧化二砷诱导 凋亡的敏感性. 生物化学与生物物理学报. 2001;33:585-589. |
| 5. | 涂 水平, 江 石湖, 谭 继宏, 蒋 晓华, 乔 敏敏, 章 永平, 吴 云林, 吴 裕忻. 氧化砷抑制胃癌SGC-7901细胞 增殖和诱导凋亡作用. 世界华人消化杂志. 1999;7:18-21. [DOI] |
| 7. | Gu QL, Li NL, Zhu ZG, Yin HR, Lin YZ. A study on arsenic trioxide inducing in vitro apoptosis of gastric cancer cell lines. World J Gastroenterol. 2000;6:435-437. [PubMed] [DOI] |
| 8. | Shen ZY, Shen J, Cai WJ, Hong C, Zheng MH. The alteration of mitochondria is an early event of arsenic trioxide induced apoptosis in esophageal carcinoma cells. Int J Mol Med. 2000;5:155-158. [PubMed] [DOI] |
| 9. | Xie DX, Yin S, Ou YX. Arsenic trioxide (AS2O3) induced apoptosis and its mechanisms in a human esophageal squamous carcinoma cell line. Chin Med J (Engl). 2002;115:280-285. [PubMed] |
| 10. | Chen QK, Yuan SZ, Huang ZQ. Arsenic trioxide-induced apoptosis and arrest of cell cycle in pancreatic cancer. Zhonghua yixue zazhi. 1998;78:578-579. |
| 12. | Oketani M, Kohara K, Tuvdendorj D, Ishitsuka K, Komorizono Y, Ishibashi K, Arima T. Inhibition by arsenic trioxide of human hepatoma cell growth. Cancer Lett. 2002;183:147-153. [PubMed] [DOI] |
| 14. | 徐 洪雨, 高 媛媛, 武 俏丽, 高 光强, 杨 幼林, 陈 淑香, 刘 铁夫. 三氧化二砷抑制人肝癌细胞株增殖和诱导凋亡作用. 世界华人消化杂志. 2000;8:1233-1237. [DOI] |
| 22. | Waga S, Hannon GJ, Beach D, Stillman B. The p21 inhibitor of cyclin-dependent kinases controls DNA replication by interaction with PCNA. Nature. 1994;369:574-578. [PubMed] [DOI] |
| 23. | Stephan TE, Ngo EO, Nutter LM. Hexahydrocolupulone and its antitumor cell proliferation activity in vitro. Biochem Pharmacol. 1998;55:505-514. [PubMed] [DOI] |