修回日期: 2005-07-18
接受日期: 2005-07-20
在线出版日期: 2005-08-28
目的: 探讨喜树碱类衍生物与celecoxib联合用药的体外和体内的抗肿瘤作用及机制, 同时观察celecoxib对CPT-11引起裸鼠腹泻的影响.
方法: 以MTT法检测结肠癌细胞系在联合应用celecoxib后对喜树碱及其衍生物的化学敏感性的改变; 流式细胞术检测celecoxib与喜树碱联合用药后HT-29细胞的凋亡比率和细胞周期的变化; Western Blot法检测环氧合酶-2(COX-2)以及凋亡相关蛋白(Bcl-2、Caspase-3、P53)的表达.以HT-29细胞裸鼠移植瘤模型观察celecoxib与CPT-11联合应用的体内抗肿瘤作用, 并且观察celecoxib对CPT-11引起腹泻及体重减轻的影响.
结果: celecoxib可以显著降低三种喜树碱类衍生物对四种人结肠癌细胞系的IC50值, 并且这种降低的程度与COX-2的表达密切相关.在HT-29细胞, celecoxib和CPT的联合应用使其凋亡率达到51.4%, 而CPT单独使用的凋亡率为24.4%(P<0.01).同时, celecoxib可以使CPT处理组的G0/G1期细胞增加并降低S期和G2/M期的细胞比例(P<0.01).celecoxib和CPT的联合应用可以降低COX-2和Bcl-2的表达, 增加Caspase-3和P53的表达.HT-29细胞裸鼠移植瘤实验中, celecoxib(60 mg/kg)与CPT-11(25 mg/kg)的联合应用使肿瘤生长明显抑制, 其抑制率为78.77%(与对照组相比P<0.01), 与CPT-11(25 mg/kg)组相比也有显著差异(P<0.05).同时celecoxib(60 mg/kg)可以明显减轻CPT-11引起腹泻症状, 降低其腹泻评分(0.33±0.52 vs 2.33±0.82, P<0.01), 并降低腹泻的发生率(16.67% vs 83.33%, P<0.05); 另外, celecoxib(60 mg/kg)可以明显缓解CPT-11引起的裸鼠体重减轻(17.54±1.13 g vs 14.56±2.16 g, P<0.05).
结论: celecoxib可以增强CPTs的体外、内的抗肿瘤活性, 这种作用可能与增加细胞凋亡和细胞周期阻滞作用有关.另外celecoxib可以减轻CPT-11引起的腹泻, 并缓解CPT-11引起的体重下降.
引文著录: 付剑江, 李燕, 李洪燕, 刘悦, 陈晓光. 氧合酶-2抑制剂celecoxib与喜树碱类衍生物联合用药的实验研究. 世界华人消化杂志 2005; 13(16): 1985-1991
Revised: July 18, 2005
Accepted: July 20, 2005
Published online: August 28, 2005
AIM: To investigate the antitumor properties of camptothecins (CPTs) combined with celecoxib, a selective cylooxygenase-2 (COX-2) inhibitor, in vitro and in vivo, and the effects of celecoxib on irinotecan (CPT-11)-induced diarrhea in mice.
METHODS: Four human colon cancer cell lines, HT-29, HCT-8, HCT-116 and Caco-2 were exposed to the increasing concentrations (10-5, 10-4, 10-3,10-2, 10-1, 1, 10,100 μmol/L) of three topoisomerase I (Topo I) inhibitors, CPT-11, CPT and topotecan (TPT), and celecoxib (1 and 5 μmol/L) as well as a combination of each Topo I inhibitor. Then MTT assay was performed to evaluate the effects of adjunct use of celecoxib on the chemosensitivity of colon cancer cells to CPTs. HT-29 cells were divided into control group, celecoxib treatment group, CPT treatment group and combined CPT with celecoxib treatment group. Flow cytometry was used to evaluate the apoptotic rates and cell cycle distribution. The expression of COX-2 and apoptosis-related proteins (Bcl-2, Caspase-3 and P53) were determined by immunocytochemical method. HT-29 cell line-xenografts model was established. The nude mice bearing tumor were divided into five groups, namely control group, CPT-11 (25 mg/kg per day) treatment group, celecoxib (60 mg/kg) treatment group and combined celecoxib (30 mg/kg and 60 mg/kg, respectively) with CPT-11 treatment group. The effects of the drugs on tumor growth and the severity of late diarrhea induced by CPT-11 were assessed.
RESULTS: Celecoxib significantly decreased the IC50 of the CPTs in the four colon cancer cell lines in vitro, but the reduction degrees of IC50 depended on the level of COX-2 expression. In HT-29 cells, the apoptotic rates were 51.4% in co-treated groups (24.4% in CPT treated groups, P<0.01), and the proportion in the G0/G1 phase were 49.1% in co-treated group (5.5% in CPT treated groups, P<0.01). The expression of COX-2 and Bcl-2 were down-regulated, but the expression of P53 and Caspase-3 were up-regulated after co-treatment with CPT and celecoxib in HT-29 cells. In vivo, treatment with celecoxib at 60 mg/kg in conjunction with CPT-11 (25 mg/kg per day for three consecutive days) significantly reduced tumor growth by 78.77% (P<0.01 vs control group; P<0.05 vs CPT-11 group), and decreased the score and rate of diarrhea induced by CPT-11 (0.330.52 vs 2.33±0.82, P<0.01; 16.67% vs 83.33%, P<0.05). Besides, celecoxib at 60 mg/kg improved the body weight of the mice (17.54±1.13 g vs 14.56±2.16 g, P<0.05).
CONCLUSION: Celecoxib enhances antitumor properties of CPTs in colon cancer in vitro and in vivo, and this enhancement may be associated with the apoptosis increase and cell cycle arrest. Additionally, celecoxib reduces the severity of diarrhea and body weight loss induced by CPT-11.
- Citation: Fu JJ, Li Y, Li HY, Liu Y, Chen XG. Effects of the combination of topoisomerase I inhibitors and celecoxib, a selective cylooxygenase-2 inhibitor on colorectal cancer. Shijie Huaren Xiaohua Zazhi 2005; 13(16): 1985-1991
- URL: https://www.wjgnet.com/1009-3079/full/v13/i16/1985.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i16.1985
环氧合酶(COX)是花生四烯酸代谢过程中的限速酶, 他存在两种亚型: COX-1和COX-2.近年来的大量研究表明, COX-2不仅参与炎症的发生, 同时与肿瘤的发生发展密切相关.因此, 非甾体类抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)的抗肿瘤活性也成为人们关注的焦点.研究表明: 一方面, NSAIDs促进肿瘤细胞凋亡, 增加细胞凋亡的比率; 另一方面, 影响肿瘤细胞的细胞周期, 使肿瘤细胞阻滞在G0/G1期.因此NSAIDs是一类有潜力用于肿瘤化疗的药物[1-4].化疗药物的联合应用是目前临床上非常重要的肿瘤治疗手段之一[5-8], NSAIDs与其他抗肿瘤药的联合应用也日益受到人们的关注.
喜树碱及其衍生物是一类以TopoⅠ为靶点的抗肿瘤药, 当这类药物与TopoⅠ结合后, 产生TopoⅠ毒性, 从而影响DNA的复制、转录和修复过程[9-11].其中topotecan和irinotecan是目前临床上广泛应用的两种喜树碱类衍生物, 前者主要用于晚期卵巢癌, 后者则用于转移性结肠癌.这两种喜树碱类药物在产生显著疗效的同时也引起非常严重的毒副反应, 比如CPT-11可以引起严重地腹泻, 这往往成为限制CPT-11使用的重要原因[12-14].有许多研究认为这种腹泻的产生可能与肠黏膜中COX-2表达增加、PGE2和TXA2的含量增加有关[15-16].我们基于上述理论基础, 探讨喜树碱类衍生物与celecoxib联合用药的体外、内的抗肿瘤作用及机制, 同时观察celecoxib对irinotecan(CPT-11)引起裸鼠腹泻的作用.
人结肠癌细胞系HT-29、Caco-2、HCT-8和HCT-116由本实验室保存.培养基和胎牛血清购于Gibico公司.CPT、TPT、CPT-11、MTT和碘化丙啶(propidium iodide, PI)均为Sigma的产品.COX-2(sc-1746), P53(sc-126), Bcl-2(sc-7382), Caspase-3(sc-7272)以及 actin(sc-1616)单抗购于Santa Cruz公司.
四种结肠癌细胞系在含有100 mL/L FBS和100 IU/L青霉素和100 mg/L链霉素的培养基中生长, 并于37℃ 50 mL/L CO2培养箱中培养.4-6 wk, Balb/c裸鼠用于HT-29裸鼠移植瘤模型和 CPT-11引起腹泻模型的建立.所有动物实验均遵照中国医学科学院中国协和医科大学药物研究所动物伦理委员会所制定实验方法进行.
1.2.1 MTT法检测细胞生长: 将生长良好的细胞接种于96孔板, 待细胞在37℃, 50 mL/L CO2 培养24 h贴壁后换成含不同浓度药物的培养基, 其中CPT、CPT-11、TPT各设8个浓度, 分别为10-5, 10-4, 10-3, 10-2, 10-1, 1, 10, 100 μmol/L; celecoxib设两个浓度, 1 μmol/L和5 μmol/L, 每个浓度设3个复孔, 继续培养96 h, 检测前4 h, 弃去上清, 每孔加入100 μL MTT(5 g/L), 4 h后弃上清, 加DMSO 200 μL, 用全自动酶标仪测定570 nm和450 nm处的吸光度(A570, A450)值, 以溶剂孔为对照计算各药物对细胞生长抑制的IC50.
1.2.2 流式细胞仪测定: 对数生长期的HT-29细胞接种于培养瓶中, 待细胞在37℃, 50 mL/L CO2 培养24 h贴壁后换成含不同浓度药物的培养基, 其中CPT设40、80 nmol/L; celecoxib设1、5 μmol/L.收集药物处理后的PBS洗涤后, 用4℃乙醇固定12 h, 离心除去乙醇, 加入10 g/L RNA酶溶液200 μL, 37℃水浴15 min, 加入PI, 上流式细胞仪(Becton & Dickinson, Mountain View, CA, USA)检测凋亡百分率和各细胞周期所占百分比[17].
1.2.3 Western blot检测凋亡相关蛋白表达: 将各处理组细胞加1 mL含0.1 mmol/L PMSF细胞裂解液(10 mmol/L Tris, pH7.6, 150 mmol/L NaCl, 5 mmol/L EDTA, pH 8.0, 10 mL/L Triton X-100, 1 mmol/L DTT), 冰上裂解30 min, 离心(15 000 g×10 min, 4℃), 去除细胞碎片, 测细胞裂解产物的蛋白含量, 取等量蛋白在100 g/L的SDS-聚丙烯酰胺凝胶中电泳, 将蛋白转印至硝酸纤维素膜上, 经封闭阻断后, 加抗体, 4℃孵育过夜, 碱性磷酸酶标记的IgG抗体室温孵育2 h, NBT/BCIP显色, GelPro3.1成像分析软件分析图像.
1.2.4 裸鼠移植瘤模型检测体内肿瘤生长及CPT-11引起的腹泻模型检测celecoxib对腹泻的影响: 雄性4-6周龄BALB/C裸鼠, 于背部皮内注射HT-29人结肠癌细胞1×107/只, 当肿瘤长至1 cm×1 cm×1 cm左右时, 无菌条件下取下部分瘤块, 切成1 mm×1 mm×1 mm瘤块, 用套管针接种到实验裸鼠背部皮下, 形成皮下移植瘤.接种48 h后随机分为五组, 每组6只: A、对照组, 只给予灭菌蒸馏水; B、celecoxib组, celecoxib每天60 mg/kg, 每周连续给药6 d; C、CPT-11组, CPT-11每天25 mg/kg, 接种后第7 d开始给药, 连续3 d, 每天一次; D、celecoxib与CPT-11联合用药Ⅰ组, celecoxib的剂量为30 mg/kg, 给药方法则与B组相同, CPT-11剂量与给药方法均与C组一致; E、celecoxib与CPT-11联合用药Ⅱ组, 其中celecoxib的剂量为60 mg/kg, 给药方法与B组相同, CPT-11的剂量及给药方法则均与C组相同.上述各组动物每周两次测量肿瘤体积, 绘制生长曲线, 5 wk后结束实验, 取下肿瘤组织称重并计算肿瘤抑制率.为了观察CPT-11引起的腹泻以及celecoxib对腹泻的作用, 上述荷瘤裸鼠在末次给予CPT-11后观察大便情况, 每天一次, 连续10 d, 并按以下标准打分[18]: 0分, 大便正常或没有; 1分, 轻度腹泻, 大便可见轻微湿软; 2分, 中度腹泻, 大便较湿且不成型并且有轻度的肛周着色; 3分, 重度腹泻, 水样便并伴有重度肛周着色.以平均腹泻评分, 2分及3分腹泻发生率, 体重恢复等指标评价腹泻严重程度.
统计学处理 应用SPSS10.0统计软件包统计, 结果以平均值±标准差(mean±SD)表示, 除腹泻发生率采用χ2检验外, 其余指标均采用单因素方差分析.
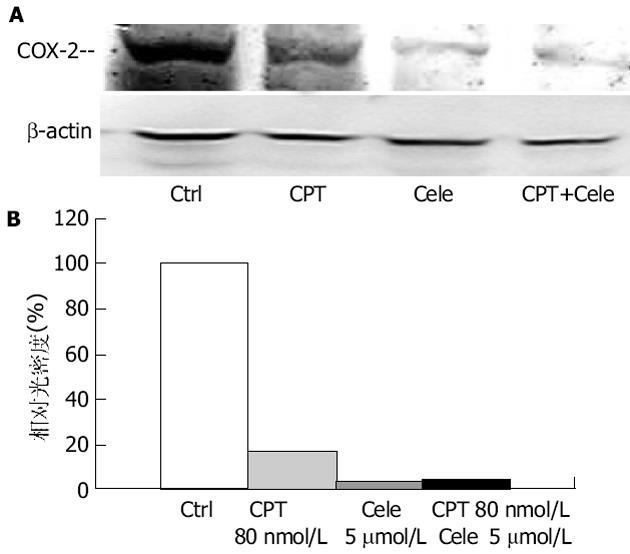
图1显示4种人结肠癌细胞的COX-2表达情况, 其中Caco-2、HT-29和HCT-8均可检测到COX-2的表达, 而HCT-116则没有检测到COX-2的表达.表1所示为三种喜树碱类药物与不同浓度的celecoxib联合应用对四株人结肠癌细胞系生长的影响.结果显示, celecoxib可以不同程度的降低受试药物的IC50, 而且这种降低的程度与COX-2表达有关.
| 细胞系 | CPT-11 | CPT | TPT | |||
| IC50(μmol/L) | RR1 | IC50(nmol/L) | RR | IC50(nmol/L) | RR | |
| HT-29 | 7.12±3.15 | 1.00 | 64.60±30.92 | 1.00 | 87.93±13.33 | 1.00 |
| HT-29/Cele 12 | 3.77±1.94 | 1.89 | 37.00±20.61 | 1.75 | 19.23±5.97 | 4.57 |
| HT-29/Cele 5 | 0.21±0.06 | 34.03 | 1.89±0.57 | 34.24 | 2.38±1.81 | 37.00 |
| HCT-8 | 53.43±37.10 | 1.00 | 542.67±348.50 | 1.00 | 512.33±162.53 | 1.00 |
| HCT-8/Cele 1 | 68.00±32.82 | 0.79 | 47.60±40.20 | 11.40 | 163.00±36.04 | 3.14 |
| HCT-8/Cele 5 | 1.04±0.19 | 51.60 | 7.16±10.69 | 75.83 | 7.75±5.85 | 66.11 |
| HCT-116 | 66.57±23.78 | 1.00 | 358.67±203.82 | 1.00 | 59.70±35.20 | 1.00 |
| HCT-116/Cele 1 | 25.93±12.87 | 2.57 | 216.67±87.56 | 1.66 | 27.30±4.48 | 2.19 |
| HCT-116/Cele 5 | 8.98±5.12 | 7.41 | 38.57±16.68 | 9.30 | 15.07±3.84 | 3.96 |
| Caco-2 | 16.00±5.37 | 1.00 | 337.00±199.97 | 1.00 | 642.00±75.97 | 1.00 |
| Caco-2/Cele 1 | 8.22±5.71 | 1.95 | 233.00±19.00 | 1.44 | 56.83±51.25 | 11.30 |
| Caco-2/Cele 5 | 1.05±0.31 | 15.24 | 44.07±14.16 | 7.65 | 6.88±3.07 | 93.35 |
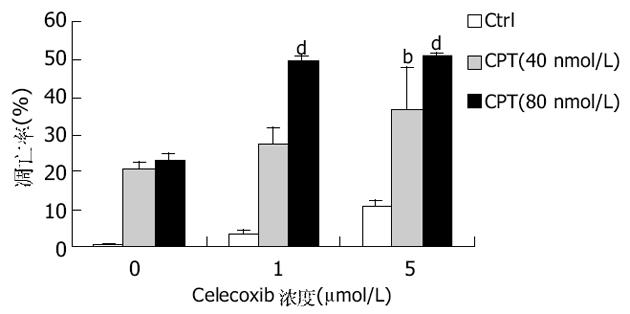
图2所示为HT-29细胞与celecoxib和/或CPT孵育48 h后流式细胞仪检测细胞凋亡的结果.celecoxib可剂量依赖性的增加CPT诱导的细胞凋亡比率(P<0.01).
celecoxib可以显著增加HT-29细胞G0/G1期的细胞比例, 而CPT则将细胞阻滞于S期.celecoxib与CPT联合应用后, G0/G1期较CPT处理组明显增加, S期和G2/M期则显著减少(P<0.01)(表2).
| 组别 | G0-G1(%) | S(%) | G2-M(%) |
| 对照组 | 58.9±2.8 | 32.7±1.1 | 10.3±0.6 |
| celecoxib 11 | 68.2±3.9 | 25.4±2.5 | 8.9±0.4 |
| celecoxib 5 | 84.5±3.2 | 11.7±3.1 | 3.5±0.5 |
| CPT(30 nmol/L) | 22.3±1.5 | 59.9±3.5 | 16.2±1.8 |
| CPT/Cele 1 | 45.7±2.2b | 48.3±2.7b | 9.0±1.1b |
| CPT/Cele 5 | 47.7±2.3b | 44.4±2.9b | 7.9±1.7b |
| CPT(60 nmol/L) | 5.5±0.9 | 81.9±4.4 | 17.6±1.9 |
| CPT 60/cele 1 | 46.7±3.4d | 44.0±1.6d | 10.5±1.5d |
| CPT 60/cele 5 | 52.1±2.8d | 43.3±2.4d | 7.6±1.2d |
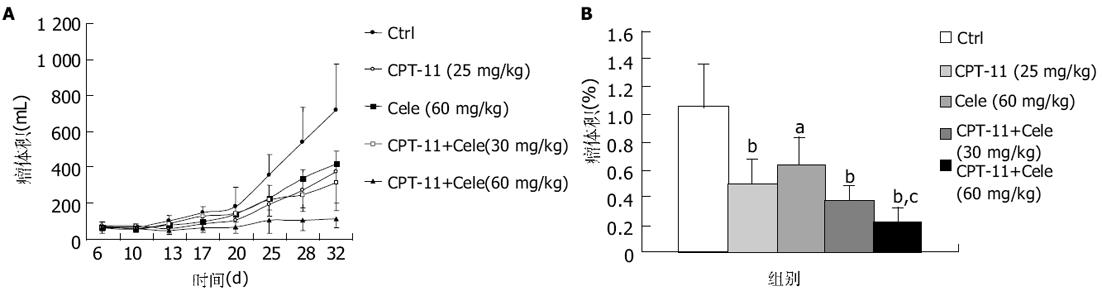
celecoxib和CPT-11均可显著抑制HT-29移植瘤的生长(图3), 二者联合应用则可以显著提高其抑制率(P<0.01), 与CPT-11组相比, 瘤重也显著降低(P<0.05).
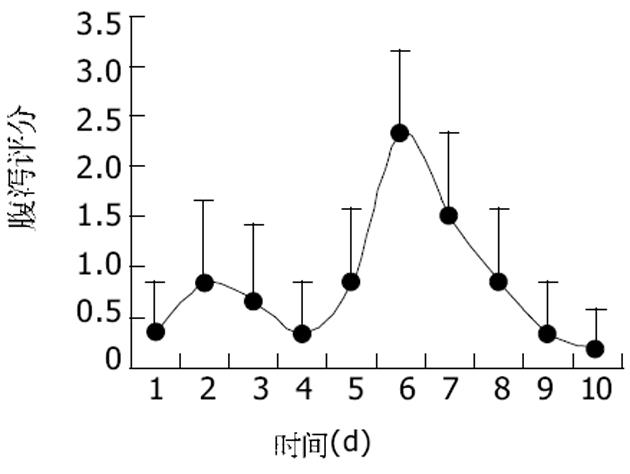
如图4所示, CPT-11可以引起小鼠产生严重的早期和晚期腹泻.早期腹泻在给药后第2 d最严重, 而晚期腹泻在第6 d达到高峰, 在第8-10 d逐渐恢复.celecoxib可以显著降低CPT-11引起的腹泻的发生, 并降低其腹泻评分, 同时增加小鼠体重(表3).
大量研究表明NSAIDs具有潜在的抗肿瘤活性, 对于多种肿瘤, 特别是结肠癌具有一定的疗效[19-20].众所周知, NSAIDs的作用靶点是COXs-花生四烯酸代谢过程中的限速酶.目前已知其至少存在两种亚型, COX-1和COX-2.COX-1属结构型(consititutive)酶, 在多种组织中呈微量表达, 其催化产物只参与维持细胞结构的完整性; COX-2属诱导型(inducible)酶, 正常组织中很少表达, 在各种刺激因素如细胞因子、炎性递质以及促癌剂等作用下, 其表达则迅速上调[21].目前研究表明, COX-2参与肿瘤的发生、发展可能与以下机制有关: 抑制凋亡; 增加肿瘤的血管生成; 对炎症的调节和抑制机体的免疫功能; 参与致癌物的活化[22]等.近年来有研究报道COX-2的选择性抑制剂可以增加化疗药的抗肿瘤疗效[7,23].我们探讨了COX-2选择性抑制剂celecoxib与细胞毒型化疗药物喜树碱及其衍生物对结肠癌的影响, 结果表明celecoxib可以显著增加四株人结肠癌细胞系对CPTs的化学敏感性, 其IC50均有不同程度的下降.这种降低的程度可能与COX-2的表达密切相关, 对于COX-2相对高表达的HT-29、HCT-8和Caco-2细胞, 其敏感性较高, 而对于COX-2不表达的HCT-116细胞, 其IC50的下降则相对较低.进一步的研究显示, 上述化学敏感性的增加可能与celecoxib增加化疗药物诱导的细胞凋亡有关.一方面, celecoxib剂量依赖性地增加CPT诱导的细胞凋亡比率; 另一方面, celecoxib使CPT处理组细胞G0/G1期细胞比例显著增加, 而S期、G2/M期细胞明显减少.
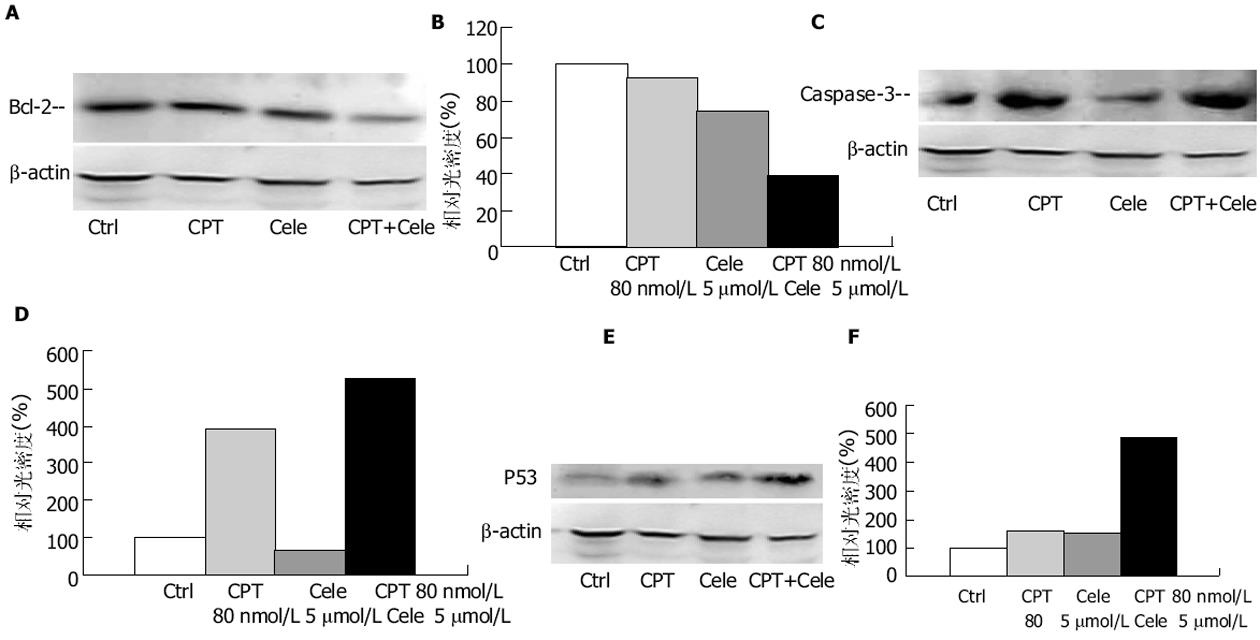
细胞凋亡是一种由细胞内基因所调控的程序性细胞自杀过程, P53、Bcl-2、c-Myc等都是细胞凋亡的重要调控因子.Bcl-2蛋白超家族在线粒体介导的凋亡途径中起着十分关键的作用, 他包括抗凋亡蛋白(Bcl-2、Bcl-xl、Bcl-w等)和促凋亡蛋白(Bad、Bak、Bax等)两大类[23].促凋亡蛋白减少或抗凋亡蛋白过渡表达与细胞癌变或降低对化疗药物的敏感性密切相关[24].本研究结果显示, celecoxib与CPT联合应用明显降低Bcl-2表达, 同时增加Caspase-3的表达, 表明celecoxib增加结肠癌细胞系对CPTs的化学敏感性可能通过降低Bcl-2表达, 促进细胞凋亡有关.
p53是一种抑癌基因, 他通过对细胞应激信号的整合而产生一系列的抗增殖效应[25], 其中最重要的效应之一为活化凋亡.P53蛋白活化凋亡的重要方式之一是作为转录因子与凋亡相关蛋白启动子区的特异序列结合, 调控下游效应基因的表达.许多研究表明, P53可以通过这种方式调控Bcl-2家族成员表达, 尽管其确切机制目前尚未完全阐明, 但最终结果是增加促凋亡蛋白与抗凋亡蛋白之间的比例, 导致凋亡蛋白从线粒体释放, Caspase活化, 启动细胞凋亡.因此p53表达的改变可以影响化疗药物诱导的细胞凋亡.此外, 在细胞应激或DNA损伤引起的细胞周期阻滞中, P53是一个关键的调控因子[26,28].Choi与Heo et al[27]的研究表明, COX-2是p53下游的靶基因, 其表达受p53调控, 但是COX-2也可以抑制P53诱导的凋亡, 这种抑制作用可以被COX-2选择性抑制剂NS-398阻断.我们的结果显示, celecoxib与CPT联合使用显著降低Bcl-2表达, 促进Caspase-3表达, 从而增加细胞凋亡比率.这种变化可能与celecoxib显著增加CPT诱导的P53的表达有关.
为了证实上述体外研究结果, 我们利用HT-29细胞裸鼠移植瘤模型观察celecoxib与CPT-11体内联合应用的抗肿瘤作用.结果显示二者联合用药显著增强CPT-11的体内抗肿瘤作用.联合用药组的肿瘤重量及瘤体积显著降低, 不仅与对照组相比具有显著差异, 而且与CPT-11组比较也具有显著差别.同时, celecoxib还显著降低CPT-11引起的腹泻发生率以及减轻腹泻的严重程度, 并缓解CPT-11引起的体重下降.Trifan与Durham et al[29]的研究表明, 在CPT-11诱导的大鼠腹泻模型中, 可以检测到COX-2的高表达以及PGE2的含量增加, 提示COX-2可能参与CPT-11诱导的晚期腹泻过程, 其选择性抑制剂可以阻断这一过程, 减轻腹泻的程度并降低腹泻的发生率.我们对COX-2抑制剂与喜树碱类衍生物的联合用药进行实验, 可以初步的得出以下结论: 一方面, celecoxib可以显著增加CPTs的体外、内抗肿瘤效应, 这种作用可能与促进凋亡和细胞周期阻滞密切相关, 而P53是其中关键的调控因子; 另一方面, COX-2选择性抑制剂celecoxib可以显著降低COX-2表达, 同时降低CPT-11引起的腹泻的发生, 显著减轻腹泻程度, 并缓解CPT-11引起的体重降低, 提示COX-2可能参与CPT-11引起的晚期腹泻过程.
编辑: 张海宁
| 1. | Arber N, Han EK, Sgambato A, Piazza GA, Delohery TM, Begemann M, Weghorst CM, Kim NH, Pamukcu R, Ahnen DJ. A K-ras oncogene increases resistance to sulindac-induced apoptosis in rat enterocytes. Gastroenterology. 1997;113:18921900. [PubMed] [DOI] |
| 2. | Lu X, Xie W, Reed D, Bradshaw WS, Simmons DL. Nonsteroidal antiinflammatory drugs cause apoptosis and induce cyclooxygenases in chicken embryo fibroblasts. Proc Natl Acad Sci USA. 1995;92:79617965. [PubMed] [DOI] |
| 3. | Piazza GA, Rahm AL, Krutzsch M, Sperl G, Paranka NS, Gross PH, Brendel K, Burt RW, Alberts DS, Pamukcu R. Antineoplastic drugs sulindac sulfide and sulfone inhibit cell growth by inducing apoptosis. Cancer Res. 1995;55:31103116. [PubMed] |
| 4. | Shiff SJ, Qiao L, Tsai LL, Rigas B. Sulindac sulfide, an aspirin-like compound, inhibits proliferation, causes cell cycle quiescence, and induces apoptosis in HT-29 colon adenocarcinoma cells. J Clin Invest. 1995;96:491503. [PubMed] [DOI] |
| 5. | Hida T, Kozaki K, Ito H, Miyaishi O, Tatematsu Y, Suzuki T, Matsuo K, Sugiura T, Ogawa M, Takahashi T. Significant growth inhibition of human lung cancer cells both in vitro and in vivo by the combined use of a selective cyclooxygenase 2 inhibitor, JTE-522, and conventional anticancer agents. Clin Cancer Res. 2002;8:2443-2447. [PubMed] |
| 6. | Ricchi P, Di Matola T, Ruggiero G, Zanzi D, Apicella A, di Palma A, Pensabene M, Pignata S, Zarrilli R, Acquaviva AM. Effect of non-steroidal anti-inflammatory drugs on colon carcinoma Caco-2 cell responsiveness to topoisomerase inhibitor drugs. Br J Cancer. 2002;86:1501-1509. [PubMed] [DOI] |
| 7. | Hida T, Kozaki K, Muramatsu H, Masuda A, Shimizu S, Mitsudomi T, Sugiura T, Ogawa M, Takahashi T. Cyclooxy-genase-2 inhibitor induces apoptosis and enhances cytotoxicity of various anticancer agents in non-small cell lung cancer cell lines. Clin Cancer Res. 2000;6:2006-2011. [PubMed] |
| 8. | Torrance CJ, Jackson PE, Montgomery E, Kinzler KW, Vogelstein B, Wissner A, Nunes M, Frost P, Discafani CM. Combinatorial chemoprevention of intestinal neoplasia. Nat Med. 2000;6:1024-1028. [PubMed] [DOI] |
| 9. | Andoh T, Ishii K, Suzuki Y, Ikegami Y, Kusunoki Y, Takemoto Y, Okada K. Characterization of a mammalian mutant with a camptothecin-resistant DNA topoisomerase I. Proc Natl Acad Sci USA. 1987;84:55655569. [PubMed] [DOI] |
| 10. | Thomas CJ, Rahier NJ, Hecht SM. Camptothecin: current perspectives. Bioorg Med Chem. 2004;12:1585-1604. [PubMed] [DOI] |
| 11. | Rothenberg ML. Topoisomerase I inhibitors: review and update. Ann Oncol. 1997;8:837-855. [PubMed] [DOI] |
| 12. | Hecht JR. Gastrointestinal toxicity of irinotecan. Oncology(Williston Park). 1998;12:7278. [PubMed] |
| 13. | Bleiberg H, Cvitkovic E. Characterisation and clinical management of CPT-11 (irinotecan)-induced adverse events: the European perspective. Eur J Cancer. 1996;32A:S18-23. [PubMed] [DOI] |
| 14. | Kawato Y, Sekiguchi M, Akahane K, Tsutomi Y, Hirota Y, Kuga H, Suzuki W, Hakusui H, Sato K. Inhibitory activity of camptothecin derivatives against acetylcholinesterase in dogs and their binding activity to acetylcholine receptors in rats. J Pharm Pharmacol. 1993;45:444-448. [PubMed] [DOI] |
| 15. | Kase Y, Hayakawa T, Togashi Y, Kamataki T. Relevance of irinotecan hydrochloride-induced diarrhea to the level of prostaglandin E2 and water absorbtion of large intestine in rats. Jpn J Pharmacol. 1997;75:399405. [PubMed] |
| 16. | Sakai H, Sato T, Hamada N, Yasue M, Ikari A, Kakinoki B, Takeguchi N. Thromboxane A2, released by the anti-tumor drug irinotecan, is a novel stimulator of Cl-secretion in isolated rat colon. J Physiol. 1997;505:133144. [PubMed] |
| 17. | Nicoletti I, Migliorati G, Pagliacci MC, Grignani F, Riccardi C. A rapid and simple method for measuring thymocyte apoptosis by propidium iodide staining and flow cytometry. J Immunol Methods. 1991;139:271-279. [PubMed] [DOI] |
| 18. | Kurita A, Kado S, Kaneda N, Onoue M, Hashimoto S, Yokokura T. Modified irinotecan hydrochloride (CPT-11) administration schedule improves induction of delayed-onset diarrhea in rats. Cancer Chemother Pharmacol. 2000;46:211220. [PubMed] [DOI] |
| 19. | Taketo MM. Cyclooxygenase-2 inhibitors in tumorigenesis (Part II). J Natl Cancer Inst. 1998;90:16091620. [PubMed] [DOI] |
| 20. | Ziegler J. Cancer and arthritis share underlying processes. J Natl Cancer Inst. 1998;90:802-803. [PubMed] [DOI] |
| 21. | Leahy KM, Ornberg RL, Wang Y, Zweifel BS, Koki AT, Masferrer JL. Cyclooxygenase-2 inhibition by celecoxib reduces proliferation and induces apoptosis in angiogenic endothelial cells in vivo. Cancer Res. 2002;62:625-631. [PubMed] |
| 22. | Dempke W, Rie C, Grothey A, Schmoll HJ. Cyclooxygenase-2: a novel target for cancer chemotherapy? J Cancer Res Clin Oncol. 2001;127:411417. [PubMed] [DOI] |
| 23. | Soriano AF, Helfrich B, Chan DC, Heasley LE, Bunn PA Jr, Chou TC. Synergistic effects of new chemopreventive agents and conventional cytotoxic agents against human lung cancer cell lines. Cancer Res. 1999;59:6178-6184. [PubMed] |
| 24. | Cory S, Adams JM. The Bcl2 family: regulators of the cellular life-or-death switch. Nat Rev Cancer. 2002;2:647656. [PubMed] [DOI] |
| 25. | Danial NN, Korsmeyer SJ. Cell death: critical control points. Cell. 2004;116:205-219. [PubMed] [DOI] |
| 28. | Choi EM, Heo JI, Oh JY, Kim YM, Ha KS, Kim JI, Han JA. COX-2 regulates p53 activity and inhibits DNA damage-induced apoptosis. Biochem Biophys Res Commun. 2005;328:1107-1112. [PubMed] [DOI] |
| 29. | Trifan OC, Durham WF, Salazar VS, Horton J, Levine BD, Zweifel BS, Davis TW, Masferrer JL. Cyclooxygenase-2 inhibition with celecoxib enhances antitumor efficacy and reduces diarrhea side effect of CPT-11. Cancer Res. 2002;62:5778-5784. [PubMed] |