修回日期: 2005-04-12
接受日期: 2005-04-20
在线出版日期: 2005-08-15
目的: 观察中药白术对肝硬化大鼠胃动力及胃肌间神经丛氮能神经的影响.
方法: Wister大鼠24只随机分为肝硬化模型组, 白术治疗组和对照组, 采用葡聚糖蓝-2000为胃肠内标记物观察大鼠胃动力变化, NADPH-d组织化学染色及肌间神经丛全层铺片技术, 观察肝硬化大鼠胃底、胃体及胃窦肌间神经丛氮能神经的变化, 并对其分布进行定量分析.
结果: 与对照组比较, 肝硬化组大鼠胃动力明显减弱(160.23±45.13 vs 100±17.78, P<0.01), 胃体、胃窦肌间神经丛氮能阳性神经排列紊乱, 染色增强, 密度增加, 明显高于对照组(7.35±0.95 vs 5.52±0.92, P<0.01或6.26±0.79 vs5.28±0.78, P<0.05), 胃底肌间神经丛氮能阳性神经元数量及分布无明显变化; 中药治疗组肝硬化大鼠胃动力明显改善(100±17.78 vs 96.12±16.25), 胃窦肌间神经丛氮能阳性神经明显恢复(5.39±0.84 vs 5.28±0.78), 与对照组比较均无明显变化(P>0.05).
结论: 中药白术对肝硬化大鼠胃动力减退有治疗作用, 其机制与改善胃窦肌间神经丛氮能神经分布有关.
引文著录: 朱金照, 许其增, 张志坚, 乐桥良. 白术对肝硬化大鼠胃动力和氮能神经分布的影响及意义. 世界华人消化杂志 2005; 13(15): 1846-1848
Revised: April 12, 2005
Accepted: April 20, 2005
Published online: August 15, 2005
AIM: To observe the effects of atractylodes macrocephalae (AM) on gastric motility and nitrergic nerval system in rats with hepatic cirrhosis.
METHODS: Twenty-four Wister rats were randomly divided into control group, cirrhosis model group and AM treatment group. Dextran blue-2000 was used as an internal marker to assay the gastric emptying of the rats. The nitrergic nerves in the myenteric plexuses of gastric fundus, body and antrum were observed with NADPH-d histochemical staining.
RESULTS: Compared with those in control group, the gastric emptyings of rats were markedly delayed in model group (160.23±45.13 vs 100±17.78, P<0.01), and the distributions and densities of myenteric nitrergic nerves in the gastric body and antrum were significantly increased (7.35±0.95 vs 5.52±0.92, P<0.01; 6.26±0.79 vs 5.28±0.78, P<0.05). No significant changes were found in the fundus. After treatment with AM, the gastric motility of rats was markedly improved and the nitrergic nerves in antrum were significantly recovered. No significant differences were observed between the rats of AM and control group (96.12±16.25 vs 100±17.78, 5.39±0.84 vs 5.28±0.78, both P>0.05).
CONCLUSION: Atractylodes macrocephalae can improve the gastric motility and the mechanism may be related to its effect on the distributions of nitrigic nerves in the gastric body and antrum of rats with hepatic cirrhosis.
- Citation: Zhu JZ, Xu QZ, Zhang ZJ, Le QL. Effects of Atractylodes macrocephalae on gastric emptying and nitrergic nerves in rats with hepatic cirrhosis. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1846-1848
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1846.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1846
肝硬化患者存在明显的胃肠动力异常[1-5]. 近年研究发现中药对胃肠动力有重要的调节作用[6-12]. 但是否对肝硬化胃肠动力障碍有治疗作用还不明确. 我们通过建立肝硬化大鼠模型, 观察中药白术对肝硬化大鼠胃排空和胃肌间神经丛氮能神经的影响, 为临床治疗肝硬化胃肠动力障碍提供一定的依据.
白术水提取液制备白术由福州总医院中药房提供, 产地浙江, 冬季收集, 先用5-7倍的蒸馏水浸泡60 min, 然后用玻璃杯恒温电炉上煮30 min, 煎液过滤, 制成250 g/L, 4 ℃备用. 清洁级Wister大鼠24只(上海实验动物中心提供), 雌雄不限, 质量200-250 g, 随机分为3组: 正常对照组, 肝硬化模型组(下称模型组)和中药治疗组各8只. 模型组大鼠给予500 mL/L CCl4溶剂大腿根部SC, 5 mL/kg, 2次/wk, 并根据质量变化调整剂量, 共12 wk. 中药治疗组在造模9 wk, 给予灌服250 g/L白术水提取液10 mL/kg, 1次/d, 共4 wk. 模型组及中药治疗组同时给予含300 g/L, 食用猪油、5 g/L胆固醇的饲料, 自由饮水.
造模成功后, 大鼠处死开腹取胃, 沿大弯侧剪开, 将胃内残留色素充分洗于4 mL去离子水中, 3 500 r/min离心15 min, 取上清滤液, 以721-A型分光光度计l620 nm测吸光度为其胃内色素残留吸光度值, 求出与对照组均值的百分比, 即为胃内色素相对残留率, 胃内色素相对残留率越低表示胃排空速率越快[13]. 胃底、胃体、胃窦标本入100 g/L甲醛+10 g/L氯化钙液中, 4 ℃过夜. 将标本先用蒸馏水漂洗5 min, 然后将标本剪成0.5×0.5 cm大小若干入0.01 moL/L PBS液中, 用钟表镊轻轻剥离出纵肌层, 用0.02 mo1/L多聚甲醛磷酸缓冲液(pH7.2-7.6)洗片2次, 在含NADPH(0.1 g/L, Sigma公司)、NBT(0.2 g/L, Sigma公司)和30 g/L Triton X-100的0.02 moL/L PBS(pH 7.4-7.6)工作液中孵育20 min, 用PBS液漂洗中止反应. 裱片, 脱水, 透明, 封片. 采用MAS-5图像分析系统. 选取同一染色条件下组化片, 每张切片于200倍光镜下选取5个视野, 观察肌间神经丛中阳性神经元的染色及分布情况, 将图像扫描入计算机, 设定基础统计面积, 调定灰度值. 滤去非阳性部分, 得到阳性表达面积, 通过计算机分析即可得到阳性表达的密度.
统计学处理 数据以mean±SD表示. 组间差异采用t检验.
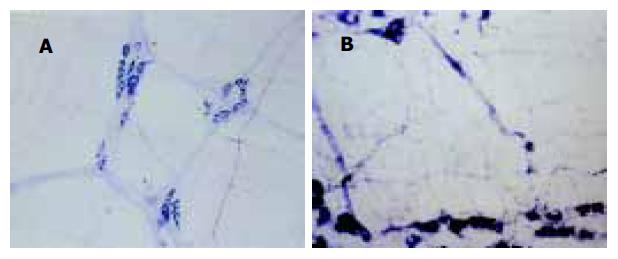
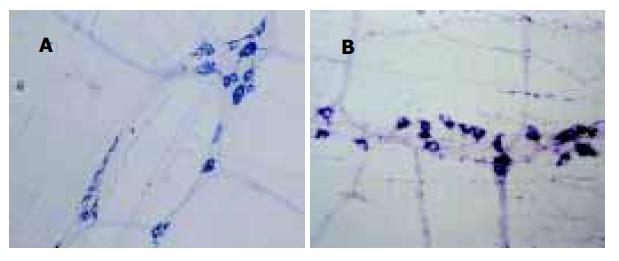
与对照组比较, 肝硬化模型组, 大鼠胃内色素相对残留率明显增加, 表明肝硬化大鼠胃排空显著减弱(160.23±45.13 vs100±17.78, P<0.01). 组化染色显示NOS阳性产物为蓝色沉淀. 肌间神经丛主要由神经节、节间束及一些含膨体的阳性神经纤维纵横交织呈网状分布, 神经节多呈梭形, 大小不等, 节间束与纵肌平行, 其中有含膨体的阳性纤维. 高倍镜下, 阳性神经形态、大小不等, 胞质呈蓝色, 核不着色, 胞体形态多样, 有卵圆形、三角形及不规则形. 与对照组比较, 肝硬化组肌间NOS阳性神经丛排列较粗乱, 神经元数量增加, 染色深, 以胃窦、胃体肌间神经丛明显(图1-2, P<0.01或P<0.05); 中药白术治疗组肌间NOS阳性神经丛排列较规律, 胃窦神经元数量较肝硬化模型组减少, 染色较浅, 与对照组无明显差异(P>0.05, 表1).
肝硬化是临床上常见的慢性肝病, 患者常出现食欲减退、嗳气、腹胀等胃肠功能障碍症状, 严重影响患者的生存质量. 本实验证实肝硬化大鼠胃排空明显延迟, 经中药白术治疗后, 大鼠胃排空显著好转, 但中药白术改善肝硬化大鼠胃动力的机制尚不明确. 研究发现NO作为氮能神经系统的神经递质, 在肝硬化的病理生理及胃肠功能调节中起非常重要的作用[14-23].NOS是NO合成的关键酶, 现已证实NOS神经元广泛分布于人和动物的整个胃肠道[24-27]. 根据NOS的生物学特性, 可将NOS分为两类三型同工酶, I型(NOSI)和Ⅲ型(NOSⅢ)属原生型NOS(cNOS), Ⅱ型(NOSⅡ)属诱生型NOS(iNOS). 一般在生理状态下cNOS即表现出一定的活性, 保持NO的基础释放量, 起神经递质和第二信使的作用, iNOS仅在内毒素及细胞因子等刺激下才显示一定活性, 催化产生的NO具有细胞毒作用, 参与免疫反应. NADPH黄递酶作为NOS组织化学标记物已被广泛应用于NOS的定位研究, 我们探索应用胃肌间神经丛全层铺片NADPH组化染色技术, 结果表明能清晰的显示NOS神经元及神经的分布情况. 正常对照组大鼠胃NOS阳性神经纤维呈蓝色网状, 神经节内有圆形或卵圆形的NOS神经元, 胞质呈蓝色. 肝硬化大鼠胃底、胃体、胃窦肌间神经丛NOS阳性神经排列均较紊乱, 胃体、胃窦NOS神经变粗, 神经元数量增加, 染色深, 胃底NOS神经元数量及染色无明显变化, 计算机定量分析显示胃体、胃窦NOS阳性神经含量明显高于对照组. 中药白术治疗后, 全胃肌间神经丛NOS阳性神经排列较规律, 与肝硬化模型鼠比较, 胃窦NOS神经元染色变浅. 定量分析表明与对照组无明显差异.
总之, 肝硬化大鼠胃动力明显减退, 胃体、胃窦肌间神经丛氮能阳性神经明显增加, 胃底肌间神经丛氮能阳性神经分布无明显变化, 中药白术对肝硬化大鼠胃动力减退有调节作用, 其机制可能减少胃窦肌间神经丛氮能阳性神经的分布有关.
编辑: 潘伯荣 审读:张海宁
| 4. | Song HL, Zhu YH, Liu GM. A Study on the relationship between gastric motility and plasma motilin in the patients with hepatocirrhosis. J Postgrad Med. 2001;24:14-15. |
| 11. | Wang XQ, Wang XJ, Li Y. Effect of xiang sha ping wei san on gastric emptying motility in mice. Shijie Huaren Xiaohua Zazhi. 2003;11:571-574. |
| 12. | Li Y, Wang XQ, Zhang WW, Wang JY. Effect of zhu xiang power on gastric and intestinal motility in mice. Shijie Huaren Xiaohua Zazhi. 2003;11:575-577. |
| 13. | Zhu JZ, Leng ER, Chen DF, Shi HT, Gui XY. A screening study of the kinetogenic effects of 15 chinese herbal medicines on the gastrointestinal tract in rats. Acta Academiae Militaris Tertiae. 2000;22:436-438. |
| 14. | Wang X, Zhong YX, Zhang ZY, Lu J, Lan M, Miao JY, Guo XG, Shi YQ, Zhao YQ, Ding J. Effect of L-NAME on nitric oxide and gastrointestinal motility alterations in cirrhotic rats. World J Gastroenterol. 2002;8:328-332. [PubMed] [DOI] |
| 15. | Yao DM, Yao XX, Yang CJ, Feng ZJ, Fang HM, Gao JP. Effect s of ET-1 and NO on hepatic hemodynamics at various stages of isolated perfused cirrhotic liver in rats. Shijie Huaren Xiaohua Zazhi. 2003;11:726-729. |
| 16. | Wang Y, Zhou Z, Wang XQ. Study of NO and CGRP in plasma in cirrhotic patients. Shijie Huaren Xiaohua Zazhi. 2003;11:358-359. |
| 17. | Ramachandran A, Prabhu R, Thomas S, Reddy JB, Pulimood A, Balasubramanian KA. Intestinal mucosal alterations in experimental cirrhosis in the rat: role of oxygen free radicals. Hepatology. 2002;35:622-629. [PubMed] [DOI] |
| 18. | Madrid AM, Hurtado C, Venegas M, Cumsille F, Defilippi C. Long-Term treatment with cisapride and antibiotics in liver cirrhosis: effect on small intestinal motility, bacterial overgrowth, and liver function. Am J Gastroenterol. 2001;96:1251-1255. [PubMed] [DOI] |
| 19. | Kato S, Suzuki K, Ukawa H, Komoike Y, Takeuchi K. Low gastric toxicity of nitric oxide-releasing aspirin, NCX-4016, in rats with cirrhosis and arthritis. Dig Dis Sci. 2001;46:1690-1699. [PubMed] [DOI] |
| 20. | Wang ZQ, Watanabe Y, Toki A, Kohno S, Hasegawa S, Hamazaki M. Involvement of endogenous nitric oxide and c-kit-expressing cells in chronic intestinal pseudo-obstruction. J Pediatr Surg. 2000;35:539-544. [PubMed] [DOI] |
| 21. | Wang YM, Feng GH. Relation of NO and liver regeneration in rats with experimental liver failure. Shijie Huaren Xiaohua Zazhi. 2000;8:109-110. |
| 22. | Li WJ, Sun JY, Wang XM, Zhang SS, Yang SC. Changes of NO and ET in patients cirrhosis with hepatorenalsyndrom. Shijie Huaren Xiaohua Zazhi. 2000;8:484-485. |
| 23. | Zhang ZP, Zhang ZJ, Zhang J, Wang W, Lin KR, Zhu JZ. Changes of intestinal cholinergic and nitrergic nerves in rats with cirrhosis. Shijie Huaren Xiaohua Zazhi. 2004;12:1459-1461. |
| 24. | Peng X, Feng JB, Wang SL. Distribution of nitric oxide synthase in stomach wall in rats. World J Gastroenterol. 1999;5:92. [PubMed] [DOI] |
| 25. | Shao RX, Wang JB, Guo JH. The plasma level of and the expression of inducible nitric oxide synthase in human hepatocellular carcinoma. World J Gastroenterol. 2000;6:61. |
| 26. | Kohjitani A, Miyawaki T, Funahashi M, Mitoh Y, Matsuo R, Shimada M. Mexiletine inhibits nonadrenergic noncholinergic lower oesophageal sphincter relaxation in rabbits. Eur J Pharmacol. 2003;465:145-151. [PubMed] [DOI] |