修回日期: 2005-06-10
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 研究H. pylori菌体蛋白对Hela细胞增殖的影响及牛抗H. pylori抗体对H. pylori菌体蛋白的中和作用.
方法: H. pylori超声全菌抗原接种奶牛, 按多克隆抗体制备常规, 腋下皮下接种, 全程免疫后每1-2 mo加强1次, 琼脂双向扩散至1:32时可采集牛血制备抗血清, 同期收集牛常乳. 抗血清及牛乳低温保存备用. 经500、330、330 g/L饱和硫酸铵粗提后, 沉淀用生理盐水溶解, 对生理盐水透析24 h, 上DEAE-32柱, 收集高峰蛋白, 经SDS-PAGE鉴定后分装, -20 ℃保存. 通过Hela生长曲线确定Hela细胞的接种密度. 建立SS1及NCTC11637对Hela 细胞生长增殖功能的抑制作用的MTT分析方法, 以牛抗H. pylori IgG分别与SS1及NCTC11637共育2 h后各自对Hela增殖功能的抑制率变化来评价牛抗H. pylori IgG对SS1及NCTC11637菌体蛋白的中和作用.
结果: 细胞毒模型发现SS1与NCTC11637均能浓度依赖性地抑制Hela细胞增殖(SS1: r = 0.9 594; NCTC11637: r = 0.9 371), Hela细胞圆缩、边界突显, 胞质内可见较多颗粒, 折光性差, 至高浓度抗原孔, Hela多见碎片, 或明显皱缩. 但对于相同的细胞毒效应SS1所需浓度高于NCTC11637; 中和模型发现牛特异性IgG可分别中和SS1及NCTC11637的细胞毒作用, 且具有剂量-反应关系(SS1: r = -0.9 936; NCTC11637: r = -0.9 627).
结论: 牛抗H. pylori抗体能够剂量依赖地中和H. pylori对Hela细胞生长增殖的抑制作用.
引文著录: 张世联, 刘冉, 王薇. 牛幽门螺杆菌抗体中和菌体蛋白对Hela细胞的生长抑制作用. 世界华人消化杂志 2005; 13(15): 1828-1833
Revised: June 10, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
AIM: To investigate the inhibitory effects of SS1 and NCTC11637 antigens on the proliferation of Hela cells, and to observe the neutralization of bovine anti-Helicobacter pylori antibodies against SS1 and NCTC11637.
METHODS: The cows were immunized with sonicated Helicobacter pylori (H. pylori) antigen. After the scheduled immunization was completed, the immunization was strengthened with an interval of 1-2 month.The bovine serum was prepared when the ratio in agar-double diffusion was 1:32. The bovine milk was collected at the same time. The serum proteins (81.4g/L) were isolated and purified by saturated ammonium sulfate (500, 330, 330 g/L) and DEAE-32. The obtained proteins were identified by SDS-PAGE. Bovine anti-H. pylori IgGs were incubated with SS1 or NCTC11637, respectively, at 37 ℃ for 2 h, and then added into the solutions including Hela cells. The proliferation of Hela cells was determined by cell growth curve. MTT assay was adopted to evaluate the inhibitory effects of SS1 and NCTC11637 antigens on the proliferation of Hela cells.
RESULTS: The bacterial protein of SS1 and NCTC11637 inhibited the proliferation of Hela cells in a concentration-dependent manner (SS1: r = 0.9 594; NCTC11637: r = 0.9 371), and the cells manifested apoptotic or lysed features. For the same effect, a higher concentration of SS1 was needed. After treatment with bovine anti-H. pylori IgG, the inhibitory effects of SS1 and NCTC11637 on Hela cells were neutralized, and their inhibition rates were negatively related with the concentration of bovine anti-H. pylori IgG (SS1: r = -0.9 936; NCTC11637: r = -0.9 627).
CONCLUSION: SS1 and NCTC11637 can inhibit the proliferation of Hela cells, and bovine anti-H. pylori antibodies can neutralize the inhibiting action in a concentration-dependent manner.
- Citation: Zhang SL, Liu R, Wang W. Bovine anti-Helicobacter pylori antibodies neutralize inhibitory effects of SS1 and NCTC11637 antigens on proliferation of Hela cells. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1828-1833
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1828.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1828
自1988年Leunk et al[1]报道VacA(vacuolating cytotoxin)可致Hela细胞空泡改变以来, VacA及与其活性密切相关的CagA(cytotoxin associating gene protein, Cag A)的基因型常被作为H. pylori是否毒力株的重要标志, 但有研究发现VacA+/CagA+的SS1株由于VacA基因型为s2-m2, 不具有诱导Hela空泡形成的能力[2], 而作为适应小鼠H. pylori感染模型的菌株SS1, 有感染率高, 慢性炎症发生率高且持久的特点[3]. SS1株能否引起小鼠胃上皮的直接损伤, 而不仅是细胞免疫反应的间接损害[4-5], 是此次研究要解决的一个问题. 为此我们比较了VacA为s2-m2的SS1株与具有致Hala空泡能力的NCTC11637株对Hela细胞生长与增殖影响. 幽门螺杆菌(H. pylori)作为慢性胃炎、消化性溃疡、胃癌、MDLT淋巴瘤的重要危险因子, 已受到广泛重视[6-10], 而抗生素治疗的副作用或耐药性常导致治疗失败[11,15,29], 我们设想通过口服抗体制剂局部中和H. pylori的毒性蛋白. 我们即检验了抗H. pylori IgG是否有中和作用, 为进一步体内试验验证IgG的预防和治疗效果提供了体外实验依据.
菌株SS1及NCTC11637均由河北医科大学中医学院惠赠. 空肠弯曲菌选择性琼脂基础购自中国腹泻病控制上海试剂供应研究中心, Hela细胞由河北省二院赠送. H. pylori菌株培养采用空肠弯曲菌选择性琼脂基础加100 g/L脱纤维羊血, 在混合气体条件下(N2 850 mL/L、CO2 50 mL/L、H2 100 mL/L)37 ℃培养48-72 h.H. pylori的血平板培养物用生理盐水洗涤重新混悬, 在冰浴中超声粉碎6次每次间隔1 min, 4 ℃离心10 000 g×30 min, 弃沉渣, 测定上清液Pr浓度(紫外吸收法)SS1:1.29 g/L, NCTC11637:0.8 g/L.0.22 mm滤器过滤除菌、分装-20 ℃保存. 免疫牛特异性IgG制备参照文献[12]按多克隆抗体制备技术免疫奶牛, 抗血清以饱和硫酸铵粗提取, DEAE-32柱层析, 洗脱液收集高峰测蛋白后, 冻干保存.
Hela细胞培养在DMEM(100 mL/L小牛血清、100 kU/L青霉素、100 kU/L链霉素)培养液中置37 ℃、50 mL/L CO2培养箱内培养, 每2 d传代1次, 以2.5 g/L胰蛋白酶、0.2 g/L EDTA消化. 细胞生长曲线测定:Hela消化10 min后GKN洗2次, 计数, 将细胞密度调节为2.5×109/L, 取0.5 mL, 用DMEM对倍稀释后, 配成10个稀释度, 在40孔培养板中每孔加200 mL, 每个稀释度重复4孔, 培养48 h后, 作MTT测定. Hela阳性对照抑制药物的筛选: 取一40孔培养板, 加入14种常用抗肿瘤药物20 mL, 分别加入Hela细胞2×103/孔, 37 ℃, 50 mL/L CO2培养48 h后, 加MTT 20 mL/孔, 37 ℃、50 mL/L CO2 4 h后1 500 r/min×10 min, 弃上清, 加DMSO 100 mL, 振荡混匀后l570 nm处测光密度, 以不加细胞的孔为空白对照, 以不加药物只加细胞的孔存活率为100%, 计算Cell抑制率 = (1-实验组平均A值÷对照组平均A值)×100%. 为分析Hela细胞对HRP-牛IgG的吸附作用, 将Hela细胞计数后(3×106)PBS洗2次, 加固定剂100 mL固定, 板条预先加黏附剂烘干, Hela细胞用固定剂稀释成10个倍比梯度后, 每孔加细胞悬液5 mL, 重复4孔, 4 ℃过夜, 50 g/L脱脂奶粉封闭过夜后, 加HRP-牛特异性IgG(1:200)37 ℃水浴30 min, 以只加黏附剂, 不加固定剂为空白对照, 以只加黏附剂和固定剂, 不加细胞为阴性对照. PRS洗3次后加底物显色, l450 nm处比色. H. pylori菌体蛋白与Hela细胞作用的ELISA参照文献[13], Hela细胞数2×104/孔, 加菌体蛋白的稀释系列37 ℃ 1 h后, HRP-牛特异性IgG 37 ℃ 30 min, 底物显色3 min, l450 nm处比色. H. pylori菌体蛋白抑制Hela增殖的MTT分析: 将Hela细胞以2×103/孔密度接种于40孔板, 分别加入不同浓度的SS1/NCTC11637菌体蛋白, 每一浓度重复4孔, 培养48 h后, 加MTT续培养4 h, 测定方法参见[14], 检测中设一阳性对照, 一阴性对照. 牛特异性IgG单独加入Hela细胞培养48 h, 分析牛特异性IgG对Hela细胞的作用. H. pylori菌体蛋白(SS1:162.5 mg/L; NCTC11637:50 mg/L)分别与牛特异性IgG(500-4 mg/L)37 ℃共育2 h后加入Hela细胞中培养, 培养48 h后作MTT分析.
统计学处理 采用SAS6.12直线回归与相关分析推断各处理剂量与Hela细胞反应率之间的关系, 倍比梯度剂量经对数变换转为正态分布后进行分析.
| 药物 | A (mean±SD) | 抑制率(%) |
| 1(ADM) | 0.95±0.04 | 10.45 |
| 2(CDDP) | 1.20±0.10 | 0 |
| 3(CTX) | 1.34±0.10 | 24.63 |
| 4(5-FU) | 1.01±0.12 | 56.72 |
| 5(HRT) | 0.58±0.06 | 8.21 |
| 6(MMC) | 1.23±0.14 | 8.21 |
| 7(VCR) | 1.23±0.14 | 17.16 |
| 8(VP-16) | 1.11±0.03 | 32.09 |
| 9(MTX) | 0.91±0.02 | 2.99 |
| 10(CBDCA) | 1.30±0.04 | 30.60 |
| 11(THP) | 0.93±0.01 | 70.90 |
| 12(EADM) | 0.39±0.06 | 19.40 |
| 13(Ara-C) | 1.08±0.02 | 2.99 |
| 14(ICTX) | 1.30±0.04 | 10.45 |
接种细胞密度以(1-4)×103/孔为宜, 培养48 h, A值在1-2范围内. Hela对三尖杉酯碱(HRT)、甲氨喋呤(MTX)、吡柔比星(THP), 表阿霉素(EADM)均敏感, 本试验采用三尖杉酯碱(HRT)为抑制Hela增殖的阳性对照物.
研究表明牛特异性IgG对Hela细胞无特异性结合. 进一步的细胞ELISA结果发现菌体蛋白的浓度对数值与光密度值之间呈良好的直线相关关系(r = 0.9 622), 回归方程A = 0.0 418±0.1 157 LnC说明菌体蛋白能与Hela细胞结合, 并呈剂量依赖关系(表2).
| SS1蛋白(mg/L) | A(mean±SD) |
| 1 300 | 1.26±0.05 |
| 130 | 0.71±0.20 |
| 65 | 0.77±0.06 |
| 32.5 | 0.64±0.07 |
| 16.25 | 0.55±0.17 |
| 8.13 | 0.59±0.11 |
| 4.06 | 0.40±0.04 |
| 2.03 | 0.39±0.06 |
| 1.02 | 0.32±0.06 |
| 0.51 | 0.27±0.01 |
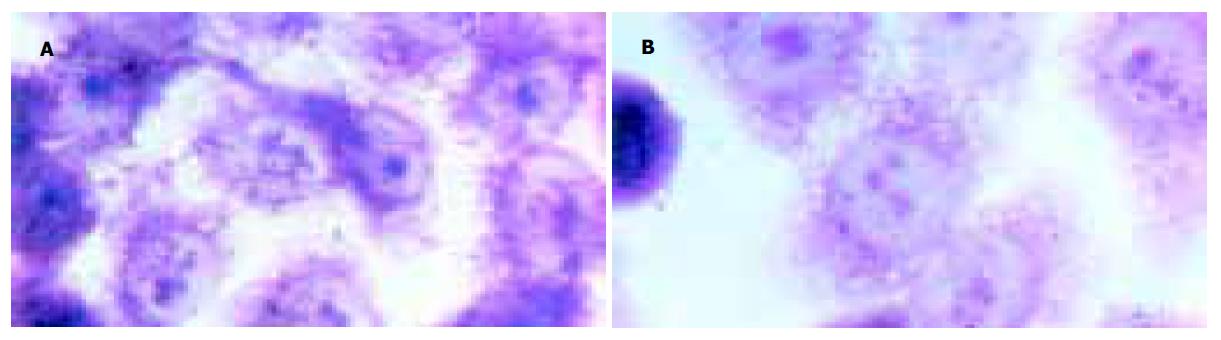
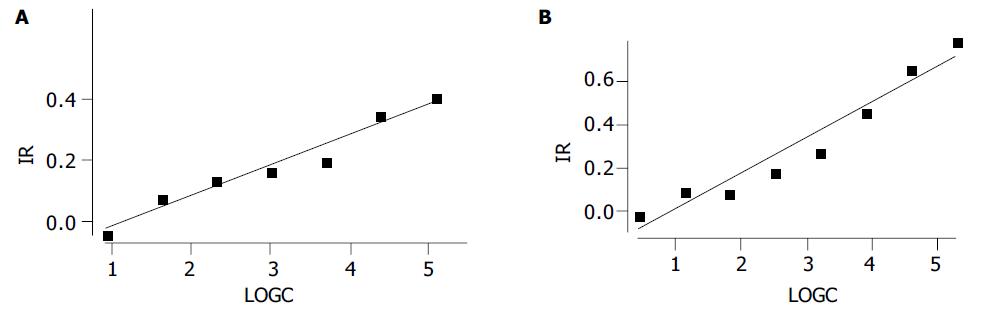
正常生长的Hela细胞呈贴壁的多形性, 细胞折光性好, 胞质透亮, 胞膜较清晰. H. pylori蛋白作用48 h后, 随菌体蛋白浓度增高, 可见孔内Hela细胞贴壁减少. 细胞圆缩、边界突显, 胞质内可见较多颗粒, 折光性差. 至高浓度抗原孔, Hela多见碎片, 或明显皱缩. MTT分析结果可见细胞抑制率随菌体蛋白剂量增加而增加, SS1蛋白与NCTC 11637对Hela细胞的毒性反应相似, 其差异主要表现在诱导相同Hela毒性反应的浓度不同(表3, 4; 图2AB), 实验同时应用SS1菌株与Hela细胞共育, 可见细胞周围有大量H. pylori附着(图1A).
| SS1蛋白(mg/L) | A(mean±SD) | IR(%) |
| 2.54 | 0.96±0.01 | -3.81 |
| 5.08 | 0.85±0.06 | 8.15 |
| 10.16 | 0.79±0.03 | 13.86 |
| 20.31 | 0.77±0.05 | 17.12 |
| 40.63 | 0.63±0.02 | 20.38 |
| 81.25 | 0.60±0.02 | 35.05 |
| 162.50 | 0.54±0.03 | 41.49 |
| 325 | 0.26±0.02 | 71.42 |
| Control | 0.92±0.02 | - |
| NCTC11637 protein(mg/L) | A(mean±SD) | IR(%) |
| 1.56 | 0.94±0.02 | -1.82 |
| 3.13 | 0.83±0.05 | 9.40 |
| 6.25 | 0.84±0.02 | 9.24 |
| 12.50 | 0.76±0.03 | 17.93 |
| 25 | 0.67±0.01 | 27.17 |
| 50 | 0.50±0.02 | 45.92 |
| 100 | 0.31±0.01 | 66.03 |
| 200 | 0.19±0.04 | 79.08 |
| control | 0.92±0.02 | - |
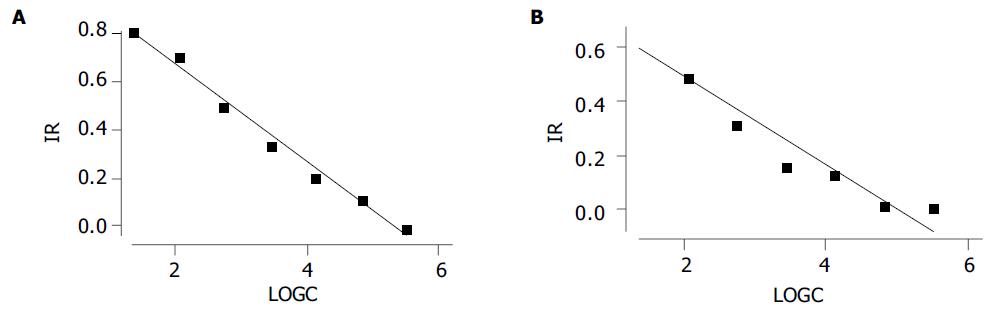
单独应用牛特异性IgG并不影响Hela的生长与增殖, 其细胞增殖形态及数量与无牛IgG作用的Hela细胞对照相似, 统计分析表明二者无明显相关. 牛抗H. pylori IgG与SS1/NCTC11637菌体蛋白分别共育2 h后, 加入Hela细胞培养48 h, 以三尖杉酯碱为阳性抑制对照, 以单加SS1/NCTC11637为中和作用阴性对照, 可见随IgG浓度升高, Hela细胞贴壁增多, 圆形及皱缩细胞量减少, 折光性增强, 细胞岛的数量亦增多, MTT分析结果可见细胞抑制率随抗H. pylori IgG剂量增加而降低, 呈显著负相关(表5, 6; 图3AB), 此外将特异牛IgG与SS1菌株同时加入Hela细胞中, 共育24 h可见贴壁的Hela细胞周围无H. pylori黏附(图1B).
| 牛抗H. pylori IgG(mg/L) | A(mean±SD) | IR(%) |
| 500 | 0.86±0.01 | 4.54 |
| 250 | 0.92±0.02 | -1.57 |
| 125 | 0.80±0.00 | 11.75 |
| 62.5 | 0.72±0.06 | 20.63 |
| 31.25 | 0.60±0.05 | 33.96 |
| 15.63 | 0.45±0.04 | 50.05 |
| 7.81 | 0.26±0.02 | 71.70 |
| 3.91 | 0.17±0.01 | 81.69 |
| 0 | 0.16±0.04 | 82.78 |
| Control | 0.90±0.13 | - |
| 牛抗H. pylori IgG (mg/L) | A(mean±SD) | IR(%) |
| 500 | 0.80±0.05 | 11.75 |
| 250 | 0.89±0.10 | 1.21 |
| 125 | 0.89±0.02 | 1.76 |
| 62.5 | 0.78±0.028 | 13.42 |
| 31.25 | 0.76±0.02 | 16.19 |
| 15.63 | 0.62±0.02 | 31.73 |
| 7.81 | 0.46±0.04 | 49.49 |
| 3.91 | 0.29±0.01 | 67.81 |
| 0 | 0.27±0.05 | 69.72 |
| Control | 0.90±0.13 | - |
在慢性胃炎, 消化性溃疡等上消化道慢性炎症性疾病的发病中, H. pylori毒力株常被认为是重要的致病因素[15-17]. 采用两株毒力株, 但SS1不具有致空泡毒性, NCTC 11637可致Hela细胞空泡变. 两株H. pylori除空泡毒素分泌活性不同外, 均可产生尿素酶、过氧化氢酶、HSP54等毒性蛋白. 两株H. pylori体外对Hela细胞的抑增殖毒性作用表明空泡毒素的确是影响Hela细胞的重要毒力因子, 此外其他毒性蛋白亦占有重要地位, 且有剂量依赖关系. Knipp et al[18]发现H. pylori的一种保守性抗原-细胞增殖抑制蛋白(proliferation inhibiting protein, PIP)可引起哺乳动物细胞增殖的抑制, 该抑制作用与细胞种属来源或细胞类型无关, 细菌各株的抑制增殖作用相似, 且是非致死的可逆反应, 具有剂量与时间依赖性, 主要存在于胞质中. 其免疫损伤作用机制可能与抑制宿主细胞免疫应答、诱导免疫无能及影响上皮细胞修复能力、促进损伤发展有关. 因此, 我们认为H. pylori的细胞毒作用可能是多种毒力因子共同作用的结果, PIP的作用有待进一步证实, 而空泡毒素并不是决定性的致细胞损伤因子. 由此我们可以推测无空泡变活性的SS1株依然具有致上皮细胞损伤的毒性作用. 这种损伤作用可能不全是免疫后炎症反应所致, 而与SS1的毒力因子的直接毒性作用有关. 另外, 我们还发现低浓度的H. pylori菌体蛋白有促Hela细胞增殖的作用. 国内外的研究均发现活菌对胃上皮细胞具有低浓度促进, 高浓度抑制增殖的作用, 认为H. pylori可能同时具备与细胞增殖和细胞凋亡相关的两类因子[19]. 当低浓度H. pylori作用于细胞时, H. pylori的促细胞增殖因子占主导地位, 而促细胞凋亡相关因子被细胞代偿机制对抗, 表现为细胞的DNA合成增加, 细胞生长加速; 高浓度H. pylori的促细胞调亡作用占优势, 表现为细胞增殖受抑制. 在H. pylori超声上清中低浓度与高浓度的矛盾作用结果, 是否亦为促增殖与促凋亡因子的优势地位转换所致, 值得进一步探讨.
以菌体蛋白免疫制备的牛特异性IgG由于是针对H. pylori的多克隆抗体, 其抗原包括不同株的共有抗原, 因此对不同菌株均具有中和作用, 在实验研究及应用人群推广方面均有重要意义. 我们前期研究[20]发现以H. pylori超声后全菌蛋白免疫奶牛, 主要的免疫抗原为23-66 KD的蛋白, 较鸡等小型动物的抗原组分范围更宽(60-70 KD)[21-22]. 在被动免疫制剂的制备中, 应用针对不同抗原范围的抗体, 制备全面抑制H. pylori从黏附定植到产毒损伤胃上皮的一系列蛋白组分的广泛抗体, 在H. pylori感染的防治中可能会收到更好的效果, 而牛抗H. pylori抗体明显具有这一优势. 该抗体可明显剂量依赖地阻断H. pylori菌体超声裂解上清的Hela细胞毒性, 与国内卵黄IgY的中和作用研究结果相似, 表明不同种属来源的IgG均可在局部环境中和H. pylori的毒性蛋白, 阻断其致上皮细胞的细胞毒活性. 有研究表明, 虽然IgG在胃蛋白酶的作用下可降解为Fab'2片段, 但Fab'2片段仍具有结合抗原的活性, 可发挥中和作用[23]. 此外, 我们还进行了活菌对Hela的黏附作用及牛特异性IgG抑制此种黏附作用的研究, 发现加活菌于Hela中, 可见贴壁细胞周围有大量H. pylori附着, 而特异牛IgG与活菌同时加入Hela细胞中, 共育24 h可见贴壁的Hela细胞周围无H. pylori黏附, 说明IgG可阻断活菌与上皮细胞的附着(图1, 图4). 目前国内外研究多以鸡的IgY免疫作用为研究重点, 发现IgY在体外能中和毒素、杀死H. pylori, 体内能降低H. pylori感染率, 减轻局部炎症, 提示口服抗体制剂作为H. pylori感染免疫防治的方法是可行的[24-28]. 同时牛作为大型动物免疫接种后可产生长期、稳定、高滴度的特异性抗体, 定期加强免疫可以保证抗体质量, 生命期长, 可多次间歇采集特异性抗体, 为工业制备抗H. pylori特异抗体提供稳定来源, 成本稳定, 收益较高. 因此, 应用口服抗体制剂局部阻断H. pylori的黏附、中和H. pylori毒性蛋白可能成为H. pylori感染免疫防治的有效方法[30].
牛特异性IgG对H. pylori菌体蛋白的中和作用表现为中低浓度为剂量依赖地中和细胞毒, 在较高浓度时甚至有轻微促细胞增殖作用, 至高浓度阈后表现为抑制细胞增殖, 考虑是否高浓度的非特异IgG可能含有抗细胞共有抗原的相应抗体, 后者可能在较高浓度时影响细胞代谢, 表现为抑制细胞增殖. 故进行了单加牛特异性IgG对Hela的剂量-反应关系分析, 发现单纯牛特异性IgG与Hela的增殖无直线相关关系. 对此现象尚待进一步研究.
编辑: 潘伯荣 审读:张海宁
| 1. | Leunk RD, Johnson PT, David BC, Kraft WG, Morgan DR. Cytotoxic activity in broth-culture filtrates of Campylobacter pylori. J Med Microbiol. 1988;26:93-99. [PubMed] [DOI] |
| 2. | Atherton JC, Cao P, Peek RM Jr, Tummuru MK, Blaser MJ, Cover TL. Mosaicism in vacuolating cytotoxin alleles of Helicobacter pylori. Association of specific vacA types with cytotoxin production and peptic ulceration. J Biol Chem. 1995;270:17771-17777. [PubMed] [DOI] |
| 3. | Lee A, O'Rourke J, De Ungria MC, Robertson B, Daskalopoulos G, Dixon MF. A standardized mouse model of Helicobacter pylori infection: introducing the Sydney strain. Gastroenterology. 1997;112:1386-1397. [PubMed] [DOI] |
| 4. | van Doorn NE, Namavar F, Sparrius M, Stoof J, van Rees EP, van Doorn LJ, Vandenbroucke-Grauls CM. Helicobacter pylori-associated gastritis in mice is host and strain specific. Infect Immun. 1999;67:3040-3046. [PubMed] |
| 5. | Sawai N, Kita M, Kodama T, Tanahashi T, Yamaoka Y, Tagawa Y, Iwakura Y, Imanishi J. Role of gamma interferon in Helicobacter pylori-induced gastric inflammatory responses in a mouse model. Infect Immun. 1999;67:279-285. [PubMed] |
| 6. | Shang J, Pena AS. Multidisciplinary approach to understand the pathogenesis of gastric cancer. World J Gastroenterol. 2005;11:4131-4139. [PubMed] [DOI] |
| 7. | Inoue M, Tsugane S. Epidemiology of gastric cancer in Japan. Postgrad Med J. 2005;81:419-424. [PubMed] [DOI] |
| 8. | 胡 伟国, 朱 欢, 陈 桧平, 徐 彰, 黄 开宇, 徐 辉, 黄 爱芬, 程 芹芹, 陶 洪群, 谢 小志. 幽门螺杆菌细胞毒素相关蛋白与 胃窦黏膜炎症程度、细菌定植密度的关系. 实用儿科临床杂志. 2005;20:446-447. |
| 10. | Arnaud L, Chryssostalis A, Terris B, Pavy S, Chaussade S, Kahan A, Allanore Y. Systemic sclerosis and gastric MALT lymphoma. Joint Bone Spine. 2006;73:105-108. [PubMed] |
| 11. | Zhang WD, Xiao SD, Hu FL. Some sujestions about the problem of Helicobacter pylori. Natl Med J China. 2004;6:522-523. |
| 12. | 李 影林. 中华医学检验全书(下卷). 北京: 人民卫生出版社 2000; 2390-2392. |
| 15. | McLoughlin R, Racz I, Buckley M, O'Connor HJ, O'Morain C. Therapy of Helicobacter pylori. Helicobacter. 2004;9 Suppl 1:42-48. [PubMed] [DOI] |
| 16. | Massari P, Manetti R, Burroni D, Nuti S, Norais N, Rappuoli R, Telford JL. Binding of the Helicobacter pylori vacuolating cytotoxin to target cells. Infect Immun. 1998;66:3981-3984. [PubMed] |
| 17. | Odenbreit S, Püls J, Sedlmaier B, Gerland E, Fischer W, Haas R. Translocation of Helicobacter pylori CagA into gastric epithelial cells by type IV secretion. Science. 2000;287:1497-1500. [PubMed] [DOI] |
| 18. | Knipp U, Birkholz S, Kaup W, Opferkuch W. Partial characterization of a cell proliferation-inhibiting protein produced by Helicobacter pylori. Infect Immun. 1996;64:3491-3496. [PubMed] |
| 19. | Wagner S, Beil W, Westermann J, Logan RP, Bock CT, Trautwein C, Bleck JS, Manns MP. Regulation of gastric epithelial cell growth by Helicobacter pylori: offdence for a major role of apoptosis. Gastroenterology. 1997;113:1836-1847. [PubMed] [DOI] |
| 21. | Nilsson I, Ljungh A, Aleljung P, Wadström T. Immunoblot assay for serodiagnosis of Helicobacter pylori infections. J Clin Microbiol. 1997;35:427-432. [PubMed] |
| 26. | 陈 翠萍, 杨 朝晖, 王 永谦. IgY抗体在体外和体内对幽门螺杆菌作用的研究. 中华微生物学和免疫学杂志. 2002;22:37-40. |
| 27. | Nomura S, Suzuki H, Masaoka T, Kurabayashi K, Ishii H, Kitajima M, Nomoto K, Hibi T. Effect of dietary anti-urease immunoglobulin Y on Helicobacter pylori infection in Mongolian gerbils. Helicobacter. 2005;10:43-52. [PubMed] [DOI] |
| 30. | 魏 华, 许 杨, 熊 勇华. 抗幽门螺杆菌牛初乳体外调理杀伤研究. 中华微生物和免疫学杂志. 2002;22:168-169. |