修回日期: 2005-05-22
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 探索一种新的人胰腺干细胞分离纯化体系, 并对经这一体系所获细胞的特性进行研究.
方法: 首先从胎儿胰腺中分离得到胰岛样细胞簇(ICCs), 进而从ICCs中得到单层上皮样细胞, 并传代培养, 第6代细胞通过荧光激活细胞分选(FACS)技术分选出side population(SP)细胞和非SP细胞后进行单克隆细胞培养. 应用逆转录-聚合酶链反应(RT-PCR)和FACS分析, 研究单克隆SP细胞的体外增殖特性和表面标志.
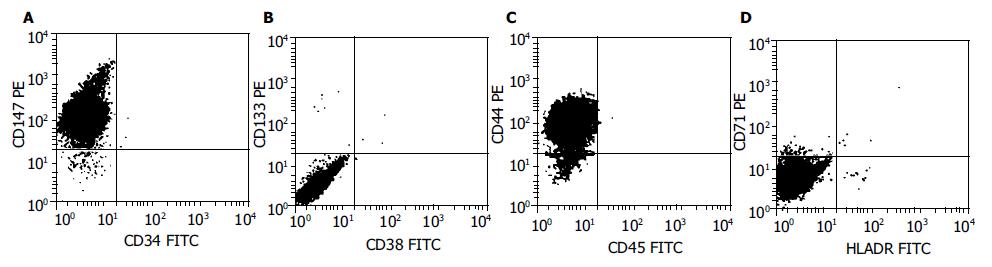
结果: SP细胞占全部细胞的0.22%, SP细胞的克隆形成率为2.7%, 而非SP细胞没有克隆形成. SP克隆能够在体外传15代以上. RT-PCR显示单克隆SP细胞可表达ATP结合盒转运子G2(ABCG2)和转录因子OCT4.FACS分析显示CD44, CD147均为阳性, 而CD34, CD38, CD45, CD71, CD133及HLA-DR均为阴性.
结论: 胎儿胰腺来源的单克隆SP细胞在体外具有高度的增殖潜能, 并具有与骨髓间充质干细胞相同的表型特征.
引文著录: 吴永华, 洪天配, 张玲, 胡江, 李凌松. 胎儿胰腺来源的单克隆SP细胞具有间充质的表型特征. 世界华人消化杂志 2005; 13(15): 1824-1827
Revised: May 22, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
AIM: To find out a new method for isolation and purification of human pancreatic stem cells, and to investigate the characterization of the cells acquired by this method.
METHODS: Islet-like cell clusters (ICCs) were isolated from human fetal pancreas. Monolayer epithelium-like cells were obtained from the ICCs and passaged thereafter. The side population (SP) cells or non-SP cells were sorted from these cells at the sixth generation by fluorescence-activated cell sorting (FACS). The culture of single SP cell or non-SP cell was assayed for clone formation. The markers of SP cells were assayed using reverse transcription polymerase chain reaction (RT-PCR) and FACS.
RESULTS: The SP cells accounted for 0.22% of the total cells. The rate of clone formation was about 2.7% for the SP cells, whereas there was no clone formation for the non-SP cells. The SP cell clones were further expanded for more than 15 generations. RT-PCR analysis showed that the mRNAs of ATP-binding cassette transporter G2 (ABCG2) and transcription factor OCT4 were expressed in the cloned SP cells. FACS analysis revealed that CD44 and CD147 were positive, whereas CD34, CD38, CD45, CD71, CD133 and HLA-DR were negative.
CONCLUSION: The SP cells isolated from human fetal pancreas have highly proliferative potential and share many phenotypic markers with mesenchymal stem cells derived from bone marrow.
- Citation: Wu YH, Hong TP, Zhang L, Hu J, Li LS. Monoclonal SP cells derived from human fetal pancreas have phenotypic markers identical to mesenchymal stem cells. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1824-1827
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1824.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1824
胰腺干细胞的纯化和鉴定是研究热点和难点. 迄今, 尚没有特异性的标记分子可供用于胰腺干细胞的分离、纯化及鉴定. 从成人胰岛培养得到的上皮样细胞中有side population(SP)细胞的存在[1]. 然而, 有关SP细胞在胎儿胰腺中是否存在及其表面标志和体外扩增能力的研究尚未见公布. 我们通过对胎儿胰腺来源的上皮样细胞进行荧光激活细胞分选(FACS), 以确证胎儿胰腺来源的上皮样细胞中有SP细胞的存在, 并对其增殖能力和表面标志物进行分析, 从而建立一种新的人胰腺干细胞的分离纯化体系.
使用进行药物(米索)引产的胎儿胰腺, 胎龄为20 wk. 孕妇自愿终止妊娠, 胎儿组织的使用得到孕妇本人的知情同意. 无菌条件下取出胎儿胰腺, 去除包膜, 剪碎成约1 mm3的小块, 加入适量的V型胶原酶(200 kU/L)(美国Sigma公司), 37 ℃水浴3-5 min. 冷D-Hanks液终止消化. 离心漂洗(300 r/min 5 min), 重复2-3次, 弃上清后, 加入含100 mL/L胎牛血清、1 mmol/L丙酮酸钠、71.5 mmol/L b-巯基乙醇的RPMI 1640培养基. 接种在100 mm细菌培养皿中. 培养96 h后, 将悬浮的胰岛样细胞簇(ICCs)吸出, 接种到新的60 mm细胞培养皿中. 加入含有20 mg/L碱性成纤维细胞生长因子(bFGF)、20 mg/L表皮细胞生长因子(EGF)的RPMI 1640培养基(美国Hyclone公司), 继续培养和传代.
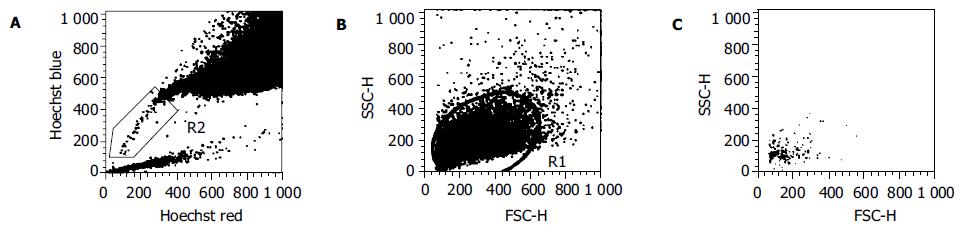
SP细胞分选. 荧光染料Hoechst 33342(终浓度为5 mg/L), 37 ℃孵育120 min; 加预冷碘化丙啶(PI)染色15-30 min, 终浓度为2 mg/L, 目的是区分死细胞. 用含20 mL/L胎牛血清的PBS悬浮细胞, 400目细胞筛过滤, 制备细胞悬液. FACS分选并分析SP细胞和非SP细胞. 另外, 分选SP细胞和非SP细胞各5 000个, 分别提取RNA. 利用流式细胞仪将单个SP和非SP细胞直接分选至96孔板中, 进行单克隆培养. 在培养7-12 d后, 可见克隆形成. 培养单克隆SP细胞达到80-90%汇合后, 用2.5 g/L胰蛋白酶-0.2 g/L EDTA消化, 当在镜下观察到细胞之间的间隙明显增大时, 终止消化. PBS漂洗(1 000 r/min, 5 min), 重复2次. 将细胞重新悬浮, 显微镜下计数. 将细胞(2×108/L, 1 mL/管)放入相同流式管中, 分别加入FITC标记的CD34, CD45, CD147, HLA-DR抗体, PE标记的CD38, CD44, CD71, CD133抗体及其相应的同型对照, 4 ℃避光孵育30 min.PBS漂洗(1 000 r/min, 5 min), 重复2次. 去除PBS后, 每管细胞中加入1 mL流式固定液, FACS流式细胞仪分析. 用Trizol试剂(美国Life Technologies公司)一步法提取细胞RNA. 用M-MLV逆转录试剂盒(Life Technologies公司), 将RNA转录成cDNA. 上述均按照操作说明书完成. PCR反应以人GAPDH基因为内参照. 引物的核苷酸序列和扩增产物大小为:GAPDH, 5'ACC ACA GTC CAT GCC ATC AC 3'和5'ATG TCG TTG TCC CAC CAC CT 3', 452 bp;ABCG2, 5'GGC CTC AGG AAG ACT TAT GT 3'和5'AAG GAG GTG GTG TAG CTG AT 3', 342 bp;OCT4, 5'CGA CCA TCT GCC GCT TTG AG 3'和5'CCC CCT GTC CCC CAT TCC TA 3', 577 bp.PCR反应条件:GAPDH运行30个循环, 94 ℃ 30 s, 50 ℃ 30 s, 72 ℃ 30 s;ABCG2运行34个循环, 94 ℃ 30 s, 56 ℃ 30 s, 72 ℃ 30 s;OCT4运行35循环, 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 30 s.PCR 产物用10 g/L琼脂糖凝胶电泳检测, Bio-RAD凝胶成像系统照相.
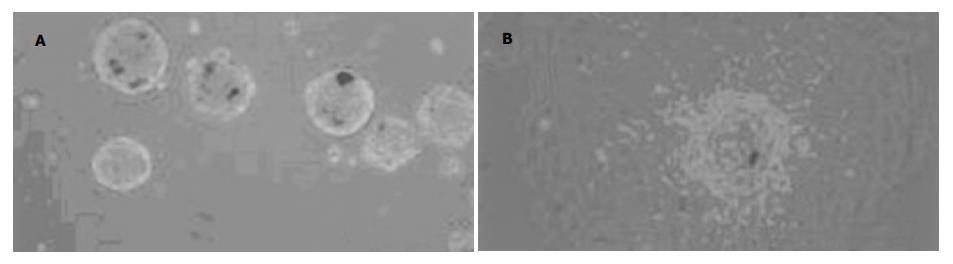
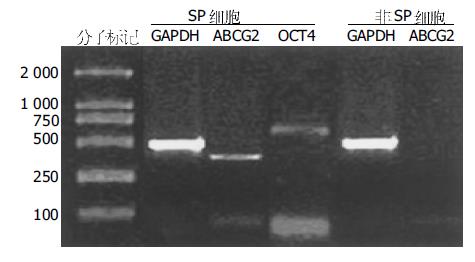
胎儿胰腺组织经胶原酶消化后接种于非贴壁培养皿中, 此时在倒置显微镜下可观察到大量悬浮的胰岛样细胞簇(ICCs). 上述ICCs培养3 d后, 重新接种于25 cm2细胞培养瓶贴壁培养. ICCs贴壁后形成单层细胞, 迁移出的细胞中以上皮样细胞为主(图1A-B). 该上皮样细胞具有很强的增殖能力, 可连续传代培养. 将第6代上皮样细胞用荧光染料Hoechst 33342标记后, 进行FACS分选. 结果显示, 有一群细胞呈现低荧光强度甚至为荧光染色阴性, 约占0.22%左右. SP细胞群属于二维散点图中的小细胞群, 细胞体积小(图2A-C).RT-PCR分析显示, 分选出的SP细胞有ABCG2和转录因子OCT4(干细胞的一种通用标志物)的表达, 而非SP细胞则没有ABCG2表达(图3).
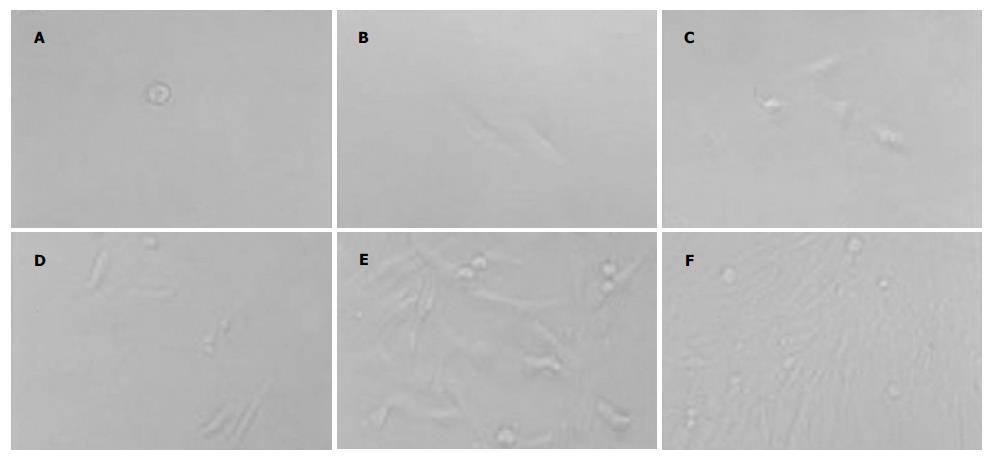
利用流式细胞仪分选至96孔板中的单个SP细胞, 在体外进行单克隆培养. 7-12 d后部分培养孔可见克隆形成, 克隆形成率为2.7%. 细胞具有很强的增殖性, 细胞体积小, 形态均一, 折光性好, 在体外可传代培养15代以上. 在相同条件下, 非SP细胞没有克隆形成(图4). 单克隆SP细胞分别加入荧光标记抗体CD34-FITC, CD45-FITC, CD147-FITC, HLA-DR-FITC, CD38-PE, CD44-PE, CD71-PE, CD133-PE及其相应的同型对照, 进行FACS分析. 结果显示, CD44, CD147为阳性, 而CD34, CD38, CD45, CD71, CD133及HLA-DR则为阴性(图5).
SP细胞最初是在骨髓造血干细胞中发现的, 是一群低荧光标记的细胞, 具有很强的增殖能力和重建造血的功能[2]. 随后的研究发现, 在骨骼肌、神经、心肌和肺等组织中均有SP细胞的存在[3-7], 其在体内具有较强的增殖能力和多向分化潜能, 从而认为SP表型是各种来源的干细胞的普遍标志[8]. 同时发现, 骨髓、骨骼肌的SP细胞可特异性表达ABCG2, 而非SP细胞没有该基因的表达. ABCG2是一种跨膜蛋白, 属于ATP结合盒转运子超家族的成员. 通过ABCG2可以将Hoechst 33342泵出细胞外, 从而使细胞呈现阴性或低荧光强度, 该群细胞即为SP细胞. ABCG2在原始的小鼠造血干细胞中呈高水平表达, 而细胞分化后的表达急剧下调. 基因转染使骨髓细胞中ABCG2持续表达增强直接导致了SP细胞群的出现, 并且在体外培养和体内移植实验中均发现成熟的子代细胞数目明显减少[8]. 因此认为ABCG2是SP表型存在的重要决定分子[8]. 从成人胰岛培养得到的上皮样细胞中有SP细胞的存在[1]. 然而, SP细胞在胎儿胰腺中是否存在及其体外扩增和表型特征的研究尚未见报道. 我们对胎儿胰腺来源的上皮样细胞进行Hoechst 33342标记后, FACS分析发现有一群细胞呈现低荧光强度甚至为阴性荧光染色, 约占细胞总数的0.22%左右, 从而证实胎儿胰腺来源的上皮样细胞中有SP细胞的存在. 另外, 该群细胞体积小, 细胞内颗粒少. 基本符合多种来源的干细胞大多为处于静止期的小细胞这一已被普遍证实的特征[9].RT-PCR检测显示, SP细胞表达ABCG2, 而非SP细胞不表达该基因. 另外, SP细胞还有干细胞通用标志物OCT4的表达, 进一步证明该SP细胞为胰腺前体细胞. 体外培养显示, 利用流式细胞仪分选至96孔板中的单个SP细胞, 在进行单克隆培养7-12 d后, 可见克隆形成, 克隆形成率为2.7%. 单克隆SP细胞在体外可传代培养15代以上. 流式分析显示, 胰腺来源的单克隆SP细胞不表达造血干细胞特有的表面标志物CD34, CD45以及T或B细胞表面标志物CD38, HLA-DR, 但可表达黏附分子CD44, CD147, 提示胎儿胰腺来源的单克隆SP细胞与骨髓间充质干细胞具有相同的表面标志物. 晚近有报道显示, 在体外合适的微环境中, 通过与胰腺b细胞发育有关的多种转录因子的作用, 人骨髓间充质干细胞可以分化为胰岛素表达细胞[10]. 另有报道也证实, 成人胰岛组织中具有间充质表型的上皮样细胞, 经过无血清诱导培养后, 也可以转化为胰岛素分泌细胞, 并重现胰岛细胞典型的上皮样特征[11].
总之, 本研究提示胎儿胰腺来源的单克隆SP细胞在体外具有高度的增殖潜能, 并具有与骨髓间充质干细胞相同的表型特征. 单克隆SP细胞的建立可能为从人胰腺组织中分离和纯化干细胞提供一种新的方案.
编辑: 潘伯荣 审读:张海宁
| 1. | Lechner A, Leech CA, Abraham EJ, Nolan AL, Habener JF. Nestin-positive progenitor cells derived from adult human pancreatic islets of Langerhans contain side population (SP) cells defined by expression of the ABCG2 (BCRP1) ATP-binding cassette transporter. Biochem Biophys Res Commun. 2002;293:670-674. [PubMed] [DOI] |
| 2. | Goodell MA, Brose K, Paradis G, Conner AS, Mulligan RC. Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J Exp Med. 1996;183:1797-1806. [PubMed] [DOI] |
| 3. | Jackson KA, Mi T, Goodell MA. Hematopoietic potential of stem cells isolated from murine skeletal muscle. Proc Natl Acad Sci USA. 1999;96:14482-14486. [PubMed] [DOI] |
| 4. | Gussoni E, Soneoka Y, Strickland CD, Buzney EA, Khan MK, Flint AF, Kunkel LM, Mulligan RC. Dystrophin expression in the mdx mouse restored by stem cell transplantation. Nature. 1999;401:390-394. [PubMed] [DOI] |
| 5. | Hulspas R, Quesenberry PJ. Characterization of neurosphere cell phenotypes by flow cytometry. Cytometry. 2000;40:245-250. [PubMed] [DOI] |
| 6. | Hierlihy AM, Seale P, Lobe CG, Rudnicki MA, Megeney LA. The post-natal heart contains a myocardial stem cell population. FEBS Lett. 2002;530:239-243. [PubMed] [DOI] |
| 7. | Summer R, Kotton DN, Sun X, Ma B, Fitzsimmons K, Fine A. Side population cells and Bcrp1 expression in lung. Am J Physiol Lung Cell Mol Physiol. 2003;285:L97-104. [PubMed] [DOI] |
| 8. | Zhou S, Schuetz JD, Bunting KD, Colapietro AM, Sampath J, Morris JJ, Lagutina I, Grosveld GC, Osawa M, Nakauchi H. The ABC transporter Bcrp1/ABCG2 is expressed in a wide variety of stem cells and is a molecular determinant of the side-population phenotype. Nat Med. 2001;7:1028-1034. [PubMed] [DOI] |
| 9. | Petropavlovskaia M, Rosenberg L. Identification and characterization of small cells in the adult pancreas: potential progenitor cells? Cell Tissue Res. 2002;310:51-58. [PubMed] [DOI] |
| 10. | Moriscot C, de Fraipont F, Richard MJ, Marchand M, Savatier P, Bosco D, Favrot M, Benhamou PY. Human bone marrow mesenchymal stem cells can express insulin and key transcription factors of the endocrine pancreas developmental pathway upon genetic and/or microenvironmental manipulation in vitro. Stem Cells. 2005;23:594-603. [PubMed] [DOI] |