修回日期: 2005-06-06
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 探讨葡萄糖醛酸转移酶UGT1A8基因多态与结直肠癌的相关性.
方法: 结直肠癌病例组与正常对照组各109例, 取静脉血5 mL, 提取DNA, PCR扩增获得UGT1A8第一外显子, 对扩增产物检测、纯化及测序. 每个基因型样本克隆至TOPO TA质粒, 通过DNA序列分析其特性. 经双尾 Fisher 精确检验, 确定各等位基因及基因型在病例组与对照组中的分布差异. 计算OR值及95%CI, 评价研究因素与结直肠癌的相关强度. 采用Logistic回归分析UGT1A8各基因型及性别因素对结直肠癌的易感性.
结果: UGT1A8基因第一外显子区域存在3个突变位点. 野生型UGT1A8*1等位基因频率在对照组高于病例组(P = 0.047), 两组差异有统计学意义, OR值为0.51(95%CI 0.28-0.79), 此等位基因为保护性因素. 突变型等位基因UGT1A8*3频率在正常对照组稀有, 明显低于病例组(P = 0.003), OR值为9.63(95%CI 2.12-7.79), 此等位基因为结直肠癌的危险因子. 纯合基因型UGT1A8*1/*1在正常对照组比例高于病例组(P = 0.045), OR值为0.28(95%CI 0.16-0.88), 此基因型的危险度减少. UGT1A8*1/*3杂合基因型(P = 0.028)、UGT1A8*2/*3杂合基因型(P = 0.003)在病例组高于对照组, OR值分别为5.03(95%CI 2.25-5.99)及12.90(95%CI 2.68-6.15), 这两种基因型为结直肠癌的易感性因素. Logistic回归分析, UGT1A8等位基因多态性是结直肠癌发生的主要影响因素(P = 0.029), 性别因素影响不明显(P = 0.25).
结论: 结直肠癌UGT1A8呈现明显的基因多态性, 野生型UGT1A8*1等位基因为保护性因素, 突变型UGT1A8*3为结直肠癌的危险因子. UGT1A8*1/*3、UGT1A8*2/*3杂合基因型为结直肠癌的易感性因素.
引文著录: 王敏, 孙德峰, 李延青, 陈建, 郭辰虹, 刘福国, 袁孟彪. UGT1A8基因多态与结直肠癌的相关性. 世界华人消化杂志 2005; 13(15): 1819-1823
Revised: June 6, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
AIM: To explore the relationship between the polymorphism of UDP-glucuronosyltransferase UGT1A8 gene and human colorectal cancer (CRC).
METHODS: One hundred and nine cases of colorectal cancer and normal controls (NC), respectively, were collected for analysis. Genomic DNA was prepared from full blood samples. The amplification of UGT1A8 exon-1 sequences was performed using exon-1 specific primer. And the products were visualized by gel electrophoresis and the fragments were purified. The extracted DNA was subcloned into TOPO TA plasmid and the insert was sequenced for the allelic specificity. Two-tailed Fisher抯exact test was used to determine the differences of allelic genotypes between CRC and NC group. Odds ratios (ORs) and confidence interval (CI) were calculated to evaluate the relationship between the gene polymorphism and the grades of CRC. The predisposition factors of CRC were analyzed by Logistics.
RESULTS: Three mutations were identified in UGT1A8 exon-1. The allele frequency of wild UGT1A8*1 was higher in controls when compared with that in CRC (P = 0.047, OR = 0.51, 95%CI: 0.28-0.79), suggesting that this allele was a protective factor. The frequency of mutant UGT1A8*3 was significantly lower in controls than that in CRC (P = 0.003, OR = 9.63, 95%CI: 2.12-7.79), indicating UGT1A8*3 as a risk factor of CRC. The expression of homozygous UGT1A8*1 was markedly higher in controls than that in CRC (P = 0.045). Both heterozygous UGT1A8*1/*3 and UGT1A8*2/*3 were more significantly expressed in CRC as compared with that in controls (P < 0.05, OR = 5.03, 95%CI: 2.25-5.99; P = 0.003, OR = 12.90, 95%CI: 2.68-6.15). Logistic regression analysis demonstrated that the occurrence of CRC was mainly related to the presence of polymorphic UGT1A8 alleles (P = 0.029), but not the sex of the patients (P = 0.25).
CONCLUSION: The high incidence of UGT1A8 polymorphism exists in the patients with colorectal cancer. UGT1A8*1 allele is a protective factor and UGT1A8*3 allele is a risk factor for CRC. Homozygous UGT1A8*1/*3 and UGT1A8*2/*3 are also associated with the high occurrence of CRC.
- Citation: Wang M, Sun DF, Li YQ, Chen J, Guo CH, Liu FG, Yuan MB. Polymorphism of UDP-glucuronosyltransferase UGT1A8 gene in human colorectal cancer. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1819-1823
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1819.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1819
葡萄糖醛酸转移酶(UDP-glucuronosyltransferase, UGT)对内源性代谢物如类固醇、胆红素以及外源性药物、毒物及致癌物等的代谢和排出有重要意义[1]. 在结直肠癌中遗传病因占15-20%, 致突变物介导的基因毒性启动了的肿瘤发生, 这种致癌作用的危险度取决于细胞的遗传生化保护机制. UGT1A8由UGT1基因位点编码, 主要表达于肠道[1-2], 可催化N-羟基化合物与葡萄糖醛酸结合, 阻止和降低杂环胺物质诱发DNA突变的发生[3]. 等位基因的变异在UGT1A8的功能特性中具有重要的意义. 这些发现提示我们, UGT1A8基因表达及功能的改变可能是结直肠肿瘤发生的危险性因素. 我们将UGT1A8作为靶基因, 检测了结直肠癌患者及正常对照人群UGT1A8基因位点的基因型, 探讨其基因多态性与结直肠癌的相关性.
2002-11/2004-09山东大学齐鲁医院普外科及消化内科患者109例, 男68例, 女41例, 平均年龄为(55.4±10.2)岁. 为新发6 mo内入院、病理学确诊的结直肠癌患者; 按照Amsterdam II标准[4], 排除遗传性非息肉病性结直肠癌(HNPCC)及家族性腺瘤息肉病(FAP); 均未经过化放疗或其他针对肿瘤的生物治疗. 对照组109例选自健康查体志愿者, 男66例, 女43例, 平均年龄为(53.2±9.2)岁. 与病例组性别比相近; 年龄相差小于5岁; 与病例组均来自山东同一地域, 均为山东籍汉族人; 与病例组无血缘关系. 对纳入研究的病例与对照组进行问卷调查, 问卷采用面访形式. 调查表内容包括年龄、性别、当前和既往职业史, 个人生活习惯、吸烟与酒精摄入情况、详细饮食摄入情况、肿瘤遗传史等, 建立流行病学档案. 红细胞裂解液, 白细胞裂解液, 蛋白沉淀液, DNA水化液等试剂均由山东大学医学院医学遗传学研究所提供, 5×PCR反应液, 5×dNTP, TaqDNA内切酶等购自美国Promega公司, PCR产物凝胶回收试剂盒购自美国BioTek公司.
空腹抽取上述病例组及对照组的外周静脉血5 mL, ACD防凝备用. 取300 mL防凝血注入到1.5 mL Eppendorf管中, 加入红细胞裂解液900 mL, 混匀, 室温下放置10 min, 12 000 g离心20 s, 弃上清液, 加入红细胞裂解液50 mL将细胞重悬, 其后再加入白细胞裂解液300 mL, 充分混匀, 室温下放置30 min, 加入蛋白沉淀液100 mL, 充分混匀, 12 000 g离心3 min, 将上清液转移至1.5 mL的新Eppendorf管中, 缓慢加入两倍体积的预冷无水乙醇, 轻摇直至DNA析出;9 000 g离心1 min, 弃上清液, 在沉淀中加入750 mL/L乙醇500 mL, 9 000 g离心1 min, 弃上清液, 晾干, 加入DNA水化液100 mL溶解DNA. 用紫外分光光度计进行DNA定量后, 将DNA稀释至20 mg/L备用.
1.2.1 UGT1A8 EXON-1的PCR扩增: 人类UGT1A基因位点在5'端包含个体差异调节的第一外显子, 根据编码UGT1A基因位点(accession number AF297093)的序列而设计引物, forward primer(pr1A8F-bases 34175-34198):5'-tgg ggt cag gtt ttg tgc ctg tag-3', reverse primer(pr1A8R, bases 35175-35208):5'-gaa aat gtc aaa tca caa ttc agt aag gaa tct-3'.反应体系100 mL, 其中5×PCR反应液4 mL、5×dNTP 4 mL、上下游引物各0.5 mL, TaqDNA内切酶5U, 模板DNA 2 mL, 余体积用灭菌三蒸水补齐. 95 ℃预变性3 min, 95 ℃变性30 s、57 ℃退火30 s、72 ℃延伸30 s, 共35个循环, 末次72 ℃延伸10 min. 取PCR扩增产物5 mL, 加入1/6体积的电泳上样缓冲液混匀, 上样于20 g/L琼脂糖凝胶中, 150 V电泳1 h, 将凝胶用EB(溴化乙锭)凝胶染色15 min, 紫外灯下观察扩增结果.
1.2.2 PCR产物的纯化和测序: 将所扩增的PCR产物全部上样于20 g/L琼脂糖凝胶中, 150 V电泳1 h.EB染色15 min后, 在波长320 nm紫外光下将扩增的DNA条带切下, 放入新的1.5 mL Eppendorf管中, 加入4倍体积Binding Buffer, 65 ℃水浴7 min后转移至colum内, 12 000 g离心1 min, 弃去溶液, 用300 mL Binding Buffer冲洗colum, 12 000 g离心1 min, 加入750 mL DNA Wash Buffer, 10 000 g离心1 min, 重复1次, 然后12 000 g离心1 min, 弃去溶液. 12 000 g离心1 min. 更换新的1.5 mL Eppendorf管, 在colum中加入30 mL DNA Water Buffer, 12 000 g离心1 min, 收集溶液定量待测序. 每个基因型的样本克隆至TOPO TA克隆质粒, 每一个DNA样本多重克隆, DNA测序经377型全自动DNA测序仪(美国ABI公司)分析完成, 通过DNA序列分析其特性.
统计学处理 采用SPSS11.0统计软件包, 进行双尾 Fisher精确检验, 确定各等位基因及基因型在病例组与对照组中分布的差异. 计算比值比OR值及95%CI, 用于评价研究因素与结直肠癌的相关强度. 采用Logistic回归分析UGT1A8所有基因型、携带UGT1A8*3的基因型及性别因素对结直肠癌的易感性. P<0.05有统计学意义.
测序结果用DNA star分子生物学软件的SeqMan进行分析, 先将每条测序引物的全部测序结果进行汇总, 剔除测序峰图的假峰和坏区, 并与人类基因组计划测定的UGT1A8标准序列比对, 确定SNP位点及相应等位基因的频率. χ2检验等位基因的群体分布符合Hardy-Weinberg平衡.
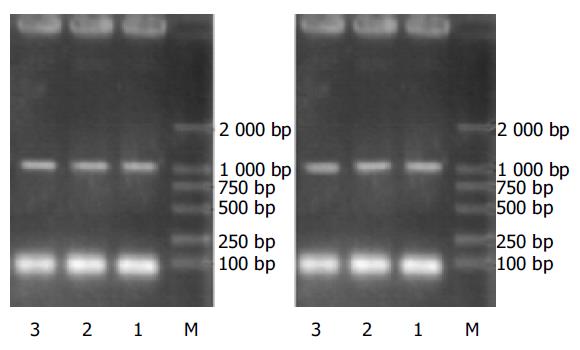
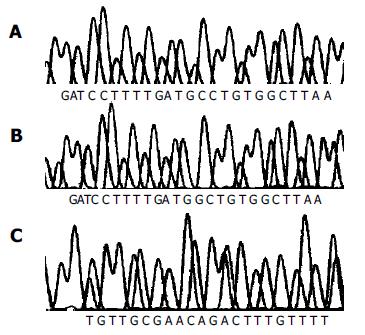
样本DNA经过PCR反应, 扩增片断长度为1 033 bp(图1), 扩增的DNA纯化后测序. 结果可见在第一外显子区域存在3个突变位点(表1, 图2). 碱基对518C>G, 碱基对765A>G, 碱基对830G>A.518位点突变导致173密码子错义突变, 致使丙氨酸被甘氨酸替代. 830G>A突变导致277密码子编码的半胱氨酸转变成酪氨酸. 碱基对765A>G突变为沉寂突变(表2). 样本中大多数均为杂合型突变, 仅有一个单一性突变(表1). 这个结果显示三个突变是非连锁的. 为进一步检测这种可能性, 每个基因型的样本克隆至TOPO TA克隆质粒, 每一个DNA样本多重克隆, 通过DNA序列分析其特性. 所有样本突变模式与等位基因同一性的匹配见表1. 在确定了UGT1A8*2和UGT1A8*3等位基因的情况下, 用TOPO克隆每一个DNA样本来核对检验基因型.
| 核苷酸位置 | |||
| 518 | 765 | 830 | |
| UGT1A8*1 | C | A | G |
| 变异体 | G | G | A |
| A173G | T255(silent) | C277Y | |
| UGT | 氨基酸位点 | |||||
| 172 | 173 | 174 | 276 | 277 | 278 | |
| 1A1 | L | P | C | N | C | L |
| 1A3 | I | P | C | N | C | A |
| 1A4 | I | P | C | N | C | A |
| 1A6 | F | P | C | N | C | K |
| 1A7 | I | F | C | N | C | H |
| 1A8*1 | I | A | C | N | C | H |
| 1A8*2 | I | G | C | N | C | H |
| 1A8*3 | I | A | C | N | Y | H |
| 1A9 | I | L | C | N | C | H |
| 1A10 | I | F | C | N | C | |
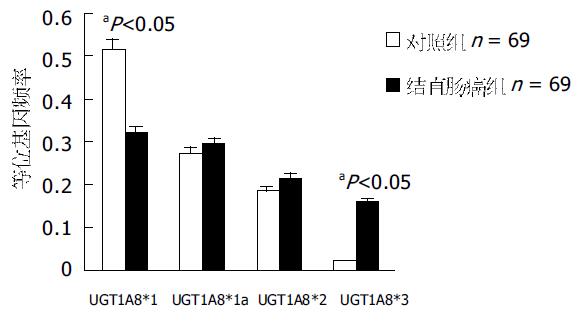
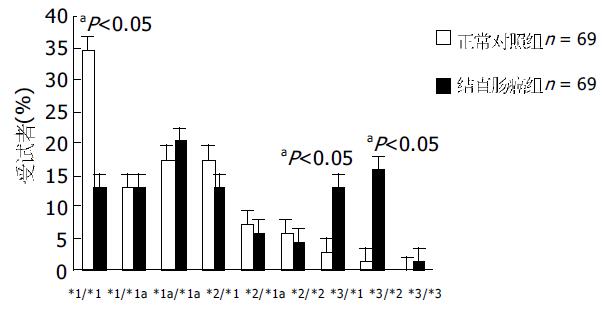
正常对照组中, 等位基因中79%为UGT1A8*1和UGT1A8*1a, 大约18.8%等位基因为UGT1A8*2, 而UGT1A8*3比例最低, 总等位基因群体约2.3%携带这种基因型(表3). 因为UGT1A8*1a是沉寂突变, 他编码UGT1A8*1, 因此1A8*1纯合型基因型(UGT1A8*1/*1, UGT1A8*1/*1a, UGT1A8*1a/*1a)表达约占总人群的65.21%(表4). 杂合基因型UGT1A8*1/*2和UGT1A8*1a/*2的频率大约24.64%, 纯合UGT1A8*2/*2的表达仅占5.8%. UGT1A8*1/*3, UGT1A8*2/*3的杂合基因型频率为约4.35%, 在我们检测的对照组中未发现UGT1A8*3的纯合型表达. 在病例组中, UGT1A8*1和UGT1A8*1a频率为61.5%, UGT1A8*2频率为22.0%, UGT1A8*3等位基因频率为16.5%. 分析此组的基因型, 46.38%的结直肠癌患者呈现UGT1A8*1纯合基因型. 杂合基因型UGT1A8*1/*2和UGT1A8*1a/*2的频率约18.84%, 纯合型UGT1A8*2/*2的表达仅占4.35%. UGT1A8*1/*3, UGT1A8*2/*3的杂合基因型频率为约28.98%, 在我们检测的结直肠癌组中有1例UGT1A8*3的纯合型表达(表3). 野生型UGT1A8*1在正常对照组为51.4%, 而病例组比例为32.1%, 采用双尾Fisher精确检验, P = 0.047, 差异有统计学意义. 计算OR值为0.51(95% CI 0.28-0.79). 突变型等位基因UGT1A8*3在正常对照组为2.3%, 而在病例组16.5%, P = 0.003, 两组差异有统计学意义(图3). 计算OR值为9.63(95% CI 2.12-7.79). 纯合型UGT1A8*1/*1在正常对照组为34.78%, 而病例组为13.04%, 采用双尾Fisher精确检验, P = 0.045, 两组差异有统计学意义. 计算OR值为0.28(95% CI 0.16-0.88).UGT1A8*1/*3杂合基因型在对照组与病例组分别为2.90%和13.04%, P = 0.028, OR值为5.03(95% CI 2.25-5.99);UGT1A8*2/*3杂合基因型在病例组及对照组分别为1.45%和15.94%, P = 0.003, OR值为12.90(95% CI 2.68-6.15)(图4).Logistic回归分析结果说明, UGT1A8等位基因的多态性是肿瘤发生的主要影响因素(P = 0.029), 尤其是UGT1A8*3(P = 0.001), 但性别因素影响不甚明显(P = 0.25).
| 等位基因 | 氨基酸位置 | 对照组 | 结直肠癌组 | P值 | OR值(95% CI) |
| UGT1A8*1 | A173T255C277 | 0.514 | 0.321 | 0.047 | 0.51(0.28-0.79) |
| UGT1A8*1a | A173T255(A>G)C277 | 0.275 | 0.294 | 0.329 | |
| UGT1A8*2 | G173T255C277 | 0.188 | 0.220 | 0.572 | |
| UGT1A8*3 | A173T255Y277 | 0.023 | 0.165 | 0.003 | 9.63(2.12-7.79) |
| UGT1A8 Genotypes | 对照组 | 结直肠癌 | P值 | OR值(95%CI) |
| UGT1A8*1/*1 | 38(34.78) | 14(13.04) | 0.045 | 0.28(0.16-0.88) |
| UGT1A8*1/*1a | 14(13.04) | 14(13.04) | 0.412 | |
| UGT1A8*1a/*1a | 19(17.39) | 22(20.30) | 0.642 | |
| UGT1A8*2/*1 | 19(17.39) | 14(13.04) | 0.477 | |
| UGT1A8*2/*1a | 8(7.25) | 6(5.80) | 0.730 | |
| UGT1A8*2/*2 | 6(5.80) | 5(4.35) | 0.698 | |
| UGT1A8*3/*1 | 3(2.90) | 14(13.04) | 0.028 | 5.03(2.25-5.99) |
| UGT1A8*3/*2 | 2(1.45) | 18(15.94) | 0.003 | 12.90(2.68-6.15) |
| UGT1A8*3/*3 | 0(0) | 2(1.45) | - |
在癌变的启动阶段, 代谢酶基因的多态性在决定环境致癌物的效应中起着关键作用. 肠道内UGT的高度表达, 说明这些酶蛋白在解毒代谢中具有重要的作用[5-7].Guillemette et al[8]发现非洲籍美国女性的UGT1A1低活性等位基因型在乳腺癌组高于正常对照组. UGT2B15的多态导致双氢睾酮葡萄糖醛酸化降低, 致双氢睾酮水平增加, 在前列腺癌的发生中有重要意义[9]. 我国刘茶珍et al[10]发现UGT1F基因第1外显子则呈高度多态, 可能与肝癌有关. 另有国外相关的研究揭示UGT1A7*3作为肿瘤风险因子在肝癌、喉癌中的意义[11-12].UGT1A8基因产物的差异性说明此基因具有高度多态性[13]. 我们检测了山东籍汉族人群中结直肠癌病例组及对照组外周血DNA 中UGT1A8第一外显子区域的基因型, 在218例(对照组及病例组各109例)进行分析, 1 033 bp的第一外显子中包含3个单核苷酸多态性. 其中2个导致在密码子173和277的错义突变, 分别导致了丙氨酸替代为甘氨酸, 以及半胱氨酸替代为酪氨酸. 分析两组人群的等位基因, 发现在结直肠癌组UGT1A8表现明显的基因多态性, 野生型UGT1A8*1在正常对照组高于病例组比例, 差异有统计学意义, OR值0.51, 说明此等位基因为保护性因素, 疾病的危险度减少. 突变型等位基因UGT1A8*3在正常对照组低于病例组, 差异有统计学意义, OR值9.63, 说明此等位基因为易感性因素, 疾病的危险度增加. 进一步分析基因型, UGT1A8*1纯合基因型UGT1A8*1/*1在正常对照组为高于病例组, OR值0.28, 此基因型疾病的危险度减低. UGT1A8*1/*3杂合基因型(OR值5.03)、UGT1A8*2/*3杂合基因型(OR值12.90), 说明这两种基因型为结直肠癌的易感性因素, 使危险度增加. 基因型分析进一步论证了UGT1A8*3等位基因是结直肠癌的危险因子. Logistic回归分析亦说明, UGT1A8等位基因的多态性是肿瘤发生的主要影响因素, 尤其是UGT1A8*3, 但性别因素影响不甚明显.
UGT1A8A173G突变是保守的无极性氨基酸变化, 但是这个位置的A/G的存在在其他UGT 1A蛋白中未发现, 173位置A/G相比于此位置上的重复的保守P, L或F, 说明其对功能是很关键的. 然而Huang et al[14]观察到在173位置A被G取代, 对催化活性影响较少. 而在UGT 1A8*3, 在编码高度保守的C277的密码子单个碱基对的突变导致被酪氨酸替代, 致使此蛋白失活. 定位于第一外显子的C277在蛋白构象中起着重要的作用, 涉及到与另一个半胱氨酸形成二硫化物, 这种二聚体氨基酸的形成对其二级结构或活性具有关键性的作用. 有学者观察到存在于UGT1A8第一外显子区域的错义突变导致了在K133R, A173G, T202A, M212L, T4A, T40A, A154G, F121S[13]部位氨基酸的变化, 从而出现UGT1A8酶蛋白催化能力的明显差异. UGT1A8在结肠中的选择性丰富表达揭示其在组织特异性葡萄糖醛酸结合反应中的重要作用, 其代谢能力的降低可能致结肠的自稳状态失衡. UGT1A8基因占优势的两种形式UGT1A8*1和UGT1A8*2之间催化能力相差不大, 而非功能性UGT1A8*3等位基因遗传的可能性, 尤其是纯合基因型在正常人群中稀有, 由此其作为肿瘤危险因子在结直肠癌的筛选中有重要意义.
结直肠癌是人类主要的恶性肿瘤之一, 我国结直肠癌近年来发病率显著上升[15]. 由于结直肠癌早期缺乏典型症状和体征, 在确诊时已属中晚期, 因此做好结直肠癌的一级预防十分重要. 肿瘤分子流行病学研究对肿瘤防治的影响已初露端倪, 对人体易感基因类型和暴露致癌因素之间关系的研究为结直肠癌高危人群的确定提供了分子生物学手段, 此研究将有助于汇集结直肠癌高危人群, 对其高危因子与代谢基因多态之间以及多态基因之间的交互作用的进一步深入探讨, 为癌症的化学预防及基因治疗开辟新途径.
编辑: 潘伯荣 审读:张海宁
| 1. | Tukey RH, Strassburg CP. Human UDP-glucuronosyltransferases: metabolism, expression, and disease. Annu Rev Pharmacol Toxicol. 2000;40:581-616. [PubMed] [DOI] |
| 2. | Tukey RH, Strassburg CP. Genetic multiplicity of the human UDP-glucuronosyltransferases and regulation in the gastrointestinal tract. Mol Pharmacol. 2001;59:405-414. [PubMed] |
| 3. | Malfatti MA, Felton JS. N-glucuronidation of 2-amino-1-methyl-6-phenylimidazo[4,5-b]pyridine (PhIP) and N_hydroxy-PhIP by specific human UDP-glucuronosyltransferases. Carcinogenesis. 2001;22:1087-1093. [PubMed] [DOI] |
| 4. | Vasen HF, Watson P, Mecklin JP, Lynch HT. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology. 1999;116:1453-1456. [PubMed] [DOI] |
| 5. | Strassburg CP, Kneip S, Topp J, Obermayer-Straub P, Barut A, Tukey RH, Manns MP. Polymorphic gene regulation and interindividual variation of UDP-glucuronosyltransferase activity in human small intestine. J Biol Chem. 2000;275:36164-36171. [PubMed] [DOI] |
| 6. | Vogel A, Ockenga J, Ehmer U, Barut A, Kramer FJ, Tukey RH, Manns MP, Strassburg CP. Polymorphisms of the carcinogen detoxifying UDP-glucuronosyltransferase UGT1A7 in proximal digestive tract cancer. Z Gastroenterol. 2002;40:497-502. [PubMed] [DOI] |
| 7. | Shipkova M, Strassburg CP, Braun F, Streit F, Gröne HJ, Armstrong VW, Tukey RH, Oellerich M, Wieland E. Glucuronide and glucoside conjugation of mycophenolic acid by human liver, kidney and intestinal microsomes. Br J Pharmacol. 2001;132:1027-1034. [PubMed] [DOI] |
| 8. | Guillemette C, Millikan RC, Newman B, Housman DE. Genetic polymorphisms in uridine diphospho-glucuronosyltransferase 1A1 and association with breast cancer among African Americans. Cancer Res. 2000;60:950-956. [PubMed] |
| 9. | MacLeod SL, Nowell S, Plaxco J, Lang NP. An allele-specific polymerase chain reaction method for the determination of the D85Y polymorphism in the human UDP-glucuronosyltransferase 2B15 gene in a case-control study of prostate cancer. Ann Surg Oncol. 2000;7:777-782. [PubMed] [DOI] |
| 10. | Liu C, Bian J, Jiang F, Shen F. [Genetic polymorphism of UDP-glucuronosyltransferase 1F and susceptibility to hepatocellular carcinoma]. Zhonghua Yixue Yichuanxue Zazhi. 2002;19:324-328. [PubMed] |
| 11. | Vogel A, Kneip S, Barut A, Ehmer U, Tukey RH, Manns MP, Strassburg CP. Genetic link of hepatocellular carcinoma with polymorphisms of the UDP-glucuronosyltransferase UGT1A7 gene. Gastroenterology. 2001;121:1136-1144. [PubMed] [DOI] |
| 12. | Zheng Z, Park JY, Guillemette C, Schantz SP, Lazarus P. Tobacco carcinogen-detoxifying enzyme UGT1A7 and its association with orolaryngeal cancer risk. J Natl Cancer Inst. 2001;93:1411-1418. [PubMed] [DOI] |
| 13. | Cheng Z, Radominska-Pandya A, Tephly TR. Cloning and expression of human UDP-glucuronosyltransferase (UGT) 1A8. Arch Biochem Biophys. 1998;356:301-305. [PubMed] [DOI] |
| 14. | Huang YH, Galijatovic A, Nguyen N, Geske D, Beaton D, Green J, Green M, Peters WH, Tukey RH. Identification and functional characterization of UDP-glucuronosyltransferases UGT1A8*1, UGT1A8*2 and UGT1A8*3. Pharmacogenetics. 2002;12:287-297. [PubMed] [DOI] |
| 15. | Zhang YL, Zhang ZS, Wu BP, Zhou DY. Early diagnosis for colorectal cancer in China. World J Gastroenterol. 2002;8:21-25. [PubMed] [DOI] |