修回日期: 2005-05-30
接受日期: 2005-06-13
在线出版日期: 2005-08-15
目的: 检测人胃癌组织中GRP94/gp96, CRT的表达, 分离并鉴定富含分子伴侣的细胞裂解物(CRCL), 为研制和开发肿瘤来源的分子伴侣疫苗奠定基础.
方法: 采用免疫组织化学方法检测人胃癌组织中GRP94/gp96和CRT的表达及其表达程度与胃癌病理因素的关系; 等电聚焦技术从人胃癌组织匀浆中分离CRCL, 经电泳及Western blot进行蛋白分子质量及性质鉴定.
结果: 癌组织中GRP94/gp96和CRT表达的阳性率分别为86.3%和84.3%;而癌旁非癌组织中的阳性率分别为37.3%和43.1%, 癌组织表达程度显著高于癌旁非癌组织(χ2 = 25.946, 18.704, P<0.01); 癌组织中GRP94/gp96的表达程度与肿瘤分化程度、浸润深度及淋巴结转移有关, CRT的表达程度与肿瘤大小及淋巴结转移有关. 分离的CRCL经鉴定为HSP70, HSP90, GRP94/gp96, CRT. 并且这些分子伴侣蛋白沿pH梯度集中分布于5-11号收集管中, 其余管中未见明显表达. pH跨度为4.8-5.6. 不同组织类型中分子伴侣蛋白的分布及pH跨度具有一致性.
结论: 胃癌组织中稳定表达GRP94/gp96和CRT, 其表达程度与胃癌的发生、发展及其生物学行为有关.
引文著录: 曲晶磊, 徐惠绵, 阎影, 唐冰, 贾兰玲. 人胃癌组织中分子伴侣蛋白的表达及检测. 世界华人消化杂志 2005; 13(15): 1809-1813
Revised: May 30, 2005
Accepted: June 13, 2005
Published online: August 15, 2005
AIM: To detect the expression of GRP94/gp96 and calreticulin (CRT) in gastric cancer, and to extract and identify the chaperone-rich cell lysates (CRCL).
METHODS: Immunohistochemistry was used to detect GRP94/gp96 and CRT expression, and the relationship between the levels of expression and the pathological factors were analyzed. Isoelectric focusing technique was used to separate CRCL from the tumor tissue homogenate. The molecular weight and quality of the purified CRCL were identified by SDS-PAGE and Western blot.
RESULTS: The positive rates of GRP94/gp96 and CRT expressive were 86.3% and 84.3% in gastric cancer, respectively, whereas they were 37.3% and 43.1% in cancer-adjacent tissues.The rates were markedly higher in gastric cancer than those in the cancer-adjacent tissues(χ2 = 25.946, 18.704, both P<0.01). The levels of GRP94/gp96 expression in gastric cancer were correlated with the differentiation, infiltration and lymph metastasis of the cancer and the levels of CRT expression were correlated with the size of tumor and lymph metastasis. Western blot showed that the isolated CRCL contained four kinds of chaperone proteins: GRP94/gp96, HSP90, HSP70 and CRT. The pH value ranged from 4.8 to 5.6 (lane 5-11). These chaperone proteins clustering along the pH gradient were very typical and reproducible, and the distributions of the proteins and the pH range were accordant among the tissues of different types.
CONCLUSION: GRP94/gp96 and CRT are stably expressed in gastric cancer and the levels of expression are correlated with the occurrence, carcinogenesis, and biological behavior of gastric cancer.
- Citation: Qu JL, Xu HM, Yan Y, Tang B, Jia LL. Expression of chaperone proteins in human gastric cancer. Shijie Huaren Xiaohua Zazhi 2005; 13(15): 1809-1813
- URL: https://www.wjgnet.com/1009-3079/full/v13/i15/1809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i15.1809
开发新型有效的抗肿瘤疫苗已成为肿瘤免疫治疗的主要目标. 研究表明, 从肿瘤细胞中提取分子伴侣蛋白如HSP70, HSP90, GRP94/gp96和钙网蛋白(calreticulin, CRT)制成的肿瘤疫苗能有效的激活抗原特异性T细胞免疫反应[1-5]. 随着纯化的肿瘤来源的分子伴侣蛋白作为抗肿瘤疫苗的研究进展, 人们将注意力集中于富含分子伴侣的细胞裂解物(chaperone-rich cell lysates, CRCL)在肿瘤免疫治疗中的应用. CRCL是通过液相等电聚焦(free solution-isoelectric focusing, FS-IEF)技术从肿瘤组织匀浆中分离获得的富含大量分子伴侣蛋白的高产疫苗. Graner et al[5-7]发现用从小鼠白血病/淋巴瘤中提取的CRCL对荷瘤小鼠进行治疗, 其治疗效果优于单一成分的分子伴侣疫苗. 由于肿瘤的自身免疫原性, 所以富含分子伴侣的肿瘤疫苗必须从自身肿瘤组织中提取制备. 为了应用自体肿瘤来源的CRCL进行人体疫苗试验, 我们首先采用免疫组织化学方法检测GRP94/gp96和CRT在人胃癌组织中的表达及其表达程度与胃癌病理因素的关系, 并采用等电聚焦技术探讨建立从人胃癌组织中分离纯化CRCL的方法.
2002-12/2003-11中国医科大学附属第一医院行胃癌切除手术病例51例. 男27例, 女24例. 每例取癌组织及距癌肿3 cm以上的癌旁非癌组织作对照. 用于HE及免疫组化染色的组织均经16 g/L多聚甲醛固定, 常规石蜡包埋, 厚4 mm连续切片. 用于CRCL提取分析的新鲜组织于术中切除后立即从原发肿瘤组织中取直径约1.5-2.0 cm组织块, -70 ℃低温冰箱保存备用.
免疫组织化学染色采用SP试剂盒法(迈新公司), 石蜡切片常规脱蜡至水, 0.01 mol/L柠檬酸盐缓冲液(pH 6.0)中高温高压抗原修复2 min, 一抗孵育, 4 ℃过夜;DAB显色, 苏木素复染, 中性树脂封片. 大鼠抗人GRP94/gp96及小鼠抗人CRT(Stressgen公司产品)工作浓度分别为1:30和1:200. 阴性对照以PBS缓冲液代替一抗. 单盲法光学显微镜下进行观察. 判定标准:GRP94/gp96和CRT主要表达在细胞质内, 呈棕黄色颗粒. 每个视野至少观察100个细胞, 以阳性细胞数≥10%作为阳性判断标准, 进而根据阳性细胞百分率分为弱阳性(+): 阳性细胞数为10-30%;阳性(++): 阳性细胞数为30-70%;强阳性(+++): 阳性细胞数≥70%. 另将人胃癌组织称质量, 剪碎, 加入3-5倍体积的匀浆缓冲液(50 mmol/L Tris/Cl, 150 mmol/L NaCl, 0.2 g/L叠氮钠, 100 mg/L PMSF, 1 mg/L Aprotinin, 10 g/L TritonX-100), 匀浆器中匀浆. 充分裂解后, 以10 000 g, 4 ℃离心30 min, 取上清; 以100 000 g, 4 ℃二次离心60 min, 取上清备用. Bradford法测定样品液中蛋白质的浓度, 以牛血清白蛋白作为标准品. 装配液相等电聚焦仪(Rotofor IEF Cell, Bio-Rad公司产品), 阳极舱填充0.1 mol/L H3PO4, 阴极舱填充0.1 mol/L NaOH. 将样品按20 g/L浓度加入两性电解质(pH范围为3-10和4-6, 二者之比1:2), 用5 mol/L尿素稀释至18 mL, 加入等电聚焦仪的聚焦室内. 聚焦在4 ℃冷却循环水浴, 12 W的功率下运行5 h, 用真空泵将样品收集到20个收集管中. 弃去1, 20号管(因其靠近两极, pH值偏离较大), 余18管样品用去离子水稀释至18 mL, 加入聚焦室内, 二次聚焦. 收集样品, pH计测定样品pH值, 进行聚丙烯酰胺凝胶电泳SDS-PAGE(Mini-Protein电泳槽, Bio-Rad公司产品), 考马斯亮蓝S-250染色, 检测蛋白分离效果. 标准分子量为Low Protein Standard(Bio-Rad). 将CRCL的蛋白样品进行SDS-PAGE后, 用电转移法转移至硝酸纤维素膜(Bio-Rad)上. 分别以抗小鼠HSP70单抗、抗小鼠HSP90单抗、抗大鼠GRP94/gp96单抗、抗小鼠CRT单抗(Stressgen公司产品)为一抗, 过氧化物酶标记的抗小鼠或大鼠IgG(1:200, 武汉博士德公司产品)为二抗, 进行Western blot检测(Western blot检测试剂盒, 为武汉博士德公司产品), DAB显色, 观察结果.
统计学处理 应用SPSS11.0软件进行统计学处理, 根据实验资料要求, 选用χ2检验进行数据分析, 以P<0.05为差异具有显著性.
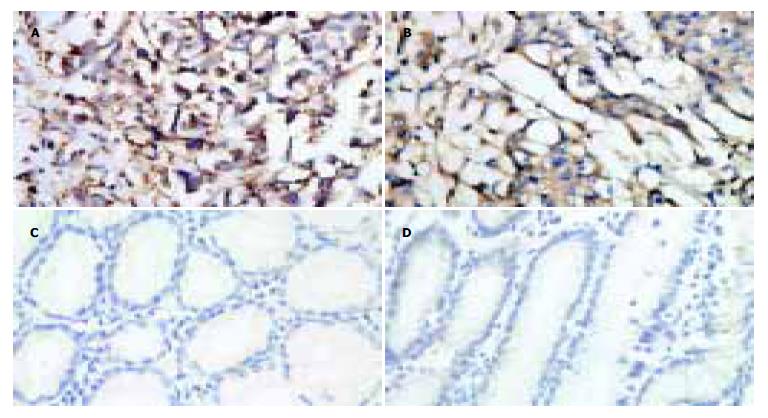
蛋白主要表达于细胞质, 呈棕黄色染色. GRP94/gp96和CRT在胃癌组织中的表达多为阳性甚至强阳性(图1AB), 阳性率分别为86.3%(44/51)和84.3%(43/51); 而在癌旁非癌组织中多为阴性或弱阳性表达(图1CD), 阳性率分别为37.3%(19/51)和43.1%(22/51). 癌组织表达程度显著高于癌旁非癌组织, 差异有统计学意义(χ2 = 25.946, 18.704, P<0.01). 癌组织中GRP94/gp96的表达程度与肿瘤分化程度、浸润深度及淋巴结转移有关, CRT的表达程度与肿瘤大小及淋巴结转移有关(表1).
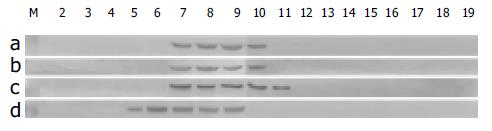
经液相等电聚焦系统分离后, 肿瘤组织中的蛋白质按各自的等电点聚焦于不同的位置, 分别收集于20个收集管中, 弃去1, 20号管. 经SDS-PAGE分离后, 考马斯亮蓝S-250染色, 可以看到同一分子质量的蛋白质仅在相邻的部位表达, 且表现为量的不同(图2). 经特异性的Western blot鉴定, 证实被聚焦的目的蛋白中富含GRP94/gp96, HSP90, HSP70, CRT, 并且这些分子伴侣蛋白沿pH梯度集中分布于5-11号收集管中, 其余管中未见明显表达(图2, 3).pH跨度为4.8-5.6(图2). 不同组织类型中分子伴侣蛋白的分布及pH跨度具有一致性. 1 g胃癌组织经液相等电聚焦分离后可产生1-2 mg的分子伴侣疫苗. 改变FS-IEF两性电解质的比例不能增强分离效果, 只能使总体蛋白沿pH梯度左右移动, 提示分子伴侣蛋白以复合物的形式被分离, 因而不表现为个体蛋白的特性.
从肿瘤细胞中分离纯化出来的CRCL是一种很有潜力的自体肿瘤疫苗, 能够激活肿瘤细胞中分子伴侣-肿瘤抗原肽复合物免疫应答. 已经证实, 分子伴侣家族的HSP70, HSP90, GRP94/gp96和CRT具有免疫活性[1-5]. 用肿瘤来源的CRCL免疫小鼠后, 其能被抗原递呈细胞(antigen presenting cell, APC)摄取和加工, 并将相关的肿瘤抗原肽提呈给细胞毒T淋巴细胞(cytotoxic T lymphocyte, CTL), 从而引发保护性的或治疗性的免疫反应[8]. 我们采用等电聚焦技术从肿瘤组织匀浆中分离获得了CRCL, 经电泳及Western blot鉴定为HSP70, HSP90, GRP94/gp96, CRT; 克服了提纯某一单一成分的分子伴侣蛋白所需周期长、费用高且产量不足的缺点, 便于临床推广应用. 鉴于自体肿瘤来源的分子伴侣蛋白在肿瘤患者的瘤苗试验, 我们应用免疫组化技术对胃癌和癌旁非癌组织中的分子伴侣蛋白GRP94/gp96和CRT的表达进行了分析. 有充分的证据证明肿瘤来源的分子伴侣制剂的免疫原性是由于与分子伴侣结合的内源性抗原肽的不同序列. 由于肿瘤的自身免疫原性, 所以含有CRCL的肿瘤疫苗必需针对每例患者, 从其自身肿瘤组织中提取制备. 因此, 了解分子伴侣蛋白在人类普遍发生的肿瘤中的表达水平很有意义. 由于近年来国内外对HSP70, HSP90在癌组织中的表达报道较多[9-13], 因此本文以胃癌为例, 对GRP94/gp96和CRT的稳定同源的表达进行了报道. 本研究发现胃癌时GRP94/gp96和CRT呈递增之势, 癌组织中GRP94/gp96和CRT表达程度显著高于癌旁非癌组织. GRP94/gp96的表达程度随细胞分化程度降低、浸润深度增加及淋巴结转移而增高, 而CRT的表达则与肿瘤大小及淋巴结转移有关. 对这种结果的一种可能性解释就是肿瘤细胞有高表达的选择性趋势. 实验性研究已经表明肿瘤细胞中HSP70和GRP94/gp96的表达有助于他们的肿瘤原性. 临床上, 已经发现卵巢癌的HSP60的高表达和乳腺癌的HSP70和HSP90的高表达都与肿瘤的进程有关[14-15]. 分子伴侣蛋白能够促进肿瘤原性的一个明显的原因就是他们对应激因子如葡萄糖缺乏、缺氧、酸中毒等应激因素起到一种保护作用, 这些应激因素普遍存在于肿瘤细胞快速生长的恶劣环境中[16]. 我们发现肿瘤结节≤5 cm的癌组织中CRT的表达增强, 可以用CRT能产生抑制血管生成的作用来解释. 近来, 有报道CRT和其蛋白片断(1-180 aa)-vasostatin是肿瘤生长的细胞抑制剂[17-18]. 肿瘤的生长依靠充足的血供, CRT抑制血管生成很可能有助于抑制肿瘤结节的生长. 因此, 应用CRT肿瘤疫苗可通过增强抗肿瘤免疫反应和抗血管生成作用而潜在地引发抗肿瘤效应.
总之, 胃癌组织中GRP94/gp96和CRT的表达程度与其生物学行为有关. 癌细胞中GRP94/gp96和CRT的高表达具有不可缺少的作用, 其作用大概是在肿瘤微环境的恶劣条件下起保护作用. 然而, 由于分子伴侣疫苗利用了宿主APC对分子伴侣-肽复合物的加工和分子伴侣-肿瘤相关抗原肽的提呈, 所以分子伴侣对肿瘤细胞起保护作用与其制剂的免疫原性显然不相矛盾. 由于肿瘤来源的分子伴侣本身不具有抗原性, 而是作为肿瘤多肽抗原的载体, 具有免疫递呈功能, 其结合的多肽为肿瘤细胞表达的特异性抗原, 含有多个活化CTL的抗原表位, 可活化多克隆的CTL, 产生对几乎所有肿瘤细胞的杀伤, 因此分子伴侣蛋白为理想的分子水平的肿瘤疫苗. 进一步研究分子伴侣蛋白的特性, 将有助于发展以分子伴侣蛋白为基础的新的肿瘤疫苗.
编辑: 潘伯荣 审读:张海宁
| 1. | Srivastava PK, Amato RJ. Heat shock proteins: the 'Swiss Army Knife' vaccines against cancers and infectious agents. Vaccine. 2001;19:2590-2597. [PubMed] [DOI] |
| 2. | Nair S, Wearsch PA, Mitchell DA, Wassenberg JJ, Gilboa E, Nicchitta CV. Calreticulin displays in vivo peptide-binding activity and can elicit CTL responses against bound peptides. J Immunol. 1999;162:6426-6432. [PubMed] |
| 3. | Zeng Y, Feng H, Graner MW, Katsanis E. Tumor-derived, chaperone-rich cell lysate activates dendritic cells and elicits potent antitumor immunity. Blood. 2003;101:4485-4491. [PubMed] [DOI] |
| 4. | Feng H, Zeng Y, Graner MW, Likhacheva A, Katsanis E. Exogenous stress proteins enhance the immunogenicity of apoptotic tumor cells and stimulate antitumor immunity. Blood. 2003;101:245-252. [PubMed] [DOI] |
| 5. | Graner M, Raymond A, Romney D, He L, Whitesell L, Katsanis E. Immunoprotective activities of multiple chaperone proteins isolated from murine B-cell leukemia/lymphoma. Clin Cancer Res. 2000;6:909-915. [PubMed] |
| 6. | Graner MW, Zeng Y, Feng H, Katsanis E. Tumor-derived chaperone-rich cell lysates are effective therapeutic vaccines against a variety of cancers. Cancer Immunol Immunother. 2003;52:226-234. [PubMed] |
| 7. | Graner M, Raymond A, Akporiaye E, Katsanis E. Tumor-derived multiple chaperone enrichment by free-solution isoelectric focusing yields potent antitumor vaccines. Cancer Immunol Immunother. 2000;49:476-484. [PubMed] [DOI] |
| 8. | Li Z, Menoret A, Srivastava P. Roles of heat-shock proteins in antigen presentation and cross-presentation. Curr Opin Immunol. 2002;14:45-51. [PubMed] [DOI] |
| 9. | Lebret T, Watson RW, Molinié V, O'Neill A, Gabriel C, Fitzpatrick JM, Botto H. Heat shock proteins HSP27, HSP60, HSP70, and HSP90: expression in bladder carcinoma. Cancer. 2003;98:970-977. [PubMed] [DOI] |
| 10. | 孙 水平, 吴 胜利, 耿 智敏, 牛 新捷, 杨 威. 肝细胞肝癌中HSP90a的表达及意义. 中国普外基础与临床杂志. 2003;10:243-245. |
| 11. | Noguchi T, Takeno S, Shibata T, Uchida Y, Yokoyama S, Müller W. Expression of heat shock protein 70 in grossly resected esophageal squamous cell carcinoma. Ann Thorac Surg. 2002;74:222-226. [PubMed] [DOI] |
| 14. | Ciocca DR, Clark GM, Tandon AK, Fuqua SA, Welch WJ, McGuire WL. Heat shock protein hsp70 in patients with axillary lymph node-negative breast cancer: prognostic implications. J Natl Cancer Inst. 1993;85:570-574. [PubMed] [DOI] |
| 15. | Kimura E, Enns RE, Alcaraz JE, Arboleda J, Slamon DJ, Howell SB. Correlation of the survival of ovarian cancer patients with mRNA expression of the 60-kD heat-shock protein HSP-60. J Clin Oncol. 1993;11:891-898. [PubMed] [DOI] |
| 17. | Pike SE, Yao L, Jones KD, Cherney B, Appella E, Sakaguchi K, Nakhasi H, Teruya-Feldstein J, Wirth P, Gupta G. Vasostatin, a calreticulin fragment, inhibits angiogenesis and suppresses tumor growth. J Exp Med. 1998;188:2349-2356. [PubMed] [DOI] |
| 18. | Cheng WF, Hung CF, Chai CY, Hsu KF, He L, Ling M, Wu TC. Tumor-specific immunity and antiangiogenesis generated by a DNA vaccine encoding calreticulin linked to a tumor antigen. J Clin Invest. 2001;108:669-678. [PubMed] [DOI] |