修回日期: 2005-04-22
接受日期: 2005-05-14
在线出版日期: 2005-07-28
目的: 运用SELDI蛋白质芯片技术检测体外培养的肝癌细胞株(HepG2)与转染乙肝病毒的肝癌细胞株(HepG2.2.15)蛋白质的差异表达, 从而为进一步研究肝癌的发病机制奠定基础.
方法: 常规培养上述两种细胞, 细胞状态良好时收集细胞, 裂解细胞后采用 SELDI-TOF-MS技术用WCX2芯片检测HepG2、HepG2.2.15蛋白质组学的差异.
结果: WCX2芯片共捕获91个蛋白, 其中HepG2、HepG 2.2.15细胞差异蛋白共19个, 9个蛋白在HepG2细胞中表达量增高, 10个蛋白在HepG2细胞中表达量降低. 通过在Swiss蛋白数据库中搜索, 发现Mr 11 081蛋白与钙结合蛋白S100 A10相符, 其他几种蛋白暂时寻找不到.
结论: SELDI蛋白芯片技术检测肝癌细胞株与转染乙肝病毒的肝癌细胞株蛋白质的差异表达方法简便, 敏感性高, 重复性好, 本文发现的这些组织特异性蛋白生物标记对我们从血清或组织标本中筛选和鉴定不同型别肝癌细胞之间的标志蛋白有重要意义.
引文著录: 丁守怡, 钱冬萌, 闫志勇, 宋旭霞, 牟文凤, 王斌. 蛋白质芯片飞行质谱技术检测体外培养的肝癌细胞株与转染HBV的肝癌细胞株蛋白质的差异表达. 世界华人消化杂志 2005; 13(14): 1684-1687
Revised: April 22, 2005
Accepted: May 14, 2005
Published online: July 28, 2005
AIM: To detect the different protein expression between Hepatitis B Virus (HBV)-transfected hepatoma cell line (HepG2.2.15) and its parental cell line (HepG2) in vitro using the surfase-enhenced laser desorption/ionization (SELDI) protein chip.
METHODS: HepG2 and HepG2.2.15 cell lines were cultured by routine method and then collected. All the cells were lysed when they were in good conditions, and the protein expression in the lysate was detected by WCX2 chip using surfase-enhenced laser desorption/ionization-time-of-flight mass spectrometry (SELDI-TOF-MS).
RESULTS: Ninety-one proteins were captured by WCX2 chip, of which nineteen were differently expressed between HepG2.2.15 and HepG2 cells. Among the nineteen proteins, nine were up-regulated and ten were down-regulated in HepG2 cells. After search in SWISS-PROT, the protein with Mr11081 was found accordant to calcium-binding protein S100A10, and the other ones were not confirmed yet.
CONCLUSION: SELDI protein chip platform is simple, sensitive and repeatable in the detection of differently expressed proteins, whose specific biological markers play important roles in screening and identifying the marker proteins of the cells from different types of liver cancer, between hepatoma cell line and HBV-transfected hepatoma cell line.
- Citation: Ding SY, Qian DM, Yan ZY, Song XX, Mou WF, Wang B. Identification of protein differentlyexpressed between hepatoma cell line and Hepatitis B Virus-transfected hepatoma cell line. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1684-1687
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1684.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1684
肝癌是我国最常见的恶性肿瘤之一, 其死亡率居第二. 且确诊时已属晚期, 缺乏有效的治疗, 因此, 需要探索一种快速、简单、灵敏度高、特异性好的早期诊断技术. 任何疾病在出现病理变化之前, 细胞内的蛋白质在成分和数量上都会有相应的改变, 癌症的发生是一个多基因多阶段多因子的动力学过程. HCC也不例外, 其中HBV的感染在HCC发生过程中具有重要意义. 目前对肝癌发生机制的研究大都是在基因水平, 但是mRNA的水平并不能真正代表所表达的蛋白质水平, 因此, 要求对生物功能的执行者-蛋白质进行研究. 蛋白质组是指一个基因组、一个细胞或组织或一种生物体所表达的全部蛋白质[1]. 蛋白质组学(proteomics)技术为研究肿瘤标志物与肿瘤进展转移研究提供良好的技术平台, SELDI蛋白质芯片技术是近年来新兴的一种蛋白质组学技术, 他具有简单, 快捷, 灵敏等特点, 可以检测Mr500-500 000之间的蛋白或多肽, 而且所需样本体积小(0.5-400 mL)[2-3]. 我们应用细胞裂解液裂解体外培养的两种细胞(HepG2、HepG 2.2.15), 进行了SELDI-TOF-MS分析, 建立了肝癌细胞与转染HBV的肝癌细胞的蛋白表达图谱, 发现了一系列(信噪比)差异表达的蛋白, 信号强度与蛋白浓度相一致, 因此能对样本中的单一成分进行定量.
肝癌细胞株(HepG2)、转染HBV的肝癌细胞株(HepG 2.2.15)由第四军医大学吴力克主任医师赠送. HPLC水, 乙晴, 三氟乙酸, SPA(sinapinic acid), tritonX-100, 尿素, HEPES, CHAPS购自美国Sigma公司, 蛋白质芯片时间质谱分析仪(PBSⅡC)及WCX2(弱阳离子交换芯片)购自美国Ciphergen Biosystems公司. 蛋白质芯片WCX2(弱阳离子交换芯片)芯片表面结合有弱型阴离子羧基, 可以被分析物表面的正电荷基团相互作用(如赖氨酸、精氨酸和组氨酸)而捕获蛋白.
细胞总蛋白质的提取. HepG2、HepG 2.2.15细胞采用含100 mL/L胎牛血清的RPMI 1640培养基培养, 细胞长成单层后, 用无菌细胞刮刀刮取细胞, PBS洗3次, 细胞计数1010/L, 加入裂解液(8 mol/L Urea, 4O g/LCHAPS, 40 mmol/L Tris-HCl pH7.4)200 mL, 4 ℃剧烈震荡30 min, 14 000 g离心30 min. 采用日立的Gene Spec V蛋白核酸分析系统测定上清的蛋白浓度, 用裂解液调至样品浓度为2 g/L, 分装-86 ℃备用. 将WCX2蛋白芯片装入蛋白工作平台, 每孔加入200 mL结合/洗脱缓冲液(50 mmol/L NaAc, pH4.0)预处理芯片, 室温下200 r/min振荡5 min, 弃缓冲液, 重复上述操作1次. 每孔加入1:2稀释的样品50 mL剧烈震荡, 室温孵育1 h. 弃掉样品, 每孔用200 mL结合/洗涤缓冲液洗涤2次, 每次震荡5 min. 弃去孔中液体, 每孔加入200 mL HPLC水, 立刻甩出. 从蛋白工作平台中取出芯片, 空气中干燥, 每孔加入EAM(SPA中加入乙晴75 mL和10 mL/L三氟乙酸75 mL)0.5 mL, 重复1次. 干燥后用蛋白质芯片阅读机进行质谱分析. IMAC3蛋白芯片每孔加入50 mmol/L硫酸镍5 mL并在湿盒中孵育15 min, 重复操作1次. 用流动的去离子水清洗芯片10s以除去过多的镍. 每孔加入结合缓冲液(0.5 mol/L NaCl, 1 g/L TrionX-100, PBS pH7.0)5 mL, 震荡孵育5 min, 将蛋白芯片放入蛋白工作平台(Bioprocessor), 每孔加入缓冲液200 mL, 震荡孵育5 min. 弃去缓冲液, 每孔立即加入50 mL 1:2稀释于缓冲液中的样品(蛋白终浓度1 g/L), 震荡孵育1 h. 弃去样品, 每孔使用缓冲液200 mL洗涤2次, 每次5 min, 然后用水进行清洗. 从蛋白工作平台中取出蛋白芯片, 空气中干燥, 每孔加入EAM 0.5 mL, 重复1次. 干燥后用蛋白质芯片阅读机进行质谱分析. 用加有All-in-one标准蛋白的NP-20芯片校正质谱仪, 仪器参数设置如下: 激光强度220, 检测敏感度10, 优化Mr范围为2 000-10 000, 最高Mr为50 000.
统计学处理 采用Ciphergen proteinchip 3.0版本的分析软件自动采集数据, 然后用Biomarker Wizard软件分析HepG2、HepG 2.2.15细胞的蛋白质谱差异.
两种芯片Mr在3 000-25 000范围内, WCX芯片捕获蛋白峰较多, 共捕获91个蛋白峰, IMAC3-Ni芯片共检测出61个蛋白峰, 且WCX2芯片中蛋白峰的强度较好. 因此后续才研究选择WCX2芯片进行. 为了保证试验结果的可靠性, 我们首先进行细胞计数为1010/L样品蛋白浓度为2 g/L以减少细胞本身蛋白的差异; 同时每种细胞收获3次, 以排除组间差别; 每份样品至少在同种芯片3个以上不同点进行检测, 以排除不同芯片点之间的差异. 然后用SELDI-TOF-MS对样品孔进行测定, 经质谱分析后选择了8个蛋白蜂, 测变异系数, 结果显示其M/Z及强度的CV分别为1%和5%, 分析结果表明试验重复性好结果可靠.
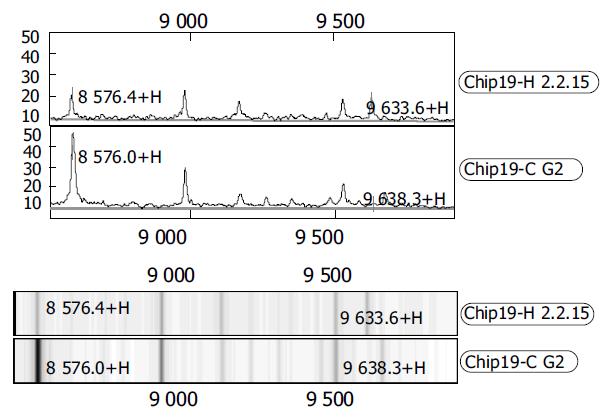
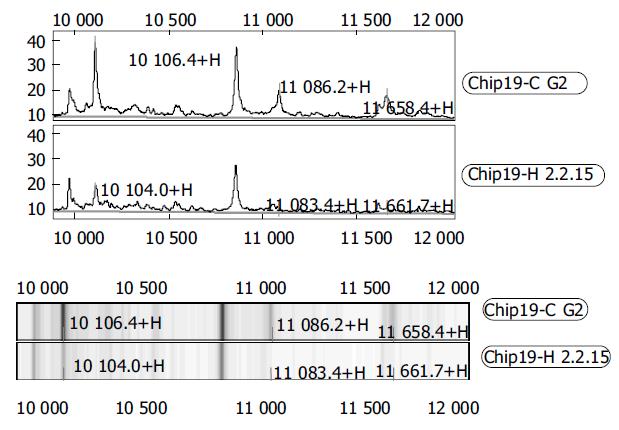
WCX2芯片共捕获91个蛋白峰, 其中HepG2、HepG 2.2.15细胞差异蛋白峰共19个, 9个蛋白峰在肝癌细胞中表达量增高, 10个蛋白峰在肝癌细胞中表达量降低(表1). 肝癌细胞及转染HBV的肝癌细胞在Mr8 500-10 000和10 000-12 000捕获的蛋白峰见图1-2.
| 标志蛋白 | 表达 | 标志蛋白 | 表达 |
| 4061 | ↓ | 5552 | ↑ |
| 5061 | ↓ | 5835 | ↑ |
| 5989 | ↓ | 7517 | ↑ |
| 6077 | ↓ | 8576 | ↑ |
| 6555 | ↓ | 9350 | ↑ |
| 6866 | ↓ | 10106 | ↑ |
| 7285 | ↓ | 10311 | ↑ |
| 7721 | ↓ | 11086 | ↑ |
| 8076 | ↓ | 11660 | ↑ |
| 9633 | ↓ |
将发现的差异蛋白峰在Swiss蛋白数据库中搜索(http://us.expasy.org/tools/tagident.html), 发现Mr 11081蛋白峰与钙结合蛋白S100 A10相符. 其他几种蛋白暂时寻找不到.
肿瘤早期就可在蛋白质水平出现细微但重要的组合改变[4], 近来研究表明, 肿瘤性疾病从蛋白质组学的角度又可以被认为是一种蛋白质缺陷病, 其发生过程中有多种蛋白会发生异常变化. 蛋白表达异常不仅包括蛋白表达量的增加或减少, 还包括蛋白翻译后加工上的改变, 从而导致肿瘤组织表达的蛋白质谱(protein profile)的改变. 因此利用蛋白质组学方法检测蛋白质谱的变化可以更加准确地诊断肿瘤及了解肿瘤的发病机制. HBV感染在肝癌发生过程中具有重要的意义, 这就需要探索一种新的技术以发现早期肿瘤标志物. SELDI蛋白质芯片技术可检测疾病进展中不同阶段血清中多肽量的变化, 翻译后修饰的改变或某些多肽的聚糖结构变化, 为HCC肿瘤标志物的进展提供了一个新的方法, 他灵敏度高、特异性好、重复性强、操作简单[5], 可同时检测血清中的多种蛋白质已被应用于检测多种生物学样品. 我们比较WCX2与IMAC3-Ni两种芯片对同一份细胞分析后发现, WCX2芯片捕获蛋白峰较多, Mr3 000-30 000范围内, 共捕获91个蛋白峰, IMAC3-Ni芯片共检测出61个蛋白峰, 且WCX2芯片中蛋白峰的强度较好. 因此本研究选择WCX2芯片进行样品分析. WCX2芯片捕获的蛋白PI一般大于4.
体外培养的细胞株虽然不能完全反映体内细胞的生长状态和生物学活性, 但他具有成分单一, 均质性好, 实验条件容易控制等优点. 尤其在做对比性研究时可避免由组织细胞成分复杂, 细胞异质性高等缺点造成的结果不真实和不可靠[6]. 我们培养了HepG2和HepG2.2.15细胞, 裂解细胞蛋白定量后SELDI-TOF-MS分析蛋白表达的差异. 共发现了19个差异的蛋白峰. 这些组织特异性蛋白生物标记对我们从血清或组织标本中筛选或鉴定标志蛋白有重要意义对肝癌的早期诊断有潜在的应用价值, 更主要的是为研究肝细胞癌变机制提供了一个基础, 而且这些蛋白有可能为肝癌治疗提供新的靶位, 可以进行RNA干扰来阻断其高表达或通过基因导入来促进低表达蛋白的表达. 用Swiss蛋白数据库发现Mr11 081蛋白峰可能为钙结合蛋白S100 A10.S100家族与肿瘤的发生发展关系密切, 他们参与细胞周期调控, 在多种肿瘤中表达异常, 并与肿瘤的浸润、转移有关. S100 A10在肿瘤发生中的作用还不确定, 他可能与Annexin II(p36)组成复合物, 抑制p36磷酸化, 参与细胞周期调控[7]. 在肝癌的发生中S100 A10可能通过p36起作用, 可能引起细胞细胞生长失控而致癌. 从理论上讲, 肝癌在发生、发展过程中其细胞内的蛋白质变化可以反应到血清中, 可从体外培养的肝癌细胞株中筛选出部分与癌患者血清相一致的标志蛋白, 有些改变可能只存在于细胞内而不分泌或代谢到细胞外, 这部分蛋白可能是与癌症的发病密切相关的功能蛋白和调节蛋白. 为临床肝癌的诊断提供新的思路, 以期使肝癌的血清学诊断成为可能.
编辑: 潘伯荣 审读:张海宁
| 1. | Peng J, Gygi SP. Proteomics: The move to mixtures. J Mass Spectrom. 2001;36:10831091. [PubMed] [DOI] |
| 2. | Robinson JC, Kerjan P, Mirande M. Macromolecular assemblage of aminoacyl-tRNA synthetases: quatitative analysis of protein-protein interactions and mechanism of complex assembly. J Mol Biol. 2000;304:983-994. [PubMed] [DOI] |
| 3. | Stoop AA, Jespers L, Lasters I, Eldering E, Pannekcek H. High-density mutagenesis by combined DNA shuffling and phage display to assign essential amino acid residues in protein-protein interactions: application to study structure-function of plasminogen activation inhibitor 1 (PAI-1). J Mol Biol. 2000;301:1135-1147. [PubMed] [DOI] |
| 4. | Liotta LA, Kohn EC, Petricoin EF. Clinical proteomics: personalized molecular medicine. JAMA. 2001;286:2211-2214. [PubMed] [DOI] |
| 5. | Persidsky Y, Gendelman HE. Mononuclear phagocyte immunity and the neuropathogenesis of HIV-1 infection. J Leukoc Biol. 2003;74:691-701. [PubMed] [DOI] |