修回日期: 2005-04-04
接受日期: 2005-04-09
在线出版日期: 2005-07-28
目的: 检测SSX-1及NY-ESO-1mRNA在肝细胞性肝癌(HCC)患者的外周血及肝癌组织中的表达情况及其临床意义.
方法: 用逆转录-聚合酶链反应(RT-PCR)方法对26例HCC患者的外周血、癌组织、相应的癌旁组织及20例对照研究标本进行SSX-1和NY-ESO-1mRNA检测. 为验证结果的可靠性, 对SSX-1和NY-ESO-1的RT-PCR产物进行了DNA测序.
结果: SSX-1及NY-ESO-1 mRNA在26例HCC组织中的表达率分别为61.5%和11.5%, 在相应的外周血中的表达率分别为46.2%和3.8%. 外周血中表达SSX-1或NY-ESO-1 mRNA的HCC患者, 其组织标本中也表达上述基因. 所有的癌旁组织, 作为对照的肝硬化和正常肝组织以及非肿瘤患者的外周血中均未发现这两种基因的表达. 测序结果表明所得到的cDNA确为要扩增的目的基因. SSX-1和NY-ESO-1基因的表达与患者的年龄、性别、肿瘤大小、分化程度、血清AFP水平、肝炎病毒感染等临床指标无显著相关性(P>0.05).37.5%的AFP正常(<20 ng/L)的 HCC患者外周血中有SSX-1基因表达. 外周血中表达SSX-1mRNA的患者的短期(6 mo)复发率为50%(4/8), 不表达者的复发率为25%(3/12).
结论: 在HCC患者及癌组织中SSX-1和NY-ESO-1基因高特异性表达, 在检查AFP的同时检测外周血SSX-1 mRNA的表达, 有助于提高HCC的检出率. 表达SSX-1 mRNA的HCC患者的短期复发率明显增高, 可作为监测HCC复发、转移和预后的指标.
引文著录: 吴力群, 王新建, 卢云, 张斌, 杨金镛. 肝细胞肝癌患者肿瘤/睾丸抗原SSX-1及NY-ESO-1mRNA的表达意义. 世界华人消化杂志 2005; 13(14): 1673-1678
Revised: April 4, 2005
Accepted: April 9, 2005
Published online: July 28, 2005
AIM: To investigate the expression of SSX-1 and NY-ESO-1 mRNA in hepatocellular carcinoma (HCC) and their clinical significances.
METHODS: The expression of SSX-1 and NY-ESO-1 mRNA were detected in the cancer tissues, the corresponding cancer-adjacent tissues and the peripheral blood of 26 patients with HCC as well as of 20 controls by reverse transcription polymerase chain reaction (RT-PCR). A randomized sample of the RT-PCR products was selected for DNA sequencingto examine the reliability of results.
RESULTS: The positive rates of SSX-1 and NY-ESO-1 mRNA expression were 61.5%(16/26) and 11.5% (3/26), respectively, in cancer tissues, and they were 46.2%(12/26) and 3.8%(1/26) in the peripheral blood. HCC patients, whose peripheral blood expressed SSX-1 or NY-ESO-1 mRNA, also expressed the same gene in their cancer tissues. SSX-1 and NY-ESO-1 mRNA were not expressed in cancer-adjacent tussues, and tissues and peripheral blood of the controls. DNA sequencing confirmed that the RT-PCR products were the target cDNA. No significant relationship was found between the expression of SSX-1 and NY-ESO-1 and the clinical indicators such as age, gender, tumor size, extent of differentiation, serum a-fetoprotein (AFP) level and infection of hepatitis B virus (P>0.05). However, in 37.5% patients with normal serum AFP (<20 ng/L), specific expression of SSX-1 mRNA was observed. The short-term recurrent rate was 50%(4/8) in patients whose peripheral blood expressed SSX-1 mRNA, while the rate in patients with no SSX-1 mRNA expression was 25%(3/12).
CONCLUSION: SSX-1 and NY-ESO-1 are expressed with a high specificity in HCC, and they can be used as the targets for specific immunotherapy of HCC. The combination of SSX-1 mRNA and AFP detection can help to improve the accuracy of diagnosis for HCC. The expression of SSX-1mRNA may be used as an indicator for reccurrence, metastesis and prognosis of HCC.
- Citation: Wu LQ, Wang XJ, Lu Y, Zhang B, Yang JY. Expression of cancer-testis antigens SSX-1 and NY-ESO-1 mRNA in hepatocellular carcinoma and its clinical significance. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1673-1678
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1673.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1673
原发性肝细胞性肝癌(HCC)常见, 恶性程度高, 预后差. 我国每年约23万人死于肝癌, 占全世界肝癌死亡数的53%[1]. 即使小肝癌术后5年的复发率也超过50%, 大肝癌的复发率则更高[2], 复发与转移成为制约肝癌预后的瓶颈. 据估计直径小于1 cm的HCC约有20%发生血管侵犯, 大于5 cm的约有90%发生血管侵犯, 对血管的浸润直接造成了肝癌细胞的血源性播散[3]. 当前, 手术切除仍是治疗肝癌复发灶的最有效的方法[4].RT-PCR技术检测循环血液中的肿瘤播散细胞(DTC)的灵敏度可达1/(106-108)[5]. 以ALBmRNA及AFPmRNA作为检测指标, 缺乏特异性[6-7]. 近年来肿瘤-睾丸抗原(cancer-testis antigens, CTA), 包括MAGE[8], SSX[9], GAGE[10], BAGE, SCP-1和NY-ESO-1等家族, 有望成为检测肿瘤细胞的特异性指标. MAGE-1和MAGE-3在HCC组织中呈高表达[11-12], 其抗原肽在体外能诱导产生CTL反应[13-14], 可用于肿瘤复发的监测[15]. 我们以SSX-1和NY-ES0-1mRNA为标记检测HCC外周血中肿瘤细胞, 对于HCC辅助诊断, 复发与预后的预测可能具有重要的意义, 目前国内外尚无此类研究报道.
术前自深静脉通道或外周静脉采血30-40 mL立即加入肝素100 U抗凝, 在1 h内采用梯度离心法分离淋巴细胞, 在显微镜下计数并计算所得淋巴细胞的总量, 根据细胞数加入适量冻存液, 使其密度为1×1010/L, 按每管1 mL装入冻存管内, 先在4 ℃冰箱内过渡30 min, 然后放入-70 ℃冰箱过夜, 次日将其转入液氮中长期保存备用. 肝癌标本离体后立即将其剖开, 更换刀片后, 先切取距肿瘤边缘2-5 cm的癌旁组织, 然后沿肿瘤边缘切取生长活跃的瘤组织, 将所取组织切成3-5 mm的小碎块装入冻存管内, 并立即放入液氮中, 随后将其转入-70 ℃冰箱内保存. 采用同样的方法, 切取和保存作为对照的肝硬化及正常肝组织. 对照标本均取自非肿瘤患者, 另取正常人的睾丸组织作为阳性对照.
1.2.1 RNA的提取和测定: 将提取RNA用的研钵刷洗干净, 经强酸浸泡过夜, 用自来水洗净残余酸, 用双蒸水清洗3遍, 200 ℃干烤6 h备用. 从液氮中取出细胞标本, 在37 ℃水浴箱内快速解冻. 以4 ℃, 2 000 r/min离心10 min, 弃去冻存液, 每107个细胞中加入Trizol(美国Gibco公司)1 mL, 反复吹打使细胞充分裂解. 从-70 ℃冰箱中取出组织标本约50-100 mg, 置入研钵内, 在有液氮存在的情况下研成碎末, 待液氮干燥后, 立即加Trizol 1 mL不断研磨直到完全成为液体后移入1.5 mL离心管中. 在上述裂解液中加入氯仿200 mL, 用力摇晃15 s, 室温放置2-3 min.12 500 g, 4 ℃离心15 min, 小心吸取上清液将其移入另一1.5 mL的离心管中, 加入异丙醇0.5 mL, 于室温放置10 min进行RNA沉淀. 12 500 g, 4 ℃离心10 min, 小心弃去上清液, 加入DEPC处理水配制的750 mL/L乙醇1 mL, 将白色RNA沉淀整块吹起进行漂洗. 7 500 g, 4 ℃离心5 min后, 弃去上清液, 再加入750 mL/L乙醇1 mL重复洗涤1次, 7 500 g, 4 ℃离心5 min后, 小心弃去上清液, 吸尽管壁残留的液体. 冰上放置5-10 min, 待残留的乙醇干燥后, 溶于30-80 mL DEPC处理过的纯净水中. 取RNA样品4 mL, 加无RNA酶的水196 mL稀释50倍, 用紫外分光光度计对RNA在260 nm下的吸光度进行定量. RNA浓度(g/L) = A260×核酸稀释倍数×40/1 000. 用紫外分光光度计对RNA在260 nm和280 nm下的吸光度A260和A280进行定量, 计算A260/A280, 所有标本的比值要求在1.75-1.95之间. 低于此值者表明其含有蛋白质杂质, 用氯仿重新提纯. 秤琼脂糖1 g, 加入0.5×TBE到总体积为50 mL, 配成2%的凝胶, 经微波炉加热100 s, 冷却到微烫手时加入2.5 mL EB(0.5 g/L)充分混匀后灌胶. 取RNA溶液3 mL, 加2 mL 0.5×TBE, 1 mL 6×Loading Buffer, 混匀后上样. 在0.5×TBE的电泳液中, 以5 V/cm的电压电泳20 min, 在紫外灯下观察RNA的电泳带, 比较核糖体RNA(rRNA)28 s和18 s两条带, 如果在EB作用下显色强度为2:1, 说明本实验提取的RNA比较完整.
1.2.2 逆转录聚合酶链式反应(RT-PCR): 所用的目的引物和内参照b2微球蛋白(b2-MG)引物均委托上海生工公司合成(表1). 所用引物序列参照了以前研究者的设计[16]). 将引物按照Qiagen QneStep RT-PCR试剂盒的要求溶解为15 mmol/L, 保存在4 ℃冰箱内备用. 目的基因及b2微球蛋白的RT-PCR扩增: 反应体积为50 mL, 依次向薄壁PCR管中加入5×Buffer 10 mL, 10 mmol/L dNTP 2 mL, 15 mol/L SSX-1/NY-ESO-1上游引物2 mL, 15 mol/L SSX-1/NY-ESO-1下游引物2 mL, 15 mol/L b2微球蛋白的上游引物2 mL, 15 mol/L b2微球蛋白的下游引物2 mL, 混合酶2 mL, RNA溶液可变(每个反应体系所需的RNA模板量为0.5 pg-1 mg, RNA溶液的加样量根据所测浓度而定), Q-selution 10 mL, 无RNA酶水至50 mL. 整个加样过程中各种试剂及PCR管均应放在冰上, 在加样结束前数分钟打开PCR仪, 设定逆转录程序, 待PCR仪的温度升至50 ℃后迅速放入PCR管. 先50 ℃ 30 min, 进行逆转录产生cDNA, 然后进行PCR扩增. 按照试剂盒的要求所有PCR扩增程序的第一步均为94 ℃, 15 min以激活DNA聚合酶, 此后步骤分别如下: SSX-1: 变性94 ℃ 45 s, 退火52 ℃ 45 s, 延伸72 ℃ 60 s;NY-ESO-1: 变性94 ℃ 45 s, 退火52 ℃ 45 s, 延伸72 ℃45 s; 于PCR仪内扩增35个循环, 延伸72 ℃ 12 min. 称取琼脂糖2.0 g, 加入0.5×TBE到总体积为100 mL, 配成15 g/L的凝胶, 经微波炉加热90 s, 冷却到微烫手后 加入5 mL EB(0.5 g/L)充分混匀后灌胶. 取PCR产物5 mL, 加1 mL 6×Loading Buffer混匀后上样. 在0.5×TBE电泳液中, 用5 V/cm的电压电泳45 min, 在紫外线灯下观察DNA的电泳带, 并用Korda成像系统对产物进行分析. PCR扩增后未出现b2微球蛋白目的带的样本, 表明cDNA, 不完整, 为排除加样错误重做1次, 必要时重新提取该样本的RNA, 对于出现b2微球蛋白目的带的样本进行相关指标的阳性统计. 取RT-PCR产物100 mL, 在5 V/cm的电压下行20 g/L的琼脂糖凝胶电泳, 电泳45 min, 在紫外灯下快速切下含目的片段的琼脂糖凝胶, 将其放入1.5 mL离心管内. 将回收的胶称重. 按照每100 mg胶300 mL S1液的比例加入S1液, 置50 ℃水浴10 min, 使琼脂糖块完全溶化, 每2-3 min颠倒混匀一次. 因为目的片段小于500 bp, 所以还需向水浴后的胶样中加1/3 S1液体积的异丙醇, 混匀. 继续50 ℃水浴1 min. 将溶化后的胶样移入吸附柱, 12 000g, 离心30 s, 倒掉收集管中的液体, 再将吸附放入同一收集管. 在吸附柱中加入500 mL W1液, 离心15 s. 倒掉收集管中的液体, 再将吸附放入同一收集管. 离心1 min. 将吸附柱放入一个干净的1.5 mL的离心管中, 在吸附膜中央加入30 mL T1液, 静置1 min后, 离心1 min. 取3 mL加入2 mL 0.5×TBE 和1 mL 6×Loading Buffer, 进行20 g/L的琼脂糖凝胶电泳, 对回收产物进行鉴定, 如果电泳带很清晰并且无杂带, 说明回收和纯化成功. 测序: 将回收和纯化的样品交给上海生工生物工程技术服务有限公司. 测序结果如下: 将测序结果与从GeneBank检索的SSX-1(NM_005635)、NY-ESO-1(U87459)基因序列相对照, 基本一致, 证实所得到的cDNA确为要扩增的目的基因.
| 引物名称 | 序列 | 扩增片段(bp) |
| SSX-1A(5') | 5'-CTA AAG CAT CAG AGA AGA GAA GC-3' | |
| SSX-1B(3') | 5'-AGA TCT CTT ATT AAT CTT CTC AGA AA-3' | 422 |
| NY-ESO-1(5') | 5'-ATG GAT GCT GCA GAT GCG G-3' | |
| NY-ESO-1(3') | 5'-GGC TTA GCG CCT CTG CCC TG-3' | 329 |
| b2-M A(5') | 5'-CTC GCG CTA CTC TCT CTT TCT GG-3' | |
| b2-M B(3') | 5'-GCT TAC ATG TCT CGA TCC CAC TTA A-3' | 168 |
统计学处理 采用SSPS统计软件(10.0版本)进行, 所用的统计学方法为χ2检验, P<0.05认为有统计学意义.
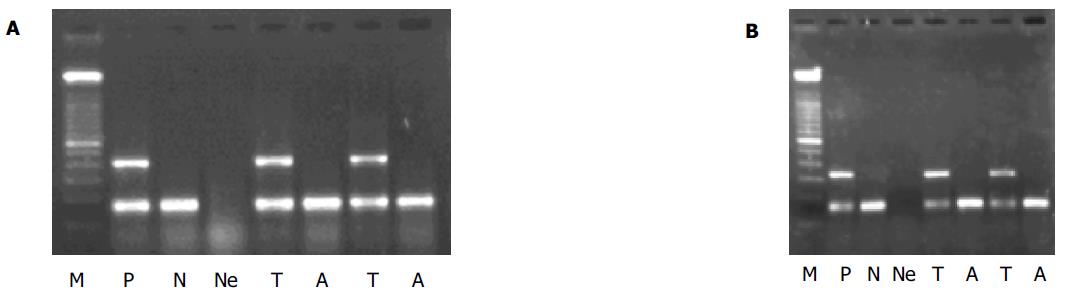
在HCC组织中, SSX-1及NY-ESO-1基因mRNA阳性率分别是61.5%和11.5%, PCR产物与阳性对照大小一致(图1A-B); 相应的癌旁组织及作为对照的肝硬化和正常肝组织中无阳性表达. 表达NY-ESO-1的3例标本同时表达SSX-1, 二者间未呈现互补关系. 阳性对照均为阳性, 而空白对照均为阴性, 说明结果可靠. 实验中发现在不同的HCC标本中SSX-1基因的RT-PCR产物电泳带的亮度存在较大差异, 说明SSX-1基因的表达存在差异. 随机选取SSX-1, NY-ESO-1表达阳性的PCR产物各1例测序, 测序结果表明所得的RT-PCR产物与从GeneBank检索的SSX-1(NM_005635), NY-ESO-1(U87459)扩增范围序列基本一致, 证实所得到的cDNA确为要扩增的目的基因.
HCC患者26例, 男21例, 女5例, 年龄17-79(平均53±14.8)岁; 随访20例, 随访时间最短6-15(平均9.6±2.6)mo, 术后6 mo内有7例复发, HBsAg阳性23例, HCV阳性3例, AFP阳性18例, AFP阴性8例; 术后病理显示中分化16例, 低分化10例;TNM分期III期和IV期各13例. 通过统计学分析发现SSX-1及NY-ESO-I基因在HCC组织中的表达与患者的年龄、性别、肿瘤大小、TNM分期、分化程度、血清AFP水平、肝炎病毒感染无显著相关性(P>0.05). 但是, 在8例AFP阴性的(<20 ng/L)HCC患者中有5例SSX-1基因表达阳性, 随访期间复发的7例患者中, 组织标本SSX-1基因阳性的5例, 阴性的2例, 组织SSX-1阳性者的复发率为41.7%(5/12), 阴性的复发率为25%(2/8); 组织NY-ESO-1阳性的复发率为0(0/3), 阴性的复发率为41.2%(7/17).
SSX-1mRNA的表达率为38.5%, 在组织表达SSX-1mRNA的患者的外周血中的表达率为62.5%(10/16)(图2A);NY-ESO-1的表达率为3.8%, 在组织呈阳性的标本中的表达率为33.3%(1/3)(图2B). 表达NY-ESO-1的血样不表达SSX-1, 二者有互补关系. 所有外周血中表达SSX-1或NY-ESO-1mRNA的患者, 其肿瘤组织中亦呈表达相应基因. 肝癌组织中不表达SSX-1或NY-ESO-1mRNA的患者, 其外周血中亦不表达该基因. 同法检测20例非肿瘤患者的外周血, 未发现这两种基因的表达. 统计学分析显示SSX-1及NY-ESO-I基因在HCC患者外周血中的表达与患者的年龄、性别、肿瘤大小、TNM分期、分化程度、血清AFP水平、肝炎病毒感染无显著相关性(P>0.05). 在8例AFP阴性的(<20 ng/L)HCC患者中有3例其外周血中SSX-1基因表达阳性. 随访期间复发的7例患者中有4例外周血SSX-1的表达为阳性, 外周血不表达SSX-1基因的3例患者中, 有2例其组织标本也不表达SSX-1. 外周血SSX-1阳性者的复发率为50%(4/8), 阴性的复发率为25%(3/12); 提示外周血SSX-1阳性的患者似乎更易复发, 因此以SSX-1基因mRNA为肿瘤标志物, 也许可以用于HCC的辅助诊断和作为监测复发、转移和预后的指标.
SSX-1基因位于Xp11.23-p11.22. 该基因DNA片段的长度为8 720 bp, 含6个外显子, 剪辑后的mRNA长度为766 bp, 编码188个氨基酸残基的蛋白[17]. 研究SSX1基因在HCC组织及外周血中的表达, 揭示其与HCC的转移, 复发及预后间的关系, 对于指导临床治疗, 探讨其能否作为HCC免疫治疗的靶点, 以及监测肿瘤的转移等可能具有重要的意义. NY-ESO-1的上述表达方式及基因位点(位于X染色体)与先前发现的CT基因相同, 因此属于CT家族. 研究NY-ESO-1mRNA在肝癌组织中的表达情况, 及表达NY-ESO-1mRNA的肿瘤播散细胞在循环血液中的存在情况, 对于肝癌的免疫治疗可能具有重要意义. 我们发现虽然SSX-1基因在HCC组织中的表达与患者的性别, 年龄, 肿瘤大小及AFP等临床指标间无显著相关性, 但是在20例随访患者中, 组织SSX-1阳性患者的短期(6 mo)复发率为41.7%(5/12), 阴性患者的复发率为25%(2/8), 外周血中SSX-1阳性患者的短期复发率为50%(4/8), 阴性患者的复发率为25%(2/8), 阳性者明显增高, 提示SSX-1阳性的患者可能更易复发, 预后差. NY-ESO-1mRNA只在HCC组织中表达, 在其相应的癌旁组织及对照的肝硬化及正常肝组织中均无表达, 具有高度特异性, 但是表达率偏低, 仅为11.5%(3/26), 而且与另一研究指标SSX-1的表达间无互补关系, 与各项临床指标间亦无显著相关性. 关于NY-ESO-1mRNA在HCC组织中表达的研究不多, Boyer et al[16]报道的检测结果为0(0/22), Chen et al[18]报道的为36.7%, 我们的研究结果介于二者之间, 显示NY-ESO-1基因在HCC组织中呈低表达. 虽然NY-ESO-1在HCC中呈低表达, 但是有研究表明, 50%的NY-ESO-1阳性的黑色素瘤患者体内可检测到NY-ESO-1抗体, 这一比例是已发现的CT抗原中最高的, 而且已经发现了NY-ESO-1抗原肽的CTL表位(HLA-A2), 并证实NY-ESO-1抗原能在患者体内同时引发抗肿瘤的体液和细胞免疫, 因此, 如能证实 NY-ESO-1抗原在其阳性的HCC患者中也能引发如此高比例的细胞和/或体液免疫, 那么NY-ESO-1抗原有可能成为NY-ESO-1阳性HCC患者最有效的免疫治疗靶点, 但这有待于进一步研究证实.
对于血液中的肿瘤播散细胞(DTC)的检测, 已经开展了约半个世纪, 多数研究集中于DTC在骨髓中的检测. 因为外周血中的DTC的含量较骨髓中的更少, 因而对检测方法的灵敏度要求更高, 常规的方法, 包括用于检测骨髓中DTC的免疫细胞/组织化学技术(ICC/IHC)也不能满足其要求, 所以对于外周血中DTC的检测主要开展于更灵敏的RT-PCR技术诞生后的近10年间, 尤其是近5-6年. 将RT-PCR技术用于检测外周血中的DTC具有两大优势: (1)他是目前用于检测DTC灵敏度最高的方法, 依据不同的条件, 其灵敏度可达1/(106-108), 体外试验中可以从1 mL全血中检测出一个肿瘤细胞[5]; (2)因为mRNA分子极不稳定, 而组织及血液中的RNA酶又无处不在, 所以体内游离以及凋亡细胞中的mRNA会立即被RNA酶降解. 因此如能从外周血中扩增出靶mRNA序列, 即表明其中含有存活的靶细胞. 如果所用mRNA具有肿瘤特异性, 那么阳性结果将表明, 外周血中存在活的肿瘤细胞. 尽管对于外周血中的肿瘤细胞的临床意义, 仅仅是代表从原发瘤脱落的无转移能力的肿瘤细胞, 还是代表着转移播散?一直存在争议, 但是有一个不容忽视的事实, 即脱离原发灶的肿瘤细胞, 如果不通过血液循环就不可能到达远隔器官形成转移灶, 例如, 肝癌的肺转移及脑转移. 从这个角度来看, 外周血中的肿瘤细胞与肿瘤的转移与复发间应该存在某种联系, 近10年来, 已有相当一部分研究结果肯定了外周血中肿瘤细胞的临床意义. 因此, 选择肿瘤特异性mRNA为标记, 检测肿瘤患者外周血中的肿瘤细胞, 对于监测肿瘤的转移, 复发及指导临床治疗可能具有重要意义.
以往的文献表明, SSX-1和NY-ESO-1mRNA具有肿瘤特异性[14,19]. 本实验也证实二者在HCC组织中高特异性表达, 适合于作为检测外周血中肿瘤细胞的标志, 尤其是SSX-1, 不但高度特异, 而且还具有较高的表达率. 本研究发现. (1)SSX-1mRNA在非肿瘤患者的外周血中的表达率为0, 而在HCC患者外周血中的表达率为10/26, 提示其具有辅助诊断的价值; (2)37.5%(3/8)的AFP正常患者的外周血中SSX-1mRNA阳性, 提示二者联合应用可能有助于提高HCC的检出率. (3)外周血SSX-1mRNA阳性患者的短期复发率为50%(4/8), 阴性患者的复发率为25%(3/12), 虽然因例数较少不具有统计学意义, 但提示外周血中SSX-1mRNA阳性的患者似乎更易复发. (4)虽然外周血中的NY-ESO-1mRNA阳性率很低, 仅为3.8%(1/26), 但是与SSX-1mRNA在外周血中的表达有互补关系, 因而仍有应用价值.
总之, 本实验得到了以下发现: (1)SSX-1和NY-ESO-1基因在肝癌组织中高特异性表达, 有望成为HCC的特异性免疫治疗新的潜在靶位; (2)SSX-1及NY-ESO-1mRNA在HCC外周血中高特异性表达, 以他们为标记检测患者外周血中的肝癌细胞, 对于HCC具有定性诊断价值; (3)部分AFP正常(<20 ng/L)HCC患者的外周血中有SSX-1mRNA的表达, 提示二者联合应用有助于提高HCC的检出率. (4)表达SSX-1mRNA的HCC患者的短期复发率明显增高, 提示可将SSX-1mRNA作为监测HCC患者复发、转移和预后的指标.
编辑: 潘伯荣 审读:张海宁
| 1. | Tang ZY, Yu YQ, Zhou XD, Ma ZC, Wu ZQ. Progress and prospects in heptocellular carcinorma surgery. Ann Chir. 1998;52:558-563. [PubMed] |
| 2. | Ghossein RA, Osman I, Bhattacharya S, Ferrara J, Fazzari M, Cordon-Cardo C, Scher HI. Detection of prostatic specific membrane antigen messenger RNA using immunobead reverse transcripatase polymerase chain reaction. Diagn Mol Pathol. 1999;8:59-65. [PubMed] [DOI] |
| 3. | Muller C, Petermann D, Pfeffel F, Oesterreicher C, Fugger R. Lack of specificity of albumin-mRNA-positive cells as a marker of circulating hepatoma cells. Hepatology. 1997;29:879-879. [PubMed] [DOI] |
| 4. | Lemoine A, LeBricon T, Salvucci M, Azoulay D, Pham P, Raccuia J, Bismuth H, Debuire B. Prospective evaluation of circulating hepatocytes by alpha-fetoprotein mRNA in humans during liver surgery. Ann Surg. 1997;226:43-50. [PubMed] [DOI] |
| 5. | Matsuzaki A, Suminoe A, Hattori H, Hoshina T, Hara T. Immunotherapy with autologous dendritic cells and tumor-specific synthetic peptides for synovial sarcoma. J Pediatr Hematol Oncol. 2002;24:220-223. [PubMed] [DOI] |
| 6. | Tureci O, Sahin U, Zwick C, Koslowski M, Seitz G, Pfreundschuh M. Identification of a meiosis-specific protein as a member of the class of cancer/testis antigens. Proc Natl Acad Sci USA. 1998;95:5211-5216. [PubMed] [DOI] |
| 7. | Chen YT, Scanlan MJ, Sahin U, Tureci O, Gure AO, Tsang S, Williamson B, Stockert E, Pfreundschuh M, Old LJ. A testicular antigen aberrantly expressed in human cancers detected by autologous antibody screening. Proc Natl Acad Sci USA. 1997;94:1914-1918. [PubMed] [DOI] |
| 8. | Chen YT, Gure AO, Tsang S, Stockert E, Jager E, Knuth A, Old LJ. Identification of multiple cancer/testis antigens by allogenic antibody screening of a melanoma cell line library. Proc Natl Acad Sci USA. 1998;95:6919-6923. [PubMed] [DOI] |
| 9. | Yamashita N, Ishibashi H, Hayashida K, Kudo J, Takenaka K, Itoh K, Niho Y. High frequency of the MAGE-1 gene expression in hepatocellular carcinoma. Hepatology. 1996;24:1437-1440. [PubMed] [DOI] |
| 10. | Tahara K, Mori M, Sadanaga N, Sakamoto Y, Kitano S, Makuuchi M. Expression of the MAGE gene family in human hepatocellular carcinoma. Cancer. 1999;85:1234-1240. [PubMed] [DOI] |
| 11. | Jager D, Stockeert E, Karbach J, Herrlinger K, Atmaca A, Arand M, Chen YT, Gnjatic S, Old LJ, Knuth A. Urine antibody against human cancer antigen NY-ESO-1. Cancer Immunity. 2002;2:10. [PubMed] |
| 12. | Clark J, Rocques PJ, Crew AJ, Gill S, Shipley J, Chan AM, Gusterson BA, Cooper CS. Identification of novel genes, SYT and SSX, involved in the t (X;18)(p11. 2;q11. 2) translocation found in human synovial sarcoma. Nat Genet. 1994;7:502-508. [PubMed] [DOI] |
| 13. | Crew AJ, Clark J, Fisher C, Gill S, Grimer R, Chand A, Shipley J, Gusterson BA, Cooper CS. Fusion of SYT to two genes, SSX1 and SSX2, encoding proteins with homology to the Kruppel-associated box in human synovial sarcoma. EMBO J. 1995;14:2333-2340. [PubMed] |
| 14. | Dos Santos NR, Torensma R, de Vries TJ, Schreurs MW, de Bruijn DR, Kater-Baats E, Ruiter DJ, Adema GJ, van Muijen GN, van Kessel AG. Heterogeneous expression of the SSX cancer/testis antigens in human melanoma lesions and cell lines. Cancer Res. 2000;60:1654-1662. [PubMed] |
| 15. | Tureci O, Chen YT, Sahin U, Gure AO, Zwick C, Villena C, Tsang S, Seitz G, Old LJ, Pfreundschuh M. Expression of SSX genes in human tumors. Int J Cancer. 1998;77:19-23. [PubMed] [DOI] |
| 16. | Chen YT, Boyer AD, Viars CS, Tsang S, Old LJ, Arden KC. Genomic cloning and localization of CTAG, a gene encoding an autoimmunogenic cancer-testis antigen NY-ESO-1, to human chromosome Xq28. Cytogenet Cell Genet. 1997;79:237-240. [PubMed] [DOI] |
| 17. | Lee SY, Obata Y, Yoshida M, Stockert E, Williamson B, Jungbluth AA, Chen YT, Old LJ, Scanlan MJ. Immunomic analysis of human sarcoma. Proc Natl Acad Sci USA. 2003;100:2651-2656. [PubMed] [DOI] |
| 18. | Chen CH, Chen GJ, Lee HS. Expressions of cancer-testis antigens in human hepatocellular carcinomas. Cancer Lett. 2001;164:189-195. [PubMed] [DOI] |
| 19. | Mori M, Mimori K, Ueo H, Tsuji K, Shiraishi T, Barnard GF, Sugimachi K, Akiyoshi T. Clinical significance of molecular detection of carcinoma cells in lymph nodes and peripheral blood by reverse transcription-polymerase chain reaction in patients with gastrointestinal or breast carcinomas. J Clin Oncol. 1998;16:128-132. [PubMed] [DOI] |