修回日期: 2005-04-04
接受日期: 2005-04-09
在线出版日期: 2005-07-28
目的: 检测SSX家族中SSX-2和SSX-5mRNA在肝细胞癌(HCC)组织和外周血中的表达情况及其与临床指标之间的关系, 评价其作为肝癌免疫治疗特异性靶位的可能性, 及作为肝癌辅助诊断和监测预后、复发指标的可能性.
方法: 用一步法逆转录-聚合酶链反应(RT-PCR)方法对HCC患者26例的癌组织、相应癌旁组织和外周血及对照(肝硬化和正常肝组织)中SSX-2,SSX-5mRNA的表达进行了检测, 为验证结果的可靠性, 随机选取每一种抗原RT-PCR呈阳性的产物1例进行DNA序列测定, 并对检测结果与AFP, HBSAg, 肿瘤直径, TNM分期等临床指标之间的相关性进行分析.
结果: 26例HCC肝癌组织SSX-2和SSX-5基因表达阳性率分别为34.6%和46.2%, 两种基因同时表达的有4例(15.4%), 至少有一种基因表达的有17例(65.4%), 癌旁组织表达的阳性率皆为0%;在26例HCC患者外周血中, SSX-2mRNA的表达率为19.2%, 在组织呈阳性的患者外周血中的表达率为55.6%;SSX-5mRNA的表达率为23.1%, 在组织呈阳性的患者外周血中的表达率为50%;两种基因同时表达者为7.7%, 至少有一种表达者为34.6%. 对照组中12例肝硬化和10例非肿瘤肝组织及外周血均未检测到SSX-2和SSX-5的表达. 二者均取1例DNA测序, 结果表明RT-PCR产物为SSX-2和SSX-5 cDNA.SSX-2和SSX-5的表达与年龄、性别、肿瘤大小、分化程度、AFP水平、HBV感染等无显著相关性(P>0.05). 部分AFP正常(<20 ng/L) HCC患者外周血中存在SSX-2或/和SSX-5基因的表达.
结论: SSX-2和SSX-5基因在HCC中呈高频率、高特异表达, 二者可同时在HCC中表达, 可以作为肝癌免疫治疗特异性靶位. 二者的表达与年龄、性别、肿瘤大小、TNM分期、血清AFP水平、肝炎病毒感染无显著相关性; SSX-2, SSX-5基因的表达可用于HCC的辅助诊断和作为监测复发和预后的指标.
引文著录: 吴力群, 王新建, 张斌, 卢云, 杨金镛. 肝细胞癌组织和外周血中肿瘤/睾丸抗原SSX-2和SSX-5的表达. 世界华人消化杂志 2005; 13(14): 1667-1672
Revised: April 4, 2005
Accepted: April 9, 2005
Published online: July 28, 2005
AIM: To investigate the expression of SSX-2 and SSX-5 mRNA in the tissues and peripheral blood of patients with hepatocellular carcinoma (HCC) and their relations with kinds of cilinical indexes, and to evaluate the possibility of using them as the targets for specific immunotherapy of HCC as well as the markers to in adjuvant diagnosis and prognosis and recurrence detection of HCC.
METHODS: One-step reverse transcription polymerase chain reaction (RT-PCR) wasused to detect the expression of SSX-2 and SSX-5 mRNA in the cancer tissues, corresponding cancer-adjacent tissues and peripheral blood of 26 patiernts with HCC, as well as in12 cirrositic tissues and 10 normal tissuesOne sample, selected from each gene with positive PCR outcomes, was sequenced to testify the reliability. The relation between SSX-2, SSX-5 expression and kinds of clinical indexes, such as a-fetoprotein (AFP), HBsAg, diameter of the tumor, TNM staging, was analysed.
RESULTS: The positive rates of SSX-2 and SSX-5 mRNA expression were 34.6%(9/26) and 46.2%(12/26) in HCC tissues respectively, while none of the two genes was detected in the corresponding cancer-adjacent tissues. At least one gene was expressed in 65.4%(17/26) of HCC tissues and the co-expression was found in 15.4%(4/26). In the peripheral blood of the 26 HCC patients, the positive-expression rates of SSX-2 and SSX-5 mRNA were 19.2%(5/26) and 23.1%(6/26) respectively. The positive rates of single expression and co-expression were 34.6%(9/26) and 7.7%(2/26) respectively. In the 12 patients with hepatic cirrhosis and 10 nomal controls, none of SSX-2 and SSX-5 mRNA was detectable in liver tissues and peripheral blood. After sequencing, the RT-PCR products were confirmed to be the target cDNA. No relationship was found between the expression of the two genes and the clinical indicators such as age, sex, tumor size, serum AFP level and infection of hepatitis B virus (P > 0.05). However, in some patients with normal serum AFP ( < 20 ng/L), specific expression of SSX-2 and/or SSX-5 genes were/was observed in the peripheral blood.
CONCLUSION: SSX-2 and SSX-5 mRNA are expressed with a high frequency and specificity in HCC, and they can be also co-expressed. They can be used as the targets for specific immunotherapy of HCC. No relationship exists between the expression of SSX-2 and SSX-5 and clinical indicators, and the expression of the two genes may be used as the markers in diagnosis and prognosis prediction of HCC.
- Citation: Wu LQ, Wang XJ, Zhang B, Lu Y, Yang JY. Expression of cancer-testis antigen SSX-2 and SSX-5 in tissues and peripheral blood of patients with hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1667-1672
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1667.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1667
原发性肝癌(hepatocellular carcinoma, HCC)是世界范围内常见的恶性肿瘤之一, 居我国恶性肿瘤致死类型的第2位. 在HCC的治疗方面, 主要是以手术为主, 辅之以化疗、放疗、酒精注射及射频消融等, 在一定程度上改善了患者的预后, 并提高了生活质量, 但是依然有近一半HCC的患者死亡. 目前治愈性肝切除术后5年生存率估计在17-33%, 但治愈性切除术后5年复发率高达61.5%, 小肝癌的复发率也高达43.5%. 在HCC中, SSX家族基因研究较少, 我们对SSX基因家族中的SSX-2和SSX-5在肝癌组织和外周血中的表达情况进行研究, 以期能找到适合HCC免疫治疗的新靶位, 并探讨是否能将其作为一种新的HCC的诊断指标, 或监测预后和复发的指标.
手术前取外周抗凝血约100 mL(加入肝素200 kU/L), 留待分离外周血单核细胞. 手术切下标本后立刻先取癌旁组织(距病变边界2-5 cm外), 分别切成约0.5 cm×0.5 cm×0.5 cm的小块, 置于冻存管中, 立即放入液氮中速冻; 然后再取癌组织, 切成约0.5 cm×0.5 cm×0.5 cm的小块, 置于冻存管后也经液氮速冻. 然后将这些标本保存于-70 ℃低温冰箱中, 用于检测CTA基因的mRNA表达. 用同样的方法取12例肝硬化组织和10例非肿瘤肝组织作为研究对照. 另取正常人的睾丸组织作为阳性对照. 将所取外周血用PBS稀释, PBS和血液的稀释比是1:1. 取50 mL离心管数个, 每管加入10-15 mL淋巴细胞分离液, 加入上述已稀释的抗凝血, 血液和分离液的比例为2:1, 向分离液加入血液时, 应使血液沿管壁缓慢流下叠于分离液上. 上述各关置于离心机, 2 500 r/min离心20 min, 用移液管吸出PBMC层. PBMC置于新离心管中, 加入5倍体积的PBS, 离心1 500 r/min, 10 min, 如此漂洗PBMC2次. 用PBS重悬漂洗后的PBMC, 取细胞悬液10-20 uL, 加入等量4 g/L台盼蓝, 混匀后上细胞计数板进行计数, 细胞总数=四个大方格总数/2×104×细胞悬液总量. 一般情况下, 100 mL血可获得8-10×107个PBMC. 将细胞悬液离心1 500 r/min 10 min, 其上清, 加入冻存液重悬细胞, 分装于冻存管中, 每管装1×107个细胞. 将冻存管先置于4 ℃冰箱, 约1 h后移入-80 ℃冰箱, 24 h后移入液氮中保存.
从液氮中取出细胞标本在37 ℃水浴箱内快速解冻, 以4 ℃, 2 000 r/min离心10 min, 弃去冻存液加入Trizol(美国Gibco公司)1 mL, 反复吹打使细胞充分裂解. 从-70 ℃冰箱中取出组织标本约50-100 mg置入研钵内, 在有液氮存在的情况下研成碎末, 待液氮干燥后, 立即加 Trizol 1 mL不断研磨直到完全成为液体后, 移入1.5 mL离心管中. 在上述裂解液中加入三氯甲烷200 mL, 用力摇晃15 s, 室温放置2-3 min.12 500 g, 4 ℃离心15 min, 小心吸取上清液将其移入另一1.5 mL离心管中, 加入异丙醇0.5 mL, 于室温放置10 min进行RNA沉淀. 12 500 g, 4 ℃离心10 min, 小心弃去上清液, 加入DEPC处理水配制的750 mol/L乙醇1 mL, 将白色RNA沉淀整块吹起进行漂洗. 7 500 g, 4 ℃离心5 min后, 弃去上清液, 再加入750 mol/L乙醇1 mL重复洗涤一次, 7 500 g, 4 ℃离心5 min后, 小心弃去上清液, 吸尽管壁残留的液体. 冰上放置5-10 min, 待残留的乙醇干燥后, 根据肉眼观察的RNA量的多少, 将所得RNA溶于30-80 mL DEPC处理过的纯净水中. 取RNA样品4 mL, 加无RNA酶的水196 mL稀释50倍, 用紫外分光光度计对RNA在260 nm下的吸光度进行定量. RNA浓度(g/L) = A260×核酸稀释倍数×40/1 000. 用紫外分光光度计对RNA在260 nm和280 nm下的吸光度A260和A280进行定量, 计算A260/A280, 所有标本的比值要求在1.75-1.95之间. 低于此值者表明其含有蛋白质杂质, 用三氯甲烷重新提纯. 琼脂糖1 g, 加入0.5×TBE到总体积为50 mL, 配成20 g/L的凝胶, 经微波炉加热100s, 冷却到微烫手时加入 EB(0.5 g/L)2.5 mL充分混匀后灌胶. 取RNA溶液3 mL, 加0.5×TBE 2 mL, 6×loading Buffer 1 mL, 混匀后上样. 在0.5×TBE的电泳液中, 以5 V/cm的电压电泳20 min, 在紫外灯下观察RNA的电泳带, 比较核糖体RNA(rRNA)28 S和18 S两条带, 如果在EB作用下显色强度为2:1, 说明本实验提取的RNA比较完整.
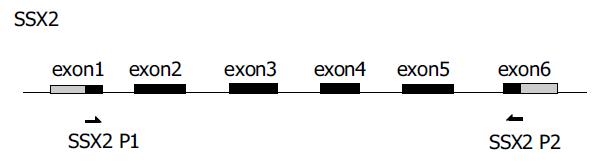
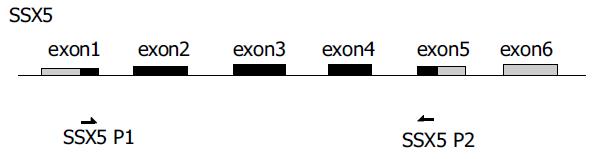
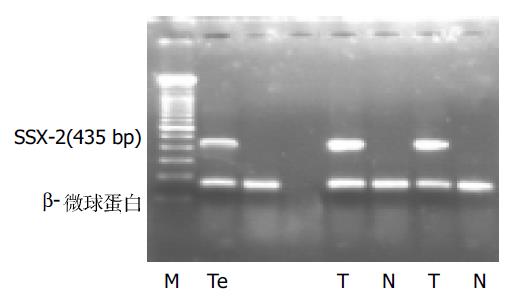
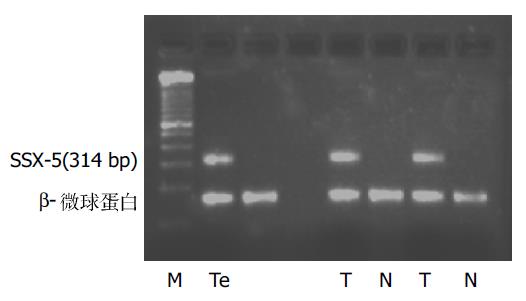
1.2.1 逆转录聚合酶链式反应(RT-PCR): 所用的引物和内参照b2微球蛋白(b2-MG)引物均委托上海生工公司合成, 引物序列、扩增片段大小及其在基因结构图上的位置详见表1, 图1, 2. 所用引物序列参照了以前研究者的设计[11].SSX-2含有6个外显子(exon), 我们所采用的引物位于第1和第5, 6外显子(跨越一个内含子)上, 扩增片段长度为435 bp, 若为基因组DNA污染的产物, 因包含4个内含子, 片段远较目的产物长, 在电泳图上容易区分. SSX-5含有6个外显子(exon), 所采用的引物位于第1和第5外显子上, 扩增片段长度为314 bp, 若为基因组DNA污染的产物, 因包含4个内含子, 片段远较目的产物长, 在电泳图上容易区分. 一步法RT-PCR按照50 uL反应体系, 依次向薄壁PCR管中加入无RNA酶水26 mL;5倍缓冲液10 mL;10 mmol/L dNTPs 2 mL;15 mmol/L上游引物2 mL;15 mmol/L下游引物2 mL;10 mmol/L b2-M P1 2 mL;10 mmol/L b2-M P2 2 mL;RT-PCR酶2 mL; 所提取的RNA 2 mL; 总体积50 mL. 反应条件: 先50 ℃ 30 min, 进行逆转录产生cDNA, 然后进行PCR扩增. 按照试剂盒的要求所有PCR扩增程序的第一步均为94 ℃, 15 min以激活DNA聚合酶, 此后步骤:SSX-2: 变性94 ℃ 45 s, 退火54 ℃ 45 s, 延伸72 ℃ 60 s;SSX-5: 变性94 ℃ 45 s, 退火52 ℃ 45 s, 延伸72 ℃ 45 s; 于PCR仪内扩增35个循环, 延伸72 ℃ 12 min.
| 引物名称 | 序列 | 扩增片断(bp) |
| SSX-2A(5')P1 | 5'-GTG CTC AAA TAC CAG AGA AGA TC-3' | |
| SSX-2B(3')P2 | 5'-TTT TGG GTC CAG ATC TCT CGT G-3' | 435 |
| SSX-5A(5')P1 | 5'-GTT CTC AAA TAC CAC AGA AGA TG-3' | |
| SSX-5B(3')P2 | 5'-CTC TGC TGG CTT CTC GGG CG-3' | 314 |
| Β2-M A(5')P1 | 5'-CTC GCG CTA CTC TCT CTT TCT GG-3' | |
| Β2-M B(3')P2 | 5'-GCT TAC ATG TCT CGA TCC CAC TTA A-3' | 168 |
1.2.2 CTA基因PCR产物的纯化和测序: 取PCR产物100 mL, 在5 V/cm的电压下行10 g/L的琼脂糖凝胶电泳, 电泳30 min, 在紫外灯下快速切下含目的片段的琼脂糖凝胶(切胶时应尽可能多的去掉不含DNA的琼脂糖). 按每100 mg琼脂糖加入S1液300 mL, 置于50 ℃水浴10 min, 是琼脂糖完全熔化, 每分钟颠倒混匀一次. 加入1/3 S1液体积的异丙醇, 混匀, 置于50 ℃水浴1 min, 混匀. 将熔化后的Agarose液已入吸附柱, 离心30 s, 倒掉收集管中的液体, 在将吸附柱放入同一收集管中. 在吸附柱中加入W1液500 mL, 离心15 s, 倒掉收集管中的液体, 将吸附柱放入同一收集管中. 在吸附柱中加入500 mL W1液, 静置1 min, 离心15 s, 倒掉收集管中的液体, 将吸附柱放入同一收集管, 离心1 min. 将吸附柱放入一个干净的1.5 mL离心管中, 在吸附膜中央加入T1液50 mL, 静置1 min, 离心1 min. 将回收产物进行20 g/L的琼脂糖凝胶电泳, 如果电泳带很清晰并且无杂带, 说明回收和纯化成功. 所回收和纯化的样品及相应的PCR上游引物送请上海生工公司进行DNA序列测定.
统计学处理 采用SSPS统计软件(10.0版本)进行, 所用的统计学方法为χ2检验, P<0.05认为有统计学意义.
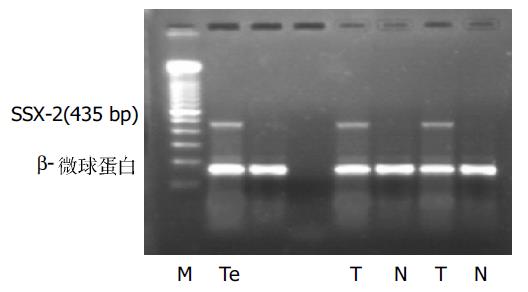
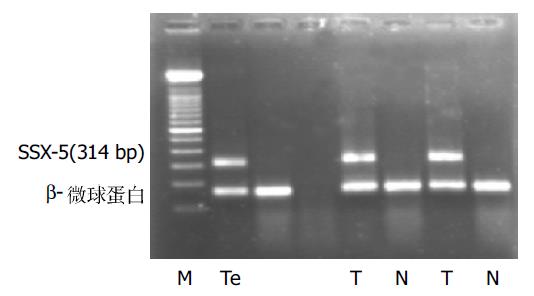
在26例HCC组织中, SSX-2, SSX-5基因mRNA阳性率分别是34.6%和46.2%, 两种基因同时表达的有4例(15.4%), 至少有一种基因表达的有17例(65.4%), 癌旁组织表达的阳性率皆为0%;对照组中12例肝硬化和10例非肿瘤患者正常肝组织均未检测到SSX-2和SSX-5的表达. 电泳显示PCR产物与阳性对照大小一致(图3-6).RT-PCR产物与从GeneBank检索的SSX-2(NM_003147), SSX-5(NM_021015)扩增范围序列基本一致, 证实所得到的cDNA确为要扩增的目的基因, 所得结果未发现有固定的碱基改变. 在不同的HCC标本中SSX-2和SSX-5基因的RT-PCR产物电泳带的亮度存在较大差异, 而在同一标本中二者的表达也存在有强弱不等的现象, 说明二者的表达存在差异
| 临床指标 | SSX-2 | SSX-5 |
| 年龄<40岁 | 1/4(25%) | 2/4(50%) |
| ≥40岁 | 8/22(36.4%) | 10/22(45.5%) |
| 男性 | 8/21(38.1%) | 10/21(47.7%) |
| 女性 | 1/5(20%) | 2/5(40%) |
| 肿瘤大小 | ||
| ≤5 cm | 5/16(31.2%) | 7/16(43.8%) |
| >5 cm | 4/10(40%) | 5/10(50%) |
| TNM分期 | ||
| Ⅰ, Ⅱ, Ⅲ期 | 4/13(30.8%) | 5/13(38.5%) |
| Ⅳ期 | 5/13(38.5%) | 7/13(53.8%) |
| HBV(+) | 8/23(%) | 11/23(%) |
| HBV(-) | 1/3(%) | 1/3(%) |
| AFP≤20 μg/L | 2/8(25%) | 3/8(37.5%) |
| AFP>20 μg/L | 7/18(38.9%) | 9/18(50%) |
在26例HCC患者中, 男21例, 女5例, 年龄17-79(平均年龄53±14.8)岁; 有完整随访资料的病例有20例, 随访时间6-15(平均9.6±2.6)mo, 共有7例复发, HBsAg阳性23例, HCV阳性3例, AFP阳性18例, AFP阴性8例; 术后病理显示中分化15例, 低分化11例;TNM分期III期和IV期各13例. 通过统计学分析发现SSX-2及SSX-5基因在HCC组织中的表达与患者的年龄、性别、肿瘤大小、TNM分期、血清AFP水平、肝炎病毒感染无显著相关性(P>0.05). 但是, 在8例AFP阴性的(<20 ng/L)HCC患者中有2例SSX-2基因表达阳性, 有3. 例SSX-5基因表达阳性. 随访的20例病例中, 术后6 mo期间有7例出现复发, 其中SSX-2基因表达阳性者2例, 占随访病例中SSX-2表达阳性者的22.2%;SSX-5基因表达阳性者2例, 占随访病例中SSX-5表达阳性者的18.2%(有1例SSX-5表达阳性者失去随访), 复发与阳性表达之间无显著的相关性(P>0.05).
在26例HCC患者外周血中, SSX-2mRNA的表达率为19.2%, 在组织呈阳性的患者外周血中的表达率为55.6%;SSX-5mRNA的表达率为23.1%, 在组织呈阳性的患者外周血中的表达率为50%. 两种基因同时表达者为7.7%, 至少有一种表达者为34.6%. 在外周血中表达为阳性者, 其在组织中的表达都为阳性; 组织中表达为阴性者, 其在外周血中表达也为阴性. 对照组中12例肝硬化和10例非肿瘤患者外周血中均未检测到SSX-2和SSX-5的表达. 在实验中严格设立阳性对照、空白对照和内参照, 所有的内参照均为阳性, 说明逆转录产物cDNA的质量良好; 所有的阳性对照电泳带显示良好, 而空白对照均为阴性, 说明无假阳性或假阴性情况出现, 所有目的带与阳性对照带的大小相同, 结果可靠.
| 临床指标 | SSX-2 | SSX-5 |
| 年龄<40岁 | 1/4(25%) | 0/4(0%) |
| ≥40岁 | 4/22(18.2%) | 6/22(27.3%) |
| 男性 | 5/21(23.8%) | 5/21(23.8%) |
| 女性 | 0/5(0%) | 1/5(20%) |
| 肿瘤大小 | ||
| ≤5 cm | 3/16(18.8%) | 4/16(25%) |
| >5 cm | 2/10(20%) | 2/10(20%) |
| TNM分期 | ||
| Ⅰ, Ⅱ, Ⅲ期 | 1/13(7.7%) | 2/13(15.4%) |
| Ⅳ期 | 4/13(30.8%) | 4/13(30.8%) |
| HBV(+) | 5/23(21.7%) | 6/23(26.1%) |
| HBV(-) | 0/3(0%) | 0/3(0%) |
| AFP≤20 μg/L | 2/8(25%) | 1/8(12.5%) |
| >20 μg/L | 3/18(16.7%) | 5/18(27.8%) |
患者的各项临床指标同前, 统计学分析显示SSX-2及SSX-5基因在HCC患者外周血中的表达与患者的年龄、性别、肿瘤大小、TNM分期、血清AFP水平、肝炎病毒感染无显著相关性(P>0.05). 在8例AFP为阴性的(<20 ng/L)HCC患者外周血中有2例SSX-2基因表达阳性, 有2例SSX-5基因表达阳性. 随访的20例病例中, 术后6 mo期间有7例出现复发, 其中有1例外周血SSX-2的表达为阳性, 占随访病例中SSX-2表达阳性者的20%; 有2例外周血SSX-5的表达为阳性, 占随访病例中SSX-5表达阳性者的40%(有1例SSX-5表达阳性者失去随访);SSX-2或SSX-5表达阳性者, 随访6mo内的复发率为37.5%(3/8). 复发与外周血中基因的表达之间无显著相关性.
关于SSX-2和SSX-5基因在HCC中的表达情况的研究较少, Chen et al[1]应用巢式PCR的方法检测了SSX基因亚家族在肝癌中的表达情况, 结果发现SSX-2和SSX-5基因mRNA在肝癌中的阳性率分别为46.7%和33.3%, 在相应的癌旁组织中为0%和10%.我们采用一步法RT-PCR的方法研究了SSX-2和SSX-5基因在肝癌组织中的表达情况. 在所检测的26例HCC组织中, SSX-2和SSX-5基因mRNA阳性率分别是34.6%(9/26)和46.2%, 表达频率较高; 两种基因同时表达的有4例(15.4%), 至少有一种基因表达的有17例(65.4%); 发现SSX-2和SSX-5基因在癌旁组织及对照组的肝硬化和正常肝组织中均没有表达. 此结果与Chen et al[1]的结果大致相同(两种基因表达阳性率分别为34.6%和46.2%), 但我们的研究结果中, 两种基因在癌旁和正常肝组织中均无表达, 至于为什么SSX-5会在癌旁组织中出现, 原因仍不清楚, Chen et al[1]认为可能是由于在癌旁存在微型转移灶, 或者是因为在肝硬化时期肝组织已经有SSX-5的表达. 根据我们的研究结果, 我们认为前一种可能性较大, 因为巢式PCR(两轮PCR)是一种高度敏感的方法, 可达到检测一个肿瘤细胞的水平, 而现有的形态学检查尚不能达到此水平, 因此不能完全排除SSX-5基因呈阳性的癌旁组织存在微小转移的可能性. 同时也不能排除采集标本时标本受到污染的可能. 我们的研究结果提示SSX-2和SSX-5基因在肝癌中呈高频率、高特异表达, 这可能为肝癌的免疫治疗提供了新的潜在的靶位. 另外, 这两个基因在肝癌中可同时表达为采用多价瘤苗进行肝癌的免疫治疗提供了实验依据. 但是, 由于SSX基因的表达存在个体差异性, 即异质性问题(我们的研究也显示SSX-2和SSX-5基因在不同的标本中的表达有差异), 而且目前我们只是进行定性检测, 以这种定性结果指导选择病例进行免疫治疗, 其合理性值得商榷. 如能从蛋白质水平和定量检测其表达, 可能对选择合适的病例进行免疫治疗更具指导价值. 我们发现SSX-2和SSX-5基因的表达与年龄、性别、肿瘤大小、TNM分期、血清AFP水平、肝炎病毒感染无显著相关性(P>0.05).
目前对HCC的诊断仍AFP的检测和影像学检查为主, 但都可造成一定的假阳性和假阴性, 所以, 临床上仍希望能找到一种特异性更高的诊断方法. 另外, 肝癌细胞具有容易侵犯血管的特性, 极易造成肝癌细胞的血行播散, 可能造成手术切除后的高复发率和高转移率, 目前临床仍以检测AFP作为检测HCC复发的指标, 但其特异性仍不能令人满意, 这就要求我们寻找一种特异性更高的检测HCC复发的指标. 近年来兴起的运用RT-PCR方法检测循环肿瘤细胞(这种方法敏感度极高, 可以从107-8个单个核细胞中检测出1个癌细胞[2-3]), 为在这方面的研究提供了广阔的前景. RT-PCR技术已经成功地应用到多种实体肿瘤中, 以检测进入循环中微量的肿瘤细胞, 如黑色素瘤[4-5]、神经母细胞瘤[6]、前列腺癌[7-9]、乳腺癌[9-10]、胃癌[11-12]和结直肠癌[11-13]等, 当然这种技术也可以被用于检测HCC患者的循环肿瘤细胞. 最近的资料证实可以应用RT-PCR方法检测循环中的肝癌细胞, 但是所用的标志物都是组织特异性标记物. 换言之, 现在尚未找到肝脏肿瘤特异的标志物, 即在100%的肝脏肿瘤细胞中表达而在正常肝组织中完全不表达的标志物. 所以, 关键是找到一种肝脏肿瘤特异性的标志物. Mori et al[13]应用MAGE基因mRNA作为标记物检测胃肠道肿瘤患者的循环肿瘤细胞, 结果显示敏感性为1个食管癌细胞系细胞/106个PBMC, 特异性也比较高(正常人血液标本均不表达MAGE基因). 同理, 也可以用CTA基因作为肿瘤标志物检测HCC的循环肿瘤细胞. 这对于HCC的诊断、指导治疗及判断治疗效果和预后都有重要的临床意义. 我们应用RT-PCR技术对26例HCC患者外周血中SSX-2和SSX-5基因的表达进行了检测. 二者表达的阳性率分别为19.2%和23.1%, 二者同时表达为7.7%, 至少有一种表达为34.6%, 在HCC组织中未能检测到SSX-2和/或SSX-5基因的患者, 在外周血标本中也不能检测到该基因, 对照组患者(12例肝硬化和10例其他非肿瘤患者)的外周血中没有表达. 这说明这两种基因在HCC的外周血中的表达呈特异性, 所以对外周血中的SSX-2和SSX-5基因进行检测可作为HCC的一种诊断措施, 但由于其表达频率不高, 可造成一定的假阴性, 应用可能受到一定的限制. 而目前临床普遍采用的AFP检测法, 由于其在慢性活动性肝炎、肝硬化患者中也有表达, 存在一定的假阳性; 同时, 并非所有HCC患者都有AFP的表达, 有一定的假阴性, 而我们的研究结果显示, 有4例AFP正常(<20 ug/L)的患者, 其外周血可检测到SSX-2和/或SSX-5基因, 这提示当怀疑有HCC但AFP又为阴性时, 可检测外周血中的SSX-2和/或SSX-5基因, 以作为HCC的辅助诊断指标. HCC外周血中SSX-2和SSX-5基因的表达与临床指标的关系: 我们发现HCC外周血中SSX-2和SSX-5基因的表达与年龄、性别、肿瘤大小、TNM分期、血清AFP水平、肝炎病毒感染无显著相关性(P>0.05). 我们的研究结果显示, 外周血SSX-2和/或SSX-5基因表达阳性的患者, 6 mo内的复发率较高(37.5%), 但没有统计学意义, 考虑可能与标本量较少有关, 应进行大标本量的研究, 可望将SSX-2和SSX-5作为监测HCC术后复发的指标.
总之, 本实验得到了以下发现:SSX-2和SSX-5基因在肝癌组织中呈高特异、高频率表达, 在非肿瘤肝组织中不表达, 这就为HCC的特异性免疫治疗提供了新的潜在的靶位;SSX-2和SSX-5基因在部分HCC中同时表达, 为采用多价瘤苗进行HCC的特异性免疫治疗提供了实验依据; 相当一部分AFP正常(<20 mg/L)HCC患者存在SSX-2和SSX-5基因的表达, 提示也许可能将SSX-2和SSX-5基因mRNA作为肿瘤标志物肿瘤标志物来检测循环肝癌细胞, 用于HCC的辅助诊断和作为监测复发、转移和预后的指标.
编辑: 潘伯荣 审读:张海宁
| 1. | Chen CH, Chen GJ, Lee HS, Huang GT, Yang PM, Tsai LJ, Chen DS, Sheu JC. Expressions of cancer-testis antigens in human hepatocellular carcinomas. Cancer Lett. 2001;164:189-195. [PubMed] [DOI] |
| 2. | Mori M, Mimori K, Tanaka F, Ueo H, Sugimachi K, Akiyoshi T. Molecular diagnosis of circulating cancer cells using MAGE gene assays. JAMA. 1997;278:476-477. [PubMed] [DOI] |
| 3. | Ghossein RA, Scher HI, Gerald WL, Kelly WK, Curley T, Amsterdam A, Zhang ZF, Rosai J. Detection of circulating tumor cells in patients with localized and metastatic prostatic carcinoma: clinical implications. J Clin Oncol. 1995;13:1195-1200. [PubMed] [DOI] |
| 4. | Gerhard M, Juhl H, Kalthoff H, Schreiber HW, Wagener C, Neumaier M. Specific detection of carcinoembryonic antigen-expressing tumor cells in bone marrow aspirates by polymerase chain reaction. J Clin Oncol. 1994;12:725-729. [PubMed] [DOI] |
| 5. | Brossart P, Schmier JW, Kruger S, Willhauck M, Scheibenbogen C, Mohler T, Keilholz U. A polymerase chain reaction-based semiquantitative assessment of malignant melanoma cells in peripheral blood. Cancer Res. 1995;55:4065-4068. [PubMed] |
| 6. | Foss AJ, Guille MJ, Occleston NL, Hykin PG, Hungerford JL, Lightman S. The detection of melanoma cells in peripheral blood by reverse transcription-polymerase chain reaction. Br J Cancer. 1995;72:155-159. [PubMed] [DOI] |
| 7. | Naito H, Kuzumaki N, Uchino J, Kobayashi R, Shikano T, Ishikawa Y, Matsumoto S. Detection of tyrosine hydroxylase mRNA and minimal neuroblastoma cells by the reverse transcription-polymerase chain reaction. Eur J Cancer. 1991;27:762-765. [PubMed] [DOI] |
| 8. | Gunther G, Haglund M, Lindquist L, Forsgren M, Skoldenberg B. Tick-bone encephalitis in Sweden in relation to aseptic meningo-encephalitis of other etiology: a prospective study of clinical course and outcome. J Neurol. 1997;244:230-238. [PubMed] [DOI] |
| 9. | Israeli RS, Miller WH Jr, Su SL, Samadi DS, Powell CT, Heston WD, Wise GJ, Fair WR. Sensitive detection of prostate hematogenous tumor cell dissemination using prostate specific antigen and prostate specific membrane-derived primers in the polymerase chain reaction. J Urol. 1995;153:573-577. [PubMed] |
| 10. | Israeli RS, Miller WH Jr, Su SL, Powell CT, Fair WR, Samadi DS, Huryk RF, DeBlasio A, Edwards ET, Wise GJ. Sensitive nested reverse transcription polymerase chain reaction detection of circulating prostatic tumor cells: comparison of prostate-specific membrane antigen and prostate-specific antigen-based assays. Cancer Res. 1994;54:6306-6310. [PubMed] |
| 11. | Kruger WH, Stockschlader M, Hennings S, Aschenbrenner M, Gruber M, Gutensohn K, Loliger C, Gieseking F, Jonat W, Zander AR. Detection of cancer cells in peripheral blood stem cells of women with breast cancer by RT-PCR and cell culture. Bone Marrow Transplant. 1996;18:S18-20. [PubMed] |
| 12. | Mori M, Mimori K, Inoue H, Barnard GF, Tsuji K, Nanbara S, Ueo H, Akiyoshi T. Detection of cancer micrometastases in lymph nodes by reverse transcriptase-polymerase chain reaction. Cancer Res. 1995;55:3417-3420. [PubMed] |
| 13. | Mori M, Mimori K, Ueo H, Karimine N, Barnard GF, Sugimachi K, Akiyoshi T. Molecular etection of circulating solid carcinoma cells in the peripheral blood: the concept of early systemic disease. Int J Cancerr. 1996;68:739-743. [PubMed] [DOI] |