修回日期: 2005-04-07
接受日期: 2005-04-09
在线出版日期: 2005-07-28
目的: 通过Maxizyme 胞外、胞内及整体水平对肝癌突变抑癌基因p53的抑制作用, 为肝癌的基因治疗探索一条新途径.
方法: 应用计算机设计针对人肝癌突变抑癌基因p53(mtp53)249位密码子的Maxizyme(Mz)和对照大酶asMz, 应用分子克隆技术构建核酶的细胞外转录载体和真核表达载体. 应用RiboMAXTM large Scale RNA production systems胞外转录出核酶和靶基因, 进行细胞外切割反应, 检测大酶对mtp53的切割作用, 同时检测对野生型p53(wtp53)是否具有切割作用. 在脂质体 LipofectamineTM2000的介导下稳定转染含有突变型p53, 且突变位点在249位密码子的人肝癌细胞MHCC97, 应用Northern Blot,Western Blot等方法检测大酶在细胞内的表达及对肝癌细胞mtp53的抑制作用. 建立人肝癌裸鼠皮下移植瘤模型, 将荷瘤裸鼠随机分为空白对照组、空载体组和基因治疗组. 观察肿瘤生长情况并记录动物死亡时间, 绘制肿瘤生长曲线和生存期图. RT-PCR检测mtp53mRNA表达水平的变化.
结果: 成功构建核酶基因并将其正确克隆入细胞外转录载体pBSKU6和真核载体pEGFPC1中. Mz在细胞外具有良好的切割靶基因mtp53活性, 切割效率为49%, 而对野生型p53无切割作用, asMz对突变型p53及野生型p53均无明显切割作用. 在脂质体LipofectAMINETM2000的介导下成功转染肝癌细胞MHCC97, 嵌于U6表达系统中的Mz在细胞内高效表达. Northern Blot检测证实pEGFPMz组mtp53的mRNA水平明显下调, Mz在细胞内的切割效率为65%. Western Blot结果提示基因治疗组mtp53的蛋白表达明显下降, 切割效率为67%. 动物试验证实Mz可减慢裸鼠肿瘤生长速度,Mz治疗组荷瘤鼠生存期明显延长. PT-PCR检测到Mz治疗组裸鼠肿瘤组织mtp53的mRNA水平明显下调(mtp53 mRNA: 0.95±0.13 vs 1.44±0.14, 1.47±0.12; P<0.05).
结论: Mz可有效切割mtp53, 抑制其mRNA和蛋白质的表达, 有效抑制肝癌细胞的生长.
引文著录: 李岩, 林菊生, 孔心涓. Maxizyme对肝癌突变抑癌基因p53的抑制作用. 世界华人消化杂志 2005; 13(14): 1658-1662
Revised: April 7, 2005
Accepted: April 9, 2005
Published online: July 28, 2005
AIM: To investigate the inhibitory effect of maxizyme on the mutant-type p53 (mtp53) gene at codon 249 in exon 7 (AGG→AGT) in cell-free system, hepatocellular carcinoma (HCC) cell line MHCC97, and nude mice bearing human HCC, and to explore a new method for gene therapy of HCC.
METHODS: Anti-mtp53 and control mutant maxizyme were designed and then cloned into the vector pBSKU6 and pEGFPC1, respectively. The 32p-labeled mtp53 transcript was the target mRNA. Cold maxizyme transcript was incubated with 32p-labeled target RNA in cell-free system. The products were quantified by measuring the radioautographed count per minute (cpm) in 1 mL solution. The MHCC97 cells were the target cells which contained a mutation at the third-base position of codon 249 of the p53 gene(AGG→AGT). PEGFPMz (recombinant eukaryotic vector) was transfected into MHCC97 cells by LipofectamineTM2000. The expression of mtp53 was analyzed by Northern Blot and Western Blot. The nude mice bearing human liver cancer were prepared and divided into blank control pEGFP and pEGFPMz group. The growth curve of the tumor in mice and the survival rate of mice were observed. The expression of mtp53 mRNA were detected by reverse transcription polymerase chain reaction (PT-PCR).
RESULTS: The established pEGFPMz had the correct structure. Maxizyme had a specific cleavage activity for mtp53 with a cleavage efficiency of 49% extracellularly, while the wild type p53 was not cleaved. The control maxizyme had no significant effect on both mutant and wile type p53. After pEGFPMz were transfected into MHCC97 cells, the expression of mtp53 mRNA and protein in pEGFPMz group were 65% and 67% respectively, which were significantly lower than those in blank control and pEGFP group (P<0.05). The tumor size decreased and mtp53 mRNA was down-regulated in mice treated with pEGFPMz as compared with those in mice of blank control and pEGFP group (mtp53 mRNA: 0.95±0.13 vs 1.44±0.14, 1.47±0.12; P<0.05), and also the survivals of the mice in pEGFPMz were improved.
CONCLUSION: Maxizyme can effectively inhibit the expression of mtp53 mRNA and protein as well as the growth of hepatocellular carcinoma cells.
- Citation: Li Y, Lin JS, Kong XJ. Inhibitory effect of maxizyme on mutant-type p53 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(14): 1658-1662
- URL: https://www.wjgnet.com/1009-3079/full/v13/i14/1658.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i14.1658
p53基因是人类恶性肿瘤中发生变异频率最高的抑癌基因. 其异常表达和很多肿瘤的发生发展密切相关[1-6]. 突变是p53失活的主要形式, 肝癌中p53的突变率高达60%, 且突变热点集中在249位密码子(AGG-AGT)[7-10]. 突变型p53具有癌基因特性且稳定性增高, 降低肿瘤对放化疗药物的敏感性. Maxizyme是由锤头状核酶(Hammerhead ribozyme)演变而来的, Maxizyme的发现弥补了锤头状核酶对切割位点的限制. 我们应用计算机设计了针对突变型p53的Maxizyme, 构建其体外转录载体和真核表达载体, 检测其在胞外、胞内和整体水平对mtp53的抑制作用, 为肝癌的基因治疗提供了一条新途径.
含wtp53和mtp53基因全长的质粒pCMV-neo-BAM载体由美国Huward Hughs Medical Institude 的Bert Vogelstein教授惠赠, pBSKU6和pEGFPC1载体由上海中国科学院生物化学研究所金由辛研究员惠赠, 人肝癌细胞系MHCC97购自复旦大学医学院肝癌研究所, Balb/c裸鼠购自华中科技大学同济医院器官移植研究所, 大肠杆菌DH5a本室保存, 小剂量胶回收试剂盒购自上海华舜生物工程有限公司, 各种限制性内切酶、DNA连接酶、DL2000 Marker、PCR试剂、PT-PCR kit均为日本Takara公司产品, pGEM-T vector, X-gal, IPTG, Trizol试剂和RiboMAX TM large Scale RNA production systems为美国Promega公司产品, Lipofectamine TM2000 Reagent为Invitrogen公司产品, 胎牛血清为Hyclone公司产品, DMEM培养基为Gibco公司产品.
应用中国科学院上海生物化学研究所陈农安教授编写的软件设计Mz的基因片断. Mz由两个单体组成Mz right(MzR)与Mz left(MzL), 序列如下: MzL: 5'CTAGAGAGGATGGCTGATGAGCGAAAGGTATGG3'; 5'GATCCCAGACCTTTGGCTCATCAGCCATCCTCT3'. MzR: 5'CTAGAAGTTTCCACTGATGAGCGAAACTCCGGG3'; 5'GATCCCCGGAGTTTCGCTCATCAGTGGAAACTT3'. 同时设计突变的Mz(asMz, G5→A5)以排除反义序列互补作用. Mz的两边设计XbaⅠ和BamHⅠ酶切位点, 便于克隆操作, 用中国科学院生物化学研究所美国产Beckman Oligo 1000 M DNA/RNA自动合成仪合成. 应用分子克隆技术构建出体外转录载体pBSKU6Mz和真核表达载体pEGFPMz, DNA测序仪分析所合成的序列, 酶切鉴定. 应用PCR技术从质粒pCMV-neo-BAM中扩增出野生型(wild type p53, wtp53)和mtp53片断(1 002 nt), PCR产物纯化回收后, 与pGEM-T载体连接, 经DNA测序证实, 分别命名为pwtp53和pmtp53. PCR上游引物: 5'GATTCTCTTCCTCTGTGC3', 下游引物:5'CTTTCCACGACGGTGACA3'.pwtp53和pmtp53经SacⅠ线形化, Mz经SmaⅠ线形化, 体外转录, 纯化, 放射自显影. [a-32P]dUTP标记的大酶、对照大酶和靶RNA水溶液各取1 mL, 测每分钟计数(cpm). 按同位素的比放及底物和Mz中U的含量进行定量, 切割率(CE)通过底物(S)与产物(P)放射性条带的放射强度(cpm)求得: CE = [P/(S+P)]×100%. 人MHCC97肝癌细胞株培养在含100 mL/L胎牛血清的DMEM培养基中, 置37 ℃, 50 mL/L的CO2培养箱, 待细胞长至对数生长期, 按每孔4×104接种至24孔细胞培养板上, G418筛选(200 mg/L), 应用Invitrogen公司的Lipofect amine TM 2000转染试剂盒进行转染, 按操作说明书进行. 筛选15 d后, 挑选单克隆细胞扩大培养.
1.2.1 Western blot分析p53蛋白表达水平: 分别收集转染pEGFPMz、空载体pEGFP和未转染任何质粒的肝癌细胞MHCC97(1×107个), 收集被无盐裂解液裂解的细胞裂解物, 常规制胶, 每样品15mL, Marker上样15 mL, 1×SDS电泳缓冲液, 恒压200 V, 40 min. 用转移缓冲液平衡凝胶和醋酸纤维素滤膜PVDF 30 min, 4 ℃湿度电转仪30 mA转移过夜. PVDF膜浸泡在50 g/L脱脂奶粉TBS溶液中, 室温封闭30 min, 洗涤液中洗涤30 min, 加入10 mL 10 g/L脱脂奶粉(含0.5 g/L Tween20), 加入5 mL一抗(抗p53抗体), 室温摇动1 h, 然后20 mL 10 g/L脱脂奶粉洗4次, 将PVDF膜与辣根过氧化物酶标记的第二抗体共同温浴60 min. 将膜放至等体积配置的检测试剂中孵育1 min, Saran包装膜包裹, X光片曝光并显像. 将膜用PBS洗涤两次, 然后用 β-actin抗体进行检测, 方法同上.
1.2.2 Northern blot分析mtp53 mRNA的表达: 应用Promega公司的探针标记试剂盒Prime-a-Gene Labeling System, 将p53PCR和β-actinPCR片断进行探针同位素标记. DNA片断沸水2 min, 速至冰上. Labeling 5×buffer 1 mL, Mixture of unlabeled dNTPs 1 mL, DNA template 5 ng, Nuclease-free BSA 1 mL, [a-32P]dATP 1 mL(3 000 Ci/mmol), Klenow fragment 1 mL(5 U), 总体积10 mL混匀, 室温60 min, 95 ℃ 2 min, 溶于EDTA, 终浓度20 mmol/L. 收集转染pEGFPMz、空载体pEGFP和未转染任何质粒的肝癌细胞MHCC97(1×107个), Trizol试剂盒提细胞内总RNA. 样品制备:RNA(20 mg, 5.5 mL), 10×MOPS 1 mL, 甲醛3.5 mL, 甲酰胺10 mL, 总体积20 mL, 65 ℃, 温育15min, 冰浴冷却. 电泳, 印迹转移过夜, 封闭非特异性结合位点后, 65 ℃杂交过夜, X片曝光.
1.2.3 动物试验4-5周龄Balb/c-nu裸鼠24只, 雌雄各半, 体重13.5±1.5 g. 收获处于对数生长期的MHCC97细胞, 按每只裸鼠1×107个(0.2 mL)接种于其颈背部皮下, 16 d左右均出现瘤结节, 成瘤率100%. 待肿瘤长径达0.4±0.05 cm时, 随机分为3组, 每组8只. 1组为生理盐水对照组, 瘤体内多点注射150 mL生理盐水;2组为pEGFP对照组, 瘤体内多点注射50 mg空质粒载体(50 mgpEGFP+30 mL Lipofectamine TM 2 000+120 mL无血清培养基); 3组为pEGFPMz治疗组, 瘤体内多点注射50 mg pEGFPMz(50 mg pEGFPMz+30 mL Lipofect amine TM 2 000+120 mL无血清培养基). 隔天注射1次, 共注射5次. 每两天用游标卡尺(精确到0.02 mm)测肿瘤体积(V = AxB2/2, A为肿瘤最长径, B为肿瘤最短径), 观察并记录动物死亡时间, 当有裸鼠死亡时, 将其取瘤称重. 50 d后将未死亡动物全部处死, 取瘤称重, 绘制裸鼠皮下移植瘤平均生长曲线, Kaplan-Meier方法进行生存期分析. 取0.1 cm3肿瘤组织做PT-PCR检测, 具体如下:p53引物序列同上, β-actin mRNA作为内部参照物, 引物序列: 上游引物: 5'CTCGCTCTCGCTCTTTTTT 3';下游引物: 5'GCGGTGGTGGCGCGTCGCGCCGCT 3'. RT反应: 总RNA 2 mg, 5×buffer 6 mL, dNTPmixture(10 mmol/L)1 mL, RNase inhibitor(40 MU/L)1 mL, Oligo dT primer(20 mmol/L)1 mL, M-MLV(200 MU/L)1 mL, 3d H2O10 mL, 总体积为20 mL, 混匀, 42 ℃逆转录1 h, 95 ℃灭活5 min. 取上述反应产物5mL, 5×PCR buffer 10 mL, dNTPmixture(10 mmol/L)8 mL, 引物各5 mL, Taq 1 mL, 56 mL 3 d H2O, 总体积为100 mL, 94 ℃变性30 s, 54 ℃退火30 s, 72 ℃ 1 min, 31个循环, 72 ℃ 10 min. 反应结束后, 取产物8 mL, 10 g/L琼脂糖凝胶电泳分析结果, 应用凝胶成像分析系统, 分析每个条带(lanes)的定积分值和所占的百分比, 并和β-actin比较, 计算核酶的切割效率.
统计学处理 以上检测试验均重复3次. 采用SPSS10.0统计学分析软件, 采用Kaplan-Meier法进行分析并绘制生存曲线. P<0.05具有统计学意义.
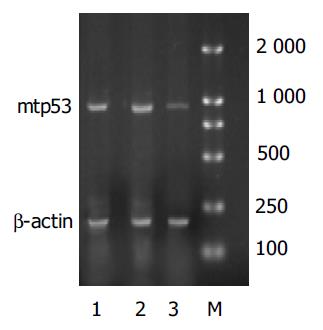
用SmaⅠ和SacⅠ双酶切载体pEGFPMz, 10 g/L琼脂糖鉴定应有920 bp的片段, 与设计完全一致. 细胞外切割反应显示pEGFPMz对pmt53切割条带为874 nt和128 nt, pwt53未被切割, 体外切割效率为49%, pEGFPasMz对pmt53及pwt53均未见明显切割条带, 和预期结果一致. 说明我们设计的大酶对突变型p53具有特异性的高效切割作用. Western blot分析结果提示, 转染pEGFP-Mz肝癌细胞MHCC97的p53(53 kDa)蛋白表达下降明显, 为67%. 而转染空质粒组和空白对照组的mtp53的蛋白表达没有明显变化(P<0.05), 提示Mz能够特异性切割靶基因mtp53, 促进p53蛋白表达水平下降(图1).
β-actin条带的亮度一致, 表明总RNA的量是一致的. 转染pEGFP-Mz的肝癌细胞MHCC97的p53 mRNA下降明显, 为65%, 而转染pEGFP和空白对照的细胞无下降(P<0.05), 证实Mz能够使mtp53 mRNA表达水平下降, 对靶基因mtp53具有特异性地切割作用(图2).
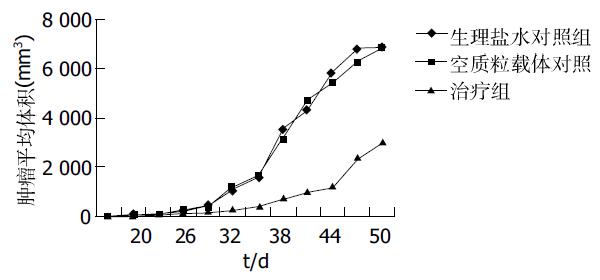
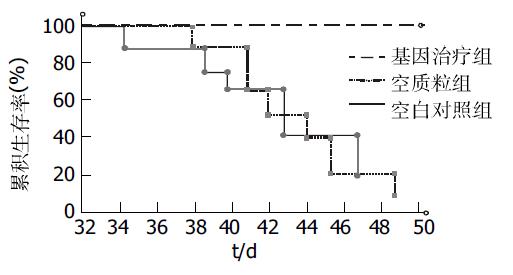
RT-PCR检测图像分析仪扫描mtp53和β-actin条带的灰度, 计算出pEGFP-Mz组mtp53/β-actin为0.95±0.13, pEGFP组为1.47±0.12, 空白对照组为1.44±0.14.pEGFP-Mz组mtp53表达明显减弱, 与转染空载体组及空白对照组比较mtp53的水平有显著性差异(P<0.05). 而转染空载体组及空白对照组比较mtp53的水平无明显差异(P>0.05, 图3). 皮下移植瘤平均生长曲线显示Mz基因治疗组生长速度明显较空白对照组和空载体组减慢, SAS软件进行t检验, 证实差异有显著性意义(P<0.05). 而空载体组和空白对照组肿瘤生长速度无明显差异(P>0.05). 实验结果提示Mz具有显著抑制裸鼠移植瘤生长的作用(图4). 应用SPSS10.0统计学分析软件, 采用Kaplan-Meier法进行荷瘤裸鼠生存期的分析, 绘制图表, 显示基因治疗组裸鼠与空载体组和空白对照组相比, 具有明显延长裸鼠生存期的作用(P<0.05). 而裸鼠生存期在空载体组和空白对照组中无显著差异(P>0.05, 图5).
现代医学认为, 肿瘤是多种基因突变引起的复合基因病(complex genetic disease), 旨在封闭突变基因表达或抑制其功能的基因疗法成为近年肿瘤研究领域的热点. 而核酶(Ribozyme)是其中极富挑战性的课题, 核酶是一类具有催化作用的RNA分子, 又称催化RNA(catalytic RNA)[11-15], 和反义寡核苷酸相比, 核酶用于基因治疗有很大的优势, 被称为"分子剪刀"和"分子外科", 在抗HIV、抗病毒、治疗白血病、抗多药耐药(multidrug resistance, MDR)及肿瘤方面得到广泛的研究[16-19]. 锤头状核酶(Hammerhead ribozyme, Rz)因其结构简单、易于设计而得到广泛的应用[20-25]. 用短链核苷酸替代茎Ⅱ即变短的核酶仍保持一定的切割活性称为minizyme[26-28].Minizyme可以形成二聚体结构, 形成二聚体后切割活性明显增强, 此二聚体命名为Maxizyme[29-31].Maxizyme的发现弥补了锤头状核酶对切割位点严格限制的不足. 自Maxizyme发现以来主要用于嵌合基因或突变基因所致疾病的治疗, 例如导致慢性粒细胞性白血病(CML)的融合基因BCR-ABL, 显示出良好的应用前景.
原发性肝细胞癌(hepatocellular carcinoma, HCC)的发生存在着多种病因与多种机制, 这些因素在HCC的发生中起着协同作用, 但无论何种原因, HCC的发生均与癌基因的激活和(或)抑癌基因的失活有关. 在肝癌发生发展中抑癌基因的突变占有重要地位. 抑癌基因中研究最多的是p53基因, p53基因定位于17号染色体短臂. 野生性p53(wild type p53, wtp53)基因监视着基因组的完整性, 有利于细胞启动修复机制, 可诱导细胞凋亡, 抑制肿瘤的形成. p53突变导致与DNA结合力改变, 使p53依赖性反式激活作用下降. 突变型p53(mutant type p53, mtp53)基因具有癌基因特性且稳定性增高, 导致细胞转化和过度增生, 同时降低肿瘤对化疗药物的敏感性. 肝癌中p53的突变率达60%, 且突变多发生于249位密码子(G:T颠换). 针对抑癌基因p53的突变, 国内外研究主要是借助基因转移技术恢复或添加肿瘤细胞中失活的p53, 从而对肿瘤产生一定的治疗作用或抑制肿瘤转移. 但这种方法不能调节抑癌基因的表达水平, 亦不能减少突变基因的表达, 限制了临床应用的前景. 本实验应用新的基因阻断技术-maxizyme, 设计了针对肝癌突变抑癌基因p53的maxizyme, 可在249位密码子处切断mtp53mRNA, 从而阻断其表达, 对mtp53具有抑制作用. 实验结果表明我们设计的maxizyme不仅在细胞外对突变型p53具有特异性的高效切割作用, 而且在细胞内同样能够特异性切割靶基因mtp53, 促进p53蛋白表达水平(Western blot)和mRNA水平(Northern blot)下降. 在整体水平上, maxizyme也可明显抑制裸鼠移植瘤的生长, 延长荷瘤裸鼠生存期. 本实验证实了我们设计的maxizyme对肝癌突变抑癌基因p53在胞外、胞内和整体水平的显著抑制作用, 为肝癌的治疗提供了一条新的途径.
编辑: 潘伯荣 审读:张海宁
| 1. | Liang Y, Wu J, Stancel GM, Hyder SM. p53-dependent inhibition of progestin-induced VEGF expression in human breast cancer cells. J Steroid Biochem Mol Biol. 2005;93:173-182. [PubMed] [DOI] |
| 2. | Du CH, Xu J, Zhong NS. Roles of mutant p53 gene in malignant phenotypes and resistance to drugs in anti-7, 8-dihydrodiol-9, 10-epoxide benzo(a)pyrene-induced lung cancer cells. Zhonghua Jiehe He Huxi Zazhi. 2005;28:176-179. [PubMed] |
| 3. | Hu W, Kavanagh JJ, Deaver M, Johnston DA. Frequent overexpression of STK15/Aurora-A/BTAK and chromosomal instability in tumorigenic cell cultures derived from human ovarian cancer. Oncol Res. 2005;15:49-57. [PubMed] |
| 4. | Flores ER, Sengupta S, Miller JB. Tumor predisposition in mice mutant for p63 and p73: evidence for broader tumor suppressor functions for the p53 family. Cancer Cell. 2005;7:363-373. [PubMed] [DOI] |
| 5. | Yao R, Wang Y, D'Agostini F, Izzotti A. K-ras mutations in lung tumors from p53 mutant mice exposed to cigarette smoke. Exp Lung Res. 2005;31:271-281. [PubMed] [DOI] |
| 6. | Kim EL, Yoshizato K, Kluwe L, Meissner H. Comparative assessment of the functional p53 status in glioma cells. Anticancer Res. 2005;25:213-224. [PubMed] |
| 7. | Lee YI, Han YJ, Lee SY, Lee YI. Activation of insulin-like growth factor II signaling by mutant type p53: physiological implications for potentiation of IGF-II signaling by p53 mutant 249. Mol Cell Endocrinol. 2003;203:51-63. [PubMed] [DOI] |
| 8. | Staib F, Hussain SP, Hofseth LJ, Wang XW, Harris CC. TP53 and liver carcinogenesis. Hum Mutat. 2003;21:201-216. [PubMed] [DOI] |
| 9. | Jin Y, Abe K, Sato Y, Aita K, Irie H, Shiga J. Hepatitis B and C virus infection and p53 mutations in human hepatocellular carcinoma in Harbin, Heilongjiang Province, China. Hepatol Res. 2002;24:379-384. [PubMed] [DOI] |
| 10. | Qian GS, Kuang SY, He X, Groopman JD. Sensitivity of electrospray ionization mass spectrometry detection of codon 249 mutations in the p53 gene compared with RFLP. Cancer Epidemiol Biomarkers Prev. 2002;11:1126-1129. [PubMed] |
| 11. | Hayashidani Y, Hiyama E, Murakami Y, Sueda T. Attenuation of telomerase activity by hammerhead ribozymes targeting human telomerase RNA and telomerase reverse transcriptase in pancreatic carcinoma cells. Hiroshima J Med Sci. 2005;54:21-27. [PubMed] |
| 12. | Callison SA, Hilt DA, Jackwood MW. In vitro analysis of a hammerhead ribozyme targeted to infectious bronchitis virus nucleocapsid mRNA. Avian Dis. 2005;49:159-163. [PubMed] [DOI] |
| 13. | Willkomm DK, Minnerup J, Huttenhofer A, Hartmann RK. Experimental RNomics in Aquifex aeolicus: identification of small non-coding RNAs and the putative 6S RNA homolog. Nucleic Acids Res. 2005;33:1949-1960. [PubMed] [DOI] |
| 14. | Pljevaljcic G, Klostermeier D, Millar DP. The tertiary structure of the hairpin ribozyme is formed through a slow conformational search. Biochemistry. 2005;44:4870-4876. [PubMed] [DOI] |
| 15. | Pasquali S, Gan HH, Schlick T. Modular RNA architecture revealed by computational analysis of existing pseudoknots and ribosomal RNAs. Nucleic Acids Res. 2005;33:1384-1398. [PubMed] [DOI] |
| 16. | Trang P, Kilani A, Lee J, Hsu A, Liou K, Kim J, Nassi A, Kim K, Liu F. RNase P ribozymes for the studies and treatment of human cytomegalovirus infections. J Clin Virol. 2002;2:63. [PubMed] [DOI] |
| 17. | Xu RH, Lin J, Zhou XQ, Xie Q, Jin YX, Yu H, Liao D. Activity identification of anti-caspase-3 mRNA hammerhead ribozyme in both cell-free condition and BRL-3A cells. Chin Med J (Engl). 2001;114:606-611. |
| 18. | Bergeron LJ, Perreault JP. Development and comparison of procedures for the selection of delta ribozyme cleavage sites within the hepatitis B virus. Nucleic Acids Res. 2002;30:4682-4691. [PubMed] [DOI] |
| 19. | Chang Z, Westaway S, Li S, Zaia J, Rossi J, Scherer L. Enhanced Expression and HIV-1 Inhibition of Chimeric tRNA (Lys3)-Ribozymes under Dual U6 snRNA and tRNA Promoters. Mol Ther. 2002;6:481. [PubMed] [DOI] |
| 20. | Okunaga T, Abe Y, Tsuchide T, Hatanaka H, Oshika Y, Tomisawa M, Yoshimura M, Ohnishi Y, Kijima H, Yamazaki H. Ribozyme mediated cleavage of cell-associated isoform of vascular endothelial growth factor inhibits liver metastasis of a pancreatic cancer cell line. Int J Oncol. 2002;21:1027-1032. [PubMed] |
| 21. | Huesker M, Folmer Y, Schneider M, Fulda C, Blum HE, Hafkemeyer P. Reversal of drug resistance of hepatocellular carcinoma cells by adenoviral delivery of anti-MDR1 ribozymes. Hepatology. 2002;36:874-884. [PubMed] [DOI] |
| 22. | Wang CH, Tsai LJ, Tsao YP, Hsieh JH, Chien WW, Liao CL, Wang HW, Liu HS, Chen SL. Recombinant adenovirus encoding H-ras ribozyme induces apoptosis in laryngeal cancer cells through caspase-and mitochondria-dependent pathways. Biochem Biophys Res Commun. 2002;298:805-814. [PubMed] [DOI] |
| 23. | Banerjea A, Li MJ, Remling L, Rossi J, Akkina R. Lentiviral transduction of Tar Decoy and CCR5 ribozyme into CD34+ progenitor cells and derivation of HIV-1 resistant T cells and macrophages. AIDS Res Ther. 2004;1:2. [PubMed] [DOI] |
| 24. | Nahreini P, Hanson AJ, Andreatta CP, Koustas WT, Prasad KN. Altering cellular signaling pathways enhance gene silencing activity of shRNA, shRNA. ribozyme, and shRNA. antisense in neuroblastoma cells. Cell Mol Neurobiol. 2004;24:781-792. [PubMed] [DOI] |
| 25. | Goila R, Banerjea AC. Sequence-specific cleavage of hepatitis X RNA in cis and trans by novel monotarget and multitarget hammerhead motif-containing ribozymes. Oligonucleotides. 2004;14:249-262. [PubMed] [DOI] |
| 26. | Tan TM, Zhou L, Houssais S, Seet BL, Jaenicke S, Peter F, Lim SG. Intracellular inhibition of hepatitis B virus S gene expression by chimeric DNA-RNA phosphorothioate minimized ribozyme. Antisense Nucleic Acid Drug Dev. 2002;12:257-264. [PubMed] [DOI] |
| 27. | McCall MJ, Hendry P, Mir AA, Conaty J, Brown G, Lockett TJ. Small, efficient hammerhead ribozymes. Mol Biotechnol. 2000;14:5-17. [PubMed] [DOI] |
| 28. | Kuwabara T, Warashina M, Orita M, Koseki S, Ohkawa J, Taira K. Formation of a catalytically active dimer by tRNA (Val)-driven short ribozymes. Nat Biotechnol. 1998;16:961-965. [PubMed] [DOI] |
| 29. | Soda Y, Tani K, Bai Y, Saiki M. A novel maxizyme vector targeting a bcr-abl fusion gene induced specific cell death in Philadelphia chromosome-positive acute lymphoblastic leukemia. Blood. 2004;104:356-363. [PubMed] [DOI] |
| 30. | Iyo M, Kawasaki H, Taira K. Maxizyme technology. Methods Mol Biol. 2004;252:257-265. [PubMed] [DOI] |
| 31. | Oshima K, Kawasaki H, Soda Y, Tani K, Asano S, Taira K. Maxizymes and small hairpin-type RNAs that are driven by a tRNA promoter specifically cleave a chimeric gene associated with leukemia in vitro and in vivo. Cancer Res. 2003;63:6809-6814. [PubMed] |