修回日期: 2005-05-07
接受日期: 2005-05-14
在线出版日期: 2005-07-15
目的: 比较不同大肠癌细胞Fas受体及其下游通路抑制因子FLIP的表达差异, 探讨Fas、FLIP对大肠癌细胞凋亡的影响.
方法: 体外培养大肠癌细胞, 应用直接免疫荧光流式细胞术检测细胞表面Fas表达率, 半定量RT-PCR法测定FLIP mRNA的水平, 并采用Annexin V法评价细胞对Fas介导的凋亡的敏感性.
结果: 大肠癌细胞表面Fas表达率不同, 其中HT-29细胞的表达率为42.46±4.32%, 明显高于其他3株细胞.SW620和HT-29细胞FLIP mRNA含量较高, Colo205居中, Lovo则呈阴性; 且相对于任何一株FLIP表达阳性的细胞, FLIPL的表达水平均高于FLIPS.给予凋亡诱导型抗Fas抗体(CH-11)刺激后, 4株大肠癌细胞凋亡敏感性均较低.
结论: 不同的大肠癌细胞株可能通过不同途径逃避Fas介导的凋亡, 其中包括下调Fas的表达和上调FLIP的含量.
引文著录: 臧凤琳, 魏熙胤, 史玉荣, 张霖, 赵秀兰, 张诗武, 孙保存. Fas死亡受体及FLIP对大肠癌细胞凋亡的影响. 世界华人消化杂志 2005; 13(13): 1590-1592
Revised: May 7, 2005
Accepted: May 14, 2005
Published online: July 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1590-1592
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1590.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1590
大肠癌是胃肠道最常见的恶性肿瘤之一, 其作为黏膜相关淋巴组织, 细胞表面重要的凋亡受体Fas表达率与凋亡敏感性不一致的现象一直吸引人们的关注[1].近年来, 在某些人类恶性肿瘤如恶性黑色素瘤、部分恶性淋巴瘤和白血病、卡波氏肉瘤等的胞质中相继分离出一种重要的凋亡相关蛋白, 即FLIP(FADD-like IL-1βconverting enzyme inhibitory protein)[2].由于该蛋白与凋亡关键因子Caspase-8在结构上有相似性, 推测其可能在Fas等受体介导的凋亡途径中起到十分重要的作用.FLIP在蛋白水平上有长型FLIP(FLIPL)和短型FLIP(FLIPS)2种形式, 均能抑制Caspase-8与FADD(Fas-associated death domain)的结合, 进而阻断Fas介导的细胞凋亡[3].本研究以体外培养的大肠癌细胞株为实验对象, 通过检测细胞表面Fas的表达率和胞内FLIP mRNA的水平, 进一步分析大肠癌细胞凋亡敏感性差异的具体机制.
FITC标记鼠抗人Fas单抗(UB2)、凋亡诱导型鼠抗人Fas单抗(CH-11)、Annexin V-FITC凋亡检测试剂盒购自Beckman Coulter公司, ImProm-ⅡTM反转录酶购自Promega公司, 其余RT-PCR试剂购自TaKaRa公司; 流式细胞仪(Beckman Coulter公司EPICS-XL型), PCR仪(Perkin Elemer GeneAmp PCR System 9700型), 凝胶成像分析仪(Kodak 440CF型).
1.2.1 细胞培养: 大肠癌细胞株Lovo、HT-29、Colo205由天津肿瘤医院中心实验室保存, SW620由Joe O'Connell教授惠赠.细胞置于含100 nmol/L胎牛血清(Hyclone公司)和青霉素100 kU/L、链霉素100 mg/L的RPMI 1640培养液(Gibco公司)中, 培养箱内含50 mL/L CO2, 温度37℃.
1.2.2 直接免疫荧光流式细胞术: 细胞经消化液(2.5 g/L胰蛋白酶+0.2 g/L EDTA)作用后, PBS洗涤2次, 取5×105细胞重悬于100 μL PBS, 实验管加入20 μL FITC标记的抗Fas抗体(UB2, 10 mg/L), 对照管加入等体积FITC标记的同型相配抗体, 室温避光孵育20 min.细胞悬液经流式细胞仪检测, 并以Coulter XL System Ⅱ TM软件分析荧光阳性细胞百分比.
1.2.3 半定量RT-PCR: 收集对数生长期的细胞, PBS洗涤, TRIZOL(Gibco公司)提取总RNA, 以Random 6mers为引物进行逆转录, 随后进入PCR扩增.FLIPL上游引物: 5'-ACCGAGACTACGACAGCTTTGTG-3', 下游引物: 5'-CAATGTGAAGATCCAGGAGTGGG-3', 扩增片段长429 bp; FLIPS上游引物: 5'-ACCTTGTGGTTGAGTTGGAGAAAC-3', 下游引物: 5'-ACAATTTCCAAGAATTTTCAGATCAG- 3', 扩增片段长259 bp[3]; 内参照β-actin上游引物: 5'-ATCATGTTTGAGACCTTCAACA-3', 下游引物: 5'-CATCTCTTGCTCGAAGTCCA-3', 扩增片段长318 bp.PCR反应条件: 94℃预变性3 min; 94℃变性45 s, 65℃退火45 s(其中FLIPS的最佳退火温度为60℃), 72℃延伸2 min, 共35个循环, 最后72℃延伸7 min.产物在13 g/L 琼脂糖凝胶上电泳, 经凝胶成像系统进行半定量比较, 计算扩增片段的相对含量.扩增片段相对含量(%) = 扩增片段Net.Int./β-actin Net.Int.×100%.
1.2.4 Annexin V-FITC染色法: 以凋亡诱导型鼠抗人Fas单抗(CH-11, 0.1 mg/L)刺激细胞, 孵箱培养16 h, 收集细胞, 调整密度至5×105/管, PBS洗涤2次, 重悬于100 μL反应缓冲液, 加入5 μL Annexin V-FITC(5 mg/L)和2.5 μL PI(250 mg/L), 冰上避光孵育10 min, 流式细胞仪检测.凋亡敏感性(%) = 刺激后细胞凋亡率(%)-刺激前细胞凋亡率(%).
统计学处理 采用SPSS 10.0软件系统处理, 各组间差异比较为单因素方差分析, P<0.05为有统计学意义.
经流式细胞仪多次测定比较发现, 4种大肠癌细胞株之间Fas的表达水平差异显著(F = 297.808, P<0.01), HT-29、Colo205高于SW620、Lovo, 其中HT-29的Fas表达水平远远高于其他3种大肠癌细胞株, 而SW620、Lovo则呈低水平表达(表1).
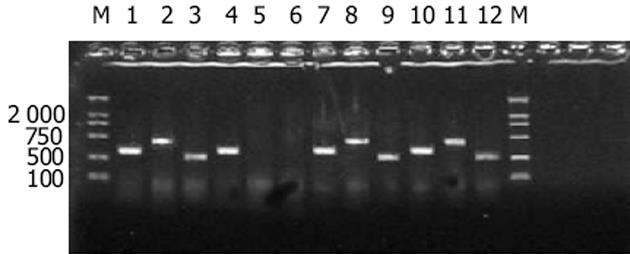
半定量RT-PCR检测结果显示, 2种形式的FLIP(FLIPL和FLIPS)在不同大肠癌细胞株中表达水平明显不同(F = 849.513 P<0.01; F = 143.571 P<0.01).SW620和HT-29的表达水平较高, Colo205的表达水平居中, 而Lovo则几乎不表达任何形式的FLIP.且相对于任何一个FLIP表达阳性的细胞, 均存在着FLIPL的表达水平明显高于FLIPS的现象(图1, 表2).
| 细胞类型 | n | FLIPL | FLIPS |
| SW620 | 4 | 85.64±3.94 | 30.43±4.79 |
| HT-29 | 4 | 83.36±3.44 | 36.30±3.44 |
| Colo205 | 4 | 61.64±1.63 | 17.15±1.61 |
| Lovo | 4 | 0.00±0.00 | 0.00±0.00 |
大肠癌作为严重威胁人类健康的恶性肿瘤, 早期便易出现侵袭和转移, 且不同患者对诱导凋亡化疗药的敏感性也不尽相同.其中, 肿瘤细胞对Fas介导的凋亡敏感性的变化一直吸引着人们的关注.夏成青et al[4]研究发现, 结肠腺癌组织和正常结肠黏膜组织均有不同程度的Fas表达, 但癌组织中的表达水平有所降低.且与未发生转移的癌组织相比, 发生淋巴结转移的癌组织Fas的平均阳性率更低.Fas表达水平的下调可能是肿瘤细胞对体内免疫系统及外源性刺激产生凋亡抵抗的原因之一.值得注意的是, 一方面临床上在使用了能够促进Fas表达的化疗药后, 仍有一部分大肠癌患者病情未得到明显控制; 另一方面, 在Fas高表达的组织细胞中, Fas的表达水平与其对Fas配体(FasL)诱导凋亡的敏感性也存在着不一致的现象[5-6].这提示在Fas介导的受体凋亡途径中必然存在着其他的抑制调节因子, 肿瘤细胞凋亡敏感性的下降也是不同水平综合作用的结果.
FLIP是近年来发现的一类含有DED(death effect domain)的凋亡抑制蛋白, 在病毒、真核生物、哺乳动物等许多物种中广泛存在.其在蛋白水平有2种存在形式, 即小分子的FLIPS和大分子的FLIPL, 前者在结构上只含有2个DED, 后者除此之外还含有一个Caspase同源结构域, 即Caspase蛋白水解酶区, 但该区域中具有催化活性的半胱氨酸残基被酪氨酸残基所取代[2].目前, 对于FLIP在抑制凋亡中的具体机制仍未得到阐明.比较公认的观点为: 由于FLIP在结构上与Caspase-8极为相似, 其DED也可以与FADD相结合, 竞争性抑制Caspase-8前体结合于DISC(death inducing signaling complex)上, 从而抑制凋亡[7].
在本研究中, 我们以凋亡诱导型抗Fas抗体体外刺激大肠癌细胞株, 经检测发现4株细胞对Fas介导的凋亡均不敏感.进一步研究发现, 4种细胞株之间Fas表达率及FLIP mRNA水平也不尽相同.其中, 除HT-29具有一定程度的Fas表达外, 其余3株细胞的Fas表达率均较低, 与先前的报道基本一致[8]; 而SW620、HT-29的FLIP mRNA含量较高, Colo205居中, Lovo则几乎呈阴性.这说明, 不同的大肠癌细胞可能存在不同的凋亡抵抗机制: SW620和Colo205很可能通过下调Fas和上调FLIP 2种方式来降低凋亡敏感性; 而对于HT-29来说, FLIP的高水平表达可能起到更为重要的作用; 至于Lovo, 由于二者的低表达, 以及Fas/FasL表达率与凋亡率之间无明显关联, 提示其很可能不是通过Fas通路发生凋亡的[9].Nita et al[10]发现与其他大肠癌细胞相比, Lovo高表达Bcl-2和Bcl-XL, 且伴随着Bax的表达下降, 这提示对于Lovo来说, 线粒体凋亡途径似乎起到更为重要的作用.
此外, Krueger et al[11]发现2种形式的FLIP均可阻断Caspase-8激活的蛋白水解反应.在BJAB细胞中, 当FLIPL过表达时, Caspase-8的第一步水解作用仍可实现, 第二步酶切水解受到抑制; FLIPS过表达时, 胞质中检测不到Caspase-8任何的酶切水解成分.而在我们的实验中, 对于任何一个FLIP mRNA表达阳性的细胞, 均存在着FLIPL表达明显高于FLIPS的现象.这种mRNA水平的差异是否与蛋白水平相一致以及究竟哪一种蛋白类型起到更为重要的凋亡抑制作用仍需进一步的探讨.
编辑: 王谨晖 审读:张海宁
| 1. | von Reyher U, Strater J, Kittstein W, Gschwendt M, Krammer PH, Moller P. Colon carcinoma cells use different mechanism to escape CD95-mediated apoptosis. Cancer Res. 1998;58:526-534. [PubMed] |
| 2. | Irmler M, Thome M, Hahne M, Schneider P, Hofmann K, Steiner V, Bodmer JL, Schroter M, Burns K, Mattmann C. Inhibition of death receptor signals by cellular FLIP. Nature. 1997;388:190-195. [PubMed] [DOI] |
| 3. | Nagaraju K, Casciola-Rosen L, Rosen A, Thompson C, Loeffler L, Parker T, Danning C, Rochon PJ, Gillespie J, Plotz P. The inhibition of apoptosis in myositis and in normal muscle cells. J Immunol. 2000;164:5459-5465. [PubMed] [DOI] |
| 4. | 夏 成青, 刑 长虹, 唐 小奈. 结肠癌组织中Fas表达的定量分析. 临床与实验病理学杂志. 2002;18:307-309. |
| 6. | Klas C, Debatin KM, Jonker RR, Krammer PH. Activation interferes with the APO-1 pathway in mature human T cells. Int Immunol. 1993;5:625-630. [PubMed] [DOI] |
| 7. | Scaffidi C, Schmitz I, Krammer PH, Peter ME. The role of c-FLIP in modulation of CD95-induced apoptosis. J Biol Chem. 1999;274:1541-1548. [PubMed] [DOI] |
| 8. | Moller P, Koretz K, Leithauser F, Bruderlein S, Henne C, Quentmeier A, Krammer PH. Expression of APO-1(CD 95), a member of the NGF/TNF receptor superfamily, in normal and neoplastic colon epithelium. Int J Cancer. 1994;57:371-377. [PubMed] [DOI] |
| 10. | Nita ME, Nagawa H, Tominaga O, Tsuno N, Fujii S, Sasaki S, Fu CG, Takenoue T, Tsuruo T, Muto T. 5-Fluorouracil induces apoptosis in human colon cancer cell lines with modulation of Bcl-2 family proteins. Br J Cancer. 1998;78:986-992. [PubMed] [DOI] |
| 11. | Krueger A, Schmitz I, Baumann S, Krammer PH, Kirchhoff S. Cellular FLICE-inhibitory protein splice variants inhibit different steps of caspase-8 activation at the CD95 death-inducing signaling complex. J Biol Chem. 2001;276:20633-20640. [PubMed] [DOI] |