Copyright
©The Author(s) 2005. Published by Baishideng Publishing Group Inc. All rights reserved.
人内皮抑素endostatin基因的融合表达纯化及活性测定
杨芳, 何援利, 刘芸
杨芳, 何援利, 南方医科大学珠江医院妇产科 广东省广州市 510282
刘芸, 中山大学生命科学院医药分子生物学实验室 广东省广州市 510275
杨芳, 女, 1975-09-18生, 山西省高平市人, 汉族. 主治医师, 2002年南方医科大学硕士生, 主要从事肿瘤治疗的研究.
ORCID number: $[AuthorORCIDs]
基金项目: 广东省科技厅科技计划项目资助课题, No. 2003B30502.
电话: 020-61643361
收稿日期: 2005-03-22
修回日期: 2005-03-28
接受日期: 2005-04-08
在线出版日期: 2005-07-15
目的: 获得有活性的人内皮抑素(endostatin)融合蛋白.
方法: 从人胎肝组织中提取总RNA,经逆转录-聚合酶链式反应(RT-PCR)扩增出endostatin基因, 定向克隆重组入pTRX表达载体, 转化大肠杆菌BL21(DE3), IPTG诱导表达, 纯化, MTT法测定endostatin蛋白对人脐带静脉血管内皮细胞的抑制活性.
结果: RT-PCR获得endostatin基因, 扩增产物在10 g/L琼脂糖凝胶上显示为1条扩增条带, 约573 bp, 与预计大小一致.将PCR产物连入PGEM-T载体, 转化大肠杆菌DH5α, 阳性克隆经KpnI, NotI酶切鉴定、测序验证.构建pTRX-endo表达载体, 在大肠杆菌BL21(DE3)中的表达, 经SDS-PAGE分析, 出现特异性蛋白质条带, 大小与预期相符合.重组蛋白经纯化, MTT法测定重组人内皮抑素蛋白具有生物学活性.人脐静脉血管内皮细胞(ECV304)受到明显抑制, 具有剂量依赖抑制关系, ED50 = 550 μg/L.
结论: 人内皮抑素基因在原核细胞表达载体pTRX中获得成功表达, 表达蛋白能够抑制人脐静脉血管内皮细胞(ECV304)的增殖.
关键词: 人内皮抑素基因; 融合表达; 活性; 逆转录-聚合酶链反应; MTT法
引文著录: 杨芳, 何援利, 刘芸. 人内皮抑素endostatin基因的融合表达纯化及活性测定. 世界华人消化杂志 2005; 13(13): 1554-1557
Fusion expression and purification of human endostatin gene and its activity analysis
Fang Yang, Yuan-Li He, Yun Liu
Fang Yang, Yuan-Li He, Department of Obstetrics and Gynecology, Zhujiang Hospital, Nanfang Medical University, Guangzhou 510282, Guangdong Province, China
Yun Liu, Laboratory of Medicine and Molecular Biology, Life Science School of Sun Yat-sen University, Guangzhou 510275, Guangdong Province, China
Supported by: the Science and Technology Project of Guangdong Province, No. 2003B30502.
Correspondence to: Yuan-Li He, Department of Obstetrics and Gynecology, Zhujiang Hospital, Nanfang Medical University, Guangzhou 510282, Guangdong Province, China. fangfangy2003@yahoo.com.cn
Received: March 22, 2005
Revised: March 28, 2005
Accepted: April 8, 2005
Published online: July 15, 2005
AIM: To procure human endostatin fusion protein with biological activity.
METHODS: The total RNA was extracted from fetal liver and amplified to acquire human endostatin gene by reverse transcription polymerase chain reaction (RT-PCR). Then the obtained gene was cloned into expression vector pTRX and transformed into E.coli BL21 (DE3). Endostatin was expressed in the E.coli by IPTG inducement, and then purified. MTT assay was used to detect the inhibitory activity of endostatin on human umbilical vein endothelial cells (ECV304).
RESULTS: One band with a length of 573 bp was showed after electrophoresis of RT-PCR product. After the obtained gene was transformed into E.coli DH5a, the positive clone was identified by KpnI and NotI digestion and its sequence was identified by sequencing. The pTRX-endo expression vector was successfully constructed and expressed in E.coli BL21 (DE3). SDS-PAGE analysis showed that the expressed endostatin was the right one. It had good biological activity after purification. The growth of ECV304 cells was markedly inhibited by endostatin in a dose-dependent manner, and ED50 was 550 μg/L.
CONCLUSION: Human endostatin gene is successfully expressed in the prokaryotic expressing vector pTRX, and human endostatin protein can inhibit the proliferation of ECV 304 cells.
Key Words: Human endostatin gene; Fusion expression; Activity; Reverse transcription polymerase chain reaction; MTT assay
0 引言
恶性肿瘤治疗一直是困扰医学界的一大难题.现有的放化疗及手术治疗虽有一定的临床效果, 但副作用大、复发率高.目前抑制肿瘤血管生成已成为肿瘤治疗学研究的新热点[1-6].血管生成抑制因子-内皮抑素(endostatin)能有效地抑制血管内皮细胞的增殖, 抑制血管生成和肿瘤的生长与转移, 而且具有低毒性、可长期应用等特点[7-12].为了研究人内皮抑素用于肿瘤治疗的可行性, 我们进行了人内皮抑素的表达及活性研究.
1 材料和方法
1.1 材料
各种限制性内切酶、T4 DNA连接酶、Taq DNA聚合酶、DNA分子大小标准、反转录试剂盒购自大连宝生物公司; 中分子质量蛋白标准购自华美生物技术公司; IPTG购自上海Sangon公司; Trizol试剂购自Gibco公司; PGEM-T载体系统购自Promega公司; 质粒提取及凝胶回收试剂盒购自Omega公司.融合表达质粒pTRX由中山大学医药分子实验室构建, 宿主菌大肠杆菌DH5α, BL21(DE3)、人脐带静脉血管内皮细胞(ECV304)由中山大学医药分子实验室保存, 肠激酶由中山大学医药分子实验室自制, 肝细胞来源于本院引产胎儿肝脏.引物根据GenBank中报告的endostatin序列设计而成.上下游引物5'端分别携带KpnI、NotI酶切位点, 由上海博亚生物工程公司合成.上游引物: 5'-GGGGTACCGACGACGACGACAAAC ACAGCCACCGCGACTTCC-3'下游引物5'GTCATGCGGC CGCTTACTACTTGGAGGCAGTCATGAAGC-3'.测序由上海博亚生物工程公司完成.
1.2 方法
将液氮冻存的新鲜胎肝组织约100 mg加入研钵中, 倒入少许液氮, 尽力研磨使其成为粉末状.Trizol一步法提取总RNA, 反转录按Takara试剂盒说明书操作.反转录引物为试剂盒提供的Oligo dT.反转录合成第一链后, 加入PCR扩增引物.引物PCR反应条件: 95℃ 30 s, 58℃ 60 s, 72℃ 60 s, 共35个循环, 72℃延伸10 min.将上述PCR产物取2 μL在10 g/L琼脂糖凝胶上进行电泳鉴定, 其余部分胶回收.将上述回收的PCR产物以4∶1的分子比率连入PGEM-T载体, 在16℃下以进行16 h连接反应, 转化大肠杆菌DH5α, 对所获克隆扩大培养, 提取质粒并经KpnI、NotI酶切鉴定.将带有插入片段的重组质粒命名为PGEM-Tendo.将含有重组质粒的PGEM-Tendo阳性克隆扩大培养, 大量提取质粒, 分别以T7、SP6为测序引物进行全自动正、反向测序, 测序由上海博亚生物工程公司完成.将所得序列与GenBank中有关基因序列相比较.将PGEM-Tendo经KpnI、NotI双酶切, 回收纯化的endostatin片段, 与经KpnI、NotI切开的线性载体pTRX连接, 构建融合表达载体pTRX-endo.转化入大肠杆菌DH5α, 经PCR筛选转化后的克隆, 阳性克隆命名为pTRX-endo.提取质粒并经KpnI、NotI进一步酶切鉴定.将pTRX-endo质粒转化工程菌BL21(DE3), 挑取含重组表达质粒的单菌落, 扩大培养, 37℃, IPTG诱导表达4 h, 对所收菌和诱导前细菌进行SDS-PAGE电泳.将诱导表达菌体重悬浮, 超声, 取超声上清, 通过Ni-Chelating Sepharose亲和层析纯化融合蛋白Trx-endo, 经0.1-1.0 mol/L咪唑梯度洗脱, 收集融合蛋白洗脱峰.纯化的融合蛋白经肠激酶(EK)酶切, 酶切产物上Ni-Chelating Sepharose亲和层析柱, 收集穿流峰, 穿流峰通过SP Sepharos Fast Flow进一步纯化, 经0.1 -1.0 mol/L NaCl梯度洗脱, 收集含目的蛋白的洗脱峰.将体外培养的人脐带静脉血管内皮细胞, 传至第5代后, 按MTT法进行重组人内皮抑素蛋白活性测定.
2 结果
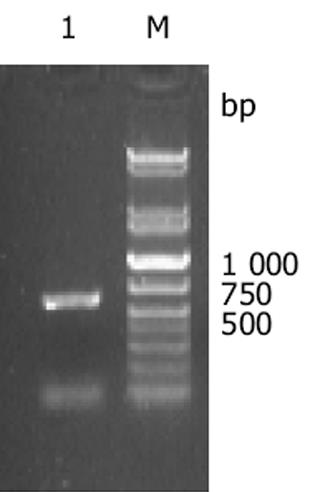
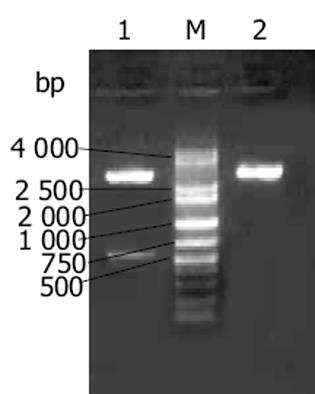
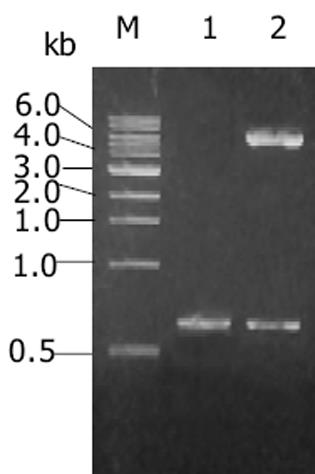
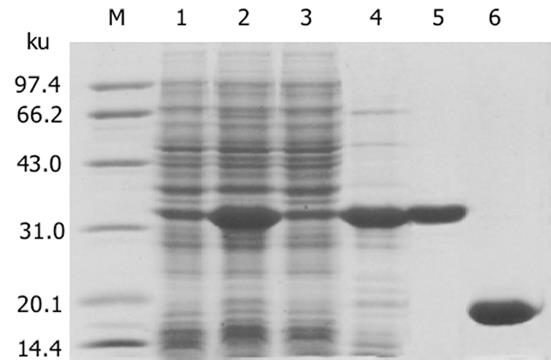
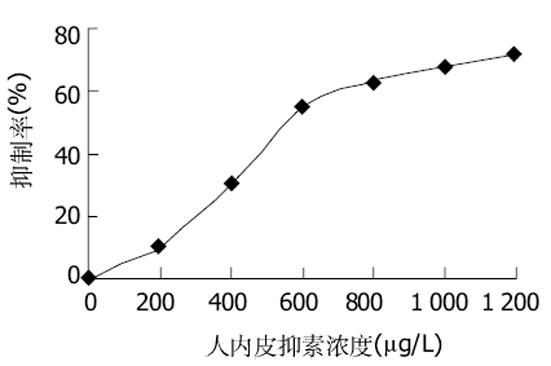
endostatin基因预计大小为573 bp(含酶切位点), 扩增产物在10 g/L琼脂糖凝胶上显示为1条扩增条带, 约573 bp, 与预计大小基本一致(图1).从阳性克隆提取的质粒用KpnI, NotI双酶切, 10 g/L琼脂糖凝胶电泳上可见约为560 bp的endostatin片段和约为3 000 bp的PGEM-T载体片段, 此结果说明endostatin已成功构建在PGEM-T载体上(图2).阳性克隆经全自动正、反向测序, 所获得目的基因序列与已发表的人endostatin基因序列相比基本一致, 该基因的第471位氨基酸编码碱基由G突变为A, 但编码的氨基酸都是精氨酸, 与GenBank中人内皮抑素蛋白质序列完全一致, 属于沉默突变型.从阳性克隆提取的质粒用KpnI, NotI双酶切, 10 g/L琼脂糖凝胶电泳上可见约为560 bp的endostatin片段和约为5 800 bp的pTRX载体片段, 此结果说明endostatin已成功构建在pTRX载体上(图3).SDS-PAGE电泳结果表明, 与没有经过IPTG诱导的阴性对照相比, 经诱导的基因工程菌在34 ku处出现了明显加强的蛋白带, 与预期大小一致(内皮抑素Mr 20 000, pTRX Mr 14 000)(图4).由于融合蛋白含有6×His亲和纯化标签, 因此首先选择亲和层析进行纯化, SDS-PAGE结果表明, 纯化的融合蛋白纯度达85%(图4), 可用于EK酶切.融合蛋白Trx-endo经EK酶切割后, 需要将EK酶、融合伴侣Trx和未切割的融合蛋白与endo重组蛋白, 根据这些蛋白亲合性、离子性质的差异, 我们选择Ni2+-Chelating Sepharose亲和层析和SP Sepharose Fast Flow阳离子交换层析进行纯化, 经上述步骤纯化, 最终可获得纯度在95%以上的重组人内皮抑素蛋白(图4).加入人内皮抑素后, 可见人脐静脉血管内皮细胞(ECV304)受到明显抑制, 具有剂量依赖抑制关系, ED50 = 550 μg/L(图5).
图1 人endoatatin RT-PCR扩增产物.
M: DNA标准; 1: RT-PCR扩增产物.
图2 PGEM-Tendo的酶切鉴定.
M: DNA标准; 1: PGEM-Tendo经Kpn I和Not I酶切; 3: PGEM-Tendo.
图3 pTRX-endo的酶切鉴定.
M: DNA标准; 1: PCR筛选阳性克隆; 2: pTRX-endo经Kpn I和Not I酶切.
图4 人内皮抑素基因的重组表达与纯化SDS-PAGE分析.
M: 中分子质量蛋白标准; 1: 诱导前总蛋白; 2: 诱导后总蛋白; 3: 诱导后沉淀; 4: 诱导后上清; 5: Trx-endo融合蛋白经Ni2+-chelating sepharose 亲和层析; 6: endostatin 重组蛋白经Ni2+ chelating sepharose column 和SP阳离子交换层析纯化.
图5 人内皮抑素蛋白抑制ECV304细胞生长曲线.
3 讨论
大量体内外实验证实, 原发性恶性肿瘤细胞中存在多种促进和抑制血管形成的因子, 抑制血管生成治疗可能是限制肿瘤生长和防止转移的有效策略[13-18].内皮抑素作为存在于体内的天然抗血管生成蛋白, 对正常静止的血管内皮细胞和其他细胞无抑制作用, 能够特异性地作用于新生血管内皮细胞而不是肿瘤细胞本身, 抗癌谱广泛, 是目前最有前景的肿瘤治疗侯选药物之一[19-22].因内皮细胞遗传性状稳定, 不易发生突变, 以内皮细胞作为治疗靶点既可提高治疗的专一性和安全性, 又大大减少了耐药性的出现[23-25].内皮抑素的蛋白治疗在国外已进入到Ⅱ期临床试验阶段.
内皮抑素为胶原XVIII C末段的一个片段, 由184个氨基酸组成, Mr约20 000, 在内皮抑素的序列中存在着锌离子结合位点, 由其N末端1、3、11三个组氨酸残基和76位的天门冬氨酸残基构成.N末端与锌离子结合成1∶1的复合物, 是内皮抑素活性所必须[26-30].我们所用的原核细胞融合表达载体pTRX由中山大学医药分子实验室构建, 以T7为启动子, 细菌硫氧还蛋白TRX为担体蛋白, 具有6×His纯化标签, 硫氧还蛋白和目的蛋白之间有柔韧区和肠激酶酶切位点, Mr 14 000.我们根据GenBank中人胶原XVIII的基因序列及融合表达载体pTRX的特点, 设计了人endostatin的序列引物.上游带有Kpn I酶切位点、肠激酶酶切位点, 下游引物带有Not I酶切位点和TTACTA强终止密码子.测序结果表明序列虽第471位氨基酸编码碱基由G突变为A, 但与GenBank中人内皮抑素蛋白质序列完全一致, 属于沉默突变型, 不影响后续表达.利用pTRX载体, 我们成功地构建了融合蛋白表达质粒pTRX-endo, 通过IPTG诱导了重组融合蛋白pTRX-endo的表达, 并利用pTRX含有6×His亲和纯化标签和endostatin离子特性, 进行重组融合蛋白和重组人内皮抑素的纯化.经体外实验证实, 纯化的人内皮抑素蛋白可明显抑制ECV304细胞的增殖, 并存在剂量效应关系.