修回日期: 2005-04-18
接受日期: 2005-05-25
在线出版日期: 2005-07-15
目的: 应用抑制性消减杂交(suppression subtractive hybridization, SSH)技术构建As2O3处理的人肝癌细胞系HepG2差异表达基因的cDNA消减文库, 筛选并克隆As2O3调节相关基因, 阐明As2O3对肝细胞调节作用的分子生物学机制.
方法: 以As2O3处理HepG2细胞, 同时以PBS处理的相同细胞系作为对照; 24 h后制备细胞裂解液, 提取mRNA并逆转录为cDNA, 经RsaI酶切后, 将实验组cDNA分成两组, 分别与两种不同的接头衔接, 再与对照组cDNA进行两次消减杂交及两次抑制性多聚酶链反应(PCR), 将产物与T/A载体连接, 构建cDNA消减文库, 并转染大肠杆菌J109进行文库扩增, 随机挑选克隆PCR扩增后进行测序及同源性分析.
结果: 成功构建三As2O3处理HepG2细胞差异表达基因的cDNA消减文库. 文库扩增后得到109个白色克隆, 进行菌落PCR分析, 均得到200-1 000 bp插入片段. 挑取含有插入片段的36个克隆进行测序, 并通过生物信息学分析获得15种已知基因序列和6个未知功能的新基因.
结论: 应用SSH技术成功构建了As2O3处理HepG2细胞差异表达基因的cDNA消减文库.
引文著录: 吴顺华, 成军, 郑玉建, 张跃新, 刘妍, 郭江, 张黎颍, 王国荃. 应用抑制性消减杂交技术筛选三氧化二砷对肝细胞调节的差异表达基因. 世界华人消化杂志 2005; 13(13): 1535-1539
Revised: April 18, 2005
Accepted: May 25, 2005
Published online: July 15, 2005
AIM: To clone and identify human genes differentially expressed in human hepatocarcinoma HepG2 cells treated with arsenic trioxide by constructing a subtractive cDNA library with suppression subtractive hybridization (SSH) technique, and to elucidate the molecular mechanism of arsenic trioxide in the regulation of liver cells.
METHODS: The mRNA was isolated from HepG2 cells treated with arsenic trioxide and PBS, respectively, and then cDNA was synthesized. After digestion of restriction enzyme RsaI, small sizes cDNA were obtained. Then the tester cDNA was subdivided into two portions and each was ligated with a different cDNA adaptor. After the tester cDNA was hybridized with driver cDNA (twice) and underwent nested polymerase chain reaction (PCR) (twice), the DNA fragment was subcloned into T/A plasmid vectors to establish the subtractive cDNA library. Amplification of the library was performed in E. coli strain JM109. The amplified cDNA was sequenced and analyzed in GenBank with BLAST search after colony PCR.
RESULTS: The subtractive cDNA library of genes differentially expressed in HepG2 cells treated with arsenic trioxide was constructed successfully. The amplified library contained 109 positive clones. Colony PCR showed that these clones all contained 200-1 000 bp inserts. Thirty-six clones were analyzed by sequencing and bioinformatics. The results showed there were 15 coding sequences with known function and 6 novel ones with unknown function.
CONCLUSION: A subtractive cDNA library of genes differentially expressed in HepG2 cells treated with arsenic trioxide was constructed successfully using SSH technique.
- Citation: Wu SH, Cheng J, Zheng YJ, Zhang YX, Liu Y, Guo J, Zhang LY, Wang GQ. Screening and identification of target genes differentially expressed in HepG2 cells treated with arsenic trioxide by suppression subtractive hybridization technique. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1535-1539
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1535.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1535
三氧化二砷(arsenic trioxide, As2O3)用于维甲酸治疗失败的急性早幼粒细胞性白血病, 取得了满意的临床效果, 完全缓解率达到90%以上.近年来的研究发现As2O3在体外对人的肝癌细胞株有抑制增殖、诱导凋亡的作用[1].但As2O3同时作为国际癌症研究机构(IARC)1980年确定一种致癌物, 其确切的致癌机制尚未阐明.因此正确认识As2O3的这种治/致癌的双向调节作用就显得尤为重要.抑制性消减杂交技术(suppression subtractive hybridization, SSH)可以快速有效地检测到差异表达的基因[2].我们应用SSH技术, 构建As2O3作用于人肝癌细胞HepG2后差异表达基因的cDNA消减文库, 筛选并克隆As2O3对肝细胞调节作用的差异表达基因, 并应用生物信息学(bioinformatics)技术初步获得其基因序列.为深入了解As2O3在肝癌治疗中的作用机制提供新的理论依据.
人肝癌细胞系HepG2细胞及大肠杆菌JM109(本室保存), mRNA Purification试剂盒(Amersham Pharmacia Biotech), PCR-Select cDNA Subtraction试剂盒(Clontech), 50×PCR Enzyme Mix, Advantage PCR Cloning试剂盒(Clontech), High Pure PCR Product Purification试剂盒(Boehringer Mannheim), T7, SP6通用引物及pGEM-T载体(Promega).DNA序列测定由上海博亚公司完成.配制As2O3溶液以PBS溶液作参比.在35 mm培养皿中常规培养HepG2细胞, 细胞生长至对数期时分别将As2O3及PBS加入细胞培养液中, 使As2O3终浓度达到5 μmol/L, 24 h后收获细胞.使用mRNA Purification试剂盒, 直接提取As2O3及PBS处理的HepG2细胞mRNA, 经琼脂糖凝胶电泳及分光光度计分别进行定性、定量分析.
消减杂交文库的建立采用PCR-Select cDNA Subtraction Kit, 常规SSH方法按说明书进行: 以As2O3及PBS处理的HepG2细胞mRNA为模板逆转录合成双链cDNA(dscDNA), 并分别标记为Tester和Driver, dscDNA经RsaⅠ(一种识别4碱基序列的内切酶)消化, 产生相对较短的平端片段, 纯化酶切产物.将Tester的dscDNA分为两份, 分别连接试剂盒提供的特殊设计的寡核苷酸接头Adapter 1和Adapter 2, 然后与过量的Driver dscDNA进行杂交; 合并两种杂交产物后再与Driver dscDNA作第2次杂交; 然后将杂交产物做选择性PCR扩增, 使Tester dscDNA中特异性表达或高表达的片段得到特异性扩增.将扩增产物与pGEM-T载体连接, 转化JM109感受态细菌, 在含氨苄青霉素的LB/X-gal/IPTG培养板上, 37℃培养18 h.挑取白色菌落, 增菌, 以pGEM-T载体多克隆位点两端T7/SP6引物进行菌落PCR扩增, 证明含有插入片段后(200-1 000 bp), 测序.应用生物信息学将测得序列与GenBank数据库进行Blast同源性分析.
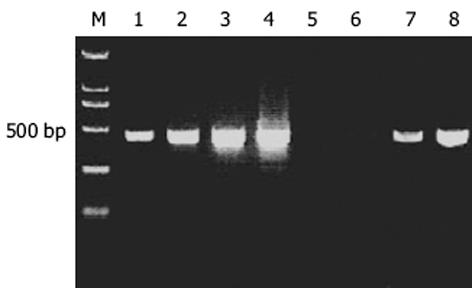
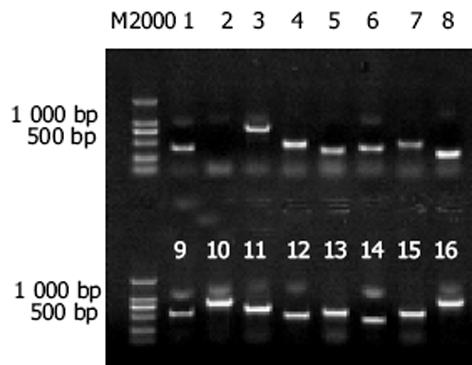
紫外分光检测显示, As2O3及PBS处理的HepG2细胞mRNA分别为4.6 μg和5.5 μg, A260/A280 = 2.199. 10 g/L琼脂糖凝胶电泳见 mRNA为大于0.5 kb清晰慧尾片状条带.将连接有adaptor l和adaptor 2的2组dscDNA分别用不同的特异性引物(看家基因甘油三磷酸脱氢酶G3PDH引物)进行28个循环扩增, 产物用20 g/L琼脂糖凝胶电泳鉴定.结果显示2组dscDNA扩增产物浓度相当, 说明dscDNA已与接头高效率连接.分别以消减及未消减PCR产物为模板, 用G3PDH引物进行PCR扩增, 分别在18, 23, 28, 33次循环结束时从体系中吸取5 μL进行电泳鉴定.结果显示, 与未消减组PCR产物相比, 消减组PCR产物中G3PDH基因产物大大减少, 说明所构建的消减文库具有很高的消减效率(图1).杂交产物经2轮PCR扩增后, 菌落PCR扩增结果显示为200-1 000 bp大小不等的插入片段, 所获得的36个克隆中几乎均含有插入片段, 这些条带可能代表差异表达的基因片段(图2).随机挑选36个克隆测序, 与GenBank数据库进行初步比较.应用生物信息学技术分析发现, 36个克隆均与已知基因的部分序列高度同源(98-100%), 编码15种已知蛋白, 6种新的未知蛋白(表1).
| 同源蛋白基因名称 | 相同克隆数 | 同源性 |
| 腺苷环化酶相关蛋白(CAP) | 2 | 97% |
| 小核糖体核蛋白(SNRPB) | 2 | 100% |
| 蛋白酶体亚单位a2(PSMA2) | 3 | 100% |
| 蛋白酶体亚单位a5(PSMA5) | 1 | 100% |
| 胶原结合蛋白 | 1 | 99% |
| 转移粘连蛋白(AEG1) | 1 | 99% |
| 碳酸氢钠协同转运子(SLC4A7) | 1 | 99% |
| CCAAT-结合蛋白类似物(CCAAT-B) | 1 | 97% |
| 包被蛋白(COPA) | 1 | 99% |
| 半乳糖苷转移酶相关蛋白激酶(p58/GTA) | 1 | 97% |
| 铁蛋白重链多肽(FHP) | 4 | 98% |
| 铁蛋白轻链多肽(FLP) | 4 | 100% |
| 热休克蛋白47(HSP47) | 1 | 100% |
| 热休克蛋白89 a(HSP89 a) | 1 | 99% |
| 热休克蛋白90a(HSP90a) | 2 | 99% |
| 推定蛋白 KIAA0172 | 1 | 99% |
| 推定蛋白 MGC9084 | 1 | 98% |
| FLJ14185 | 1 | 100% |
| FLJ90301 | 1 | 97% |
| FLJ23322 | 1 | 100% |
| 有丝裂原活化蛋白激酶(MAPK) | 1 | 100% |
| 睾丸增强基因转录子(BAX inhibitor 1), | 1 | 100% |
| 人类染色体克隆 | 3 | 100% |
三氧化二砷(arsenic trioxide, As2O3)俗称砒霜, 是细胞凋亡诱导物, 其注射液已获得我国SDA和美国FDA批准上市.肝细胞肝癌(Hepatocellular Carcinoma, HCC)是最常见的原发性肝癌, 同时也是一个常见的世界范围内的肿瘤[3-6], 其恶性程度高预后差[7-10].As2O3在与肝癌细胞的研究表明, 他是较好的抗肿瘤药物之一.但As2O3同时作为一种致癌物, 可以引起包括皮肤异常改变和肺癌、膀胱癌、肝癌等其他内脏肿瘤的发生.因此研究As2O3对肝细胞作用的机制在有效防治肝细胞癌方面有很重要的意义.As2O3在体外引起细胞代谢异常, 发生细胞凋亡, 下调抑凋亡基因Bcl-2, 增加促凋亡基因Bax的表达以及改变二者之间的比例, 促使Fas基因的表达增强, 促进其凋亡[11-13].随着As2O3广泛应用于抑制包括肝癌的其他实体肿瘤, 其抑癌作用机制的研究也更加深入.抑制性消减杂交方法是近年发展起来的一项新的基因克隆技术, 与传统的方法比较, 具有实验周期短、易操作、可靠性高、假阳性率低等特点, 能有效地分离扩增低丰度特异表达的基因, 可以在较短的时间内获得较理想的实验结果[14].我们将As2O3刺激肝母细胞瘤细胞系HepG2, 并以As2O3溶剂PBS刺激的相同细胞系作为对照, 以2种细胞系中提取的mRNA为起始材料, 应用SSH方法成功地构建了As2O3激活相关基因差异表达的cDNA消减文库, 随机挑选36个克隆测序分析, 有27个克隆与已知功能的基因高度同源(98-100%), 共编码15种基因.6个克隆为新的基因序列, 3个染色体基因序列.
As2O3可上调肝细胞许多功能蛋白的表达.吴顺华et al[15]应用低剂量As2O3对肝HepG2细胞基因表达谱调节的基因芯片研究发现, 5 μmol/L As2O3诱导肝HepG2细胞差异表达基因137条, 其中53条基因表达上调.包括人胰岛素生长因子2受体(IGF2R), 人有丝分裂原激活蛋白2激酶6(MAP2K6)等.Tchounwou et al[16]发现As2O3上调谷胱甘肽转移酶, 金属硫蛋白II, 热休克蛋白HSP70, C-Fos, DNA损伤组织蛋白153, 45(GADD153, 45), 葡萄糖调节蛋白78启动子(GRP78), 以及异源物质反应元件(XRE)、肿瘤抑制蛋白反应元件(p53RE), 环磷酰苷反应元件(CRE), 维甲酸反应元件(RARE)的表达.我们发现As2O3上调的15种已知功能蛋白可分为7类: (1) 细胞凋亡相关蛋白: (BAX inhibitor 1), Bax inhibitor-1(BI-1)是一种新的抗凋亡蛋白, 位于12q12-q13, CDS全长711bp, 编码237 aa, 信号肽区域1-46, 6个跨膜区30-47, 51-73, 85-107, 112-134, 141-163, 早期研究命名为睾丸增强基因转录子(TEGT), 受Bcl-2和Bax的调控.现在证实BI-1可与Bcl-2和Bcl-XL相互作用, 而不是与Bax和Bad, 当BI-1在恶性细胞中过度表达时, 可以抑制由Bax和化疗药物诱导的细胞凋亡, 而不是通过Fas(CD95)作用的[17].(2)离子通道和运输蛋白: 包被蛋白(COPA), 碳酸氢钠协同转运子(SLC4A7), 这是两种在物质转运和能量传递中起重要作用的蛋白.转移粘连蛋白(AEG1)是肿瘤转移的标志物之一.(3)细胞外基质: 胶原结合蛋白, 核糖体蛋白为细胞内结构的蛋白.腺苷酸环化酶相关蛋白(CAP)为广泛存在, 高度保守, 具有双重功能的蛋白质, 其氨基末端是细胞响应上游的Ras调节信号系统, 结合腺苷酸环化酶; 而羧基末端结合球形肌动蛋白, 改变微丝系统动态的重组, 是保持正常细胞形态和生长所需要的[18].Yu et al[19]证实As2O3显著地抑制肝母细胞瘤HepG2细胞, 改变了核基质蛋白的组成减少了HSC70的表达启动了级联反应以及多核功能最终导致细胞存活.(4)维持细胞稳定, 促进损伤细胞再生、修复的基因: 铁蛋白重(轻)链多肽: 铁蛋白是体内主要储存铁的蛋白质, 与体内铁的代谢密切相关.有研究发现肝脏中其水平的升高为抵抗氧化应激损伤的机制之一[20], Gebel et al[21]发现低水平的砷介导的细胞毒性可以通过细胞耐受提高砷诱导的DNA损伤.近来还有研究认为铁蛋白重链基因有抗凋亡作用, 可以使肝脏免受缺血性损伤[22], 因此间接的反映As2O3可以改变细胞内铁负荷的平衡影响铁代谢.(5)分子伴侣蛋白: HSP47, HSP89, HSP90.HSP47作为细胞内质网的一种分子伴侣, 参与内质网前胶原分子的折叠, 组装和转运, 促进胶原的合成并维持内质网非折叠分子稳定性, 有助于从内质网到高尔基体的分子正确组装和转运[23].HSP47在富含胶原的实体瘤中特异的表达增高, 可作为肿瘤早期转移的标志物之一.HSP89是HSP90家族的新成员, HSP90是细胞内最活跃的分子伴侣蛋白之一, 许多信号转导蛋白的正常功能发挥都依赖于他.Lee et al[24]应用Strategic shotgun proteomics技术筛选肝HepG2蛋白表达谱与Hep3B相比发现16种蛋白包括热休克蛋白HSP90和异种核糖核蛋白(hnRNP A2/B1)存在显著的统计学意义, 实验证明这些蛋白的差异表达与端粒酶的长度有关系.(6)信号转导通路蛋白: 有丝裂原活化蛋白激酶(MAPK)是一类广泛存在于真核细胞中的Ser/Thr蛋白激酶, 是Ras途径中的下游信号分子, 具有丝氨酸/苏氨酸蛋白激酶活性, 可激活C-Fos、C-Jun等转录调节因子, 形成AP-1作用于核内, 激活特定的基因从而传递信号.MAPK的激活需要其分子中特定的Tyr残基和Ser残基同时被磷酸化.MAPK信号通路具有调节细胞分裂和凋亡的作用.当细胞经As2O3处理, 则MAPK信号传导, 同时应激胱冬肽酶-3(caspase-3)和信号调节激酶(ERK)和相关的C-Jun氨基末端激酶(JNK)、应激激化蛋白激酶(SAPK), 但p38MAP未被激活, 抑制HepG2细胞iNOS的表达, 结果表明被As2O3诱导的信号转到通路激酶活性的改变可能不是细胞凋亡的主要因素[25].As2O3诱导凋亡可能与MAPK信号通路有关.最近的发现表明, 慢性砷暴露导致的免疫毒性与砷直接作用于JAK酪氨酸激酶, 从而强烈的抑制了STAT3酪氨酸磷酸化作用有关, 而不影响其丝氨酸的磷酸化.砷完全阻断了STAT活性依赖的细胞因子信号抑制子(SOCS)的表达, 激活了MAPK的活性[26].(7)蛋白酶体: PSMA2, PSMA5, 一般真核细胞主要有两种蛋白降解途径: 一种是溶酶体途径, 主要降解经胞吞进入细胞中的胞外蛋白质; 另一种是非溶酶体途径, 他主要经细胞颗粒中的蛋白酶体(proteasome)降解泛素化的胞内蛋白质.泛素-蛋白酶体(ubiquitin-proteasome)途径不仅是一种破坏陈旧或损伤蛋白质的重要机制之一, 而且还是调节多种细胞生物学过程如细胞周期、基因转录调节、抗原递呈、免疫逃逸和耐药的关键机制[27].20 S蛋白酶体主要用于底物识别, 参与底物降解.其活性调节因子主要有两种: 19 S调节复合体和11 S(20S-PA28)调节复合体.20 S蛋白酶体结合19 S调节复合体后参与泛素化蛋白的降解, 20 S-PA28主要参与抗原递呈.26 S蛋白酶体复合物由20 S核心颗粒和19 S帽结构组成, 主要使蛋白在胞质中裂解为短肽片段.20 S蛋白酶体有28个亚单位构成, PSMA2和PSMA5均是20 S蛋白酶体亚单位, 负责蛋白酶体的激活, 抑制, 调节, 可能在肿瘤的转移和侵袭过程中发挥作用[28].我们的结果暗示As2O3可激活泛素-蛋白酶体调节通路.
总之, 我们应用SSH技术成功构建了As2O3处理HepG2细胞差异表达基因的cDNA消减文库.发现应用As2O3刺激细胞后, 有7类15种蛋白参与了细胞生长、代谢、维持细胞稳定及促进损伤细胞再生、修复以及抑制肿瘤的生长和转移的基因表达增高, 这些基因影响了细胞凋亡、信号转导和蛋白降解等系统.提示As2O3在抑制肝癌细胞中作用机制是多基因多通路共同作用的结果.
编辑: 潘伯荣 审读: 张海宁
| 1. | Siu KP, Chan JY, Fung KP. Effect of arsenic trioxide on human hepatocellular carcinoma HepG2 cells: inhibition of proliferation and induction of apoptosis. Life Sci. 2002;71:275-285. [PubMed] [DOI] |
| 2. | Diatchenko L, Lukyanov S, Lau YF, Siebert PD. Suppression subtractive hybridization: a versatile method for identifying differentially expressed genes. Methods Enzymol. 1999;303:349-380. [PubMed] [DOI] |
| 3. | Anzola M. Hepatocellular carcinoma: role of hepatitis B and hepatitis C viruses proteins in hepatocarcinogenesis. J Viral Hepat. 2004;11:383-393. [PubMed] [DOI] |
| 4. | Szabo E, Paska C, Kaposi Novak P, Schaff Z, Kiss A. Similarities and differences in hepatitis B and C virus induced hepatocarcinogenesis. Pathol Oncol Res. 2004;10:5-11. [PubMed] [DOI] |
| 5. | Lee JH, Ku JL, Park YJ, Lee KU, Kim WH, Park JG. Establishment and characterization of four human hepatocellular carcinoma cell lines containing hepatitis B virus DNA. World J Gastroenterol. 1999;5:289-295. [PubMed] [DOI] |
| 6. | Worman HJ, Lin F, Mamiya N, Mustacchia PJ. Molecular biology and the diagnosis and treatment of liver diseases. World J Gastroenterol. 1998;4:185-191. [PubMed] [DOI] |
| 7. | He XX, Wang JL. The current status and prospect in the gene therapy of liver cancer. Huaren Xiaohua Zazhi. 1998;6:158-159. |
| 8. | Yang LJ, Wang WL. Preparation of monoclonal antibody against apoptosis-associated antigens of hepatoma cells by subtractive immunization. World J Gastroenterol. 2002;8:808-814. [PubMed] [DOI] |
| 9. | Wang FS, Liu MX, Zhang B, Shi M, Lei ZY, Sun WB, Du QY, Chen JM. Antitumor activities of human autologous cytokineinduced killer(CIK)cells against hepatocellular carcinoma cells in vitro and In vivo. World J Gastroenterol. 2002;8:464-468. [PubMed] [DOI] |
| 10. | Zhang G, Long M, Wu ZZ, Yu WQ. Mechanical properties of hepatocellular carcinoma cells. World J Gastroenterol. 2002;8:243-246. [PubMed] |
| 11. | Siu KP, Chan JY, Fung KP. Effect of arsenic trioxide on human hepatocellular carcinoma HepG2 cells: inhibition of proliferation and induction of apoptosis. Life Sci. 2002;71:275-285. [PubMed] [DOI] |
| 12. | Kito M, Akao Y, Ohishi N. Arsenic trioxide-induced apoptosis and its enhancement by buthionine sulfoximine in hepatocellular carcinoma cell lines. Biochem Biophys Res Commun. 2002;291:861-867. [PubMed] [DOI] |
| 13. | Liu JW, Tang Y, Shen Y, Zhong XY. Synergistic effect of cell differential agent-II and arsenic trioxide on induction of cell cycle arrest and apoptosis in hepatoma cells. World J Gastroenterol. 2003;9:65-68. [PubMed] [DOI] |
| 15. | 吴 顺华, 郑 玉建, 成 军, 刘 妍, 张 跃新, 刘 开泰, 钟 彦伟, 吴 煜. 低剂量三氧化二砷对HepG2细胞基因表达谱调节的影响. 世界华人消化杂志. 2005;13:100-104. [DOI] |
| 16. | Tchounwou PB, Wilson BA, Ishaque AB. Atrazine potentiation of arsenic trioxide-induced cytotoxicity and gene expression in human liver carcinoma cells (HepG2). Mol Cell Biochem. 2001;222:49-59. [PubMed] [DOI] |
| 17. | Xu Q, Reed JC. Bax inhibitor-1, a mammalian apoptosis suppressor identified by functional screening in yeast. Mol Cell. 1998;1:337346. [PubMed] [DOI] |
| 18. | Ksiazek D, Brandstetter H, Israel L, Bourenkov GP, Katchalova G, Janssen KP, Bartunik HD, Noegel AA, Schleicher M, Holak TA. Structure of the n-terminal domain of the adenylyl cyclase-associated protein (cap) from dictyostelium discoideum. Structure (Camb). 2003;11:1171-1178. [PubMed] [DOI] |
| 19. | Yu D, Wang ZH, Cheng SB. The effect of arsenic trioxide on the expression of Hsc and HNF4 in nuclear matrix proteins in HepG2 cells. Anticancer Res. 2001;21:2553-2559. [PubMed] |
| 20. | Erario MA, Gonzales S, Noriega GO, Tomaro ML. Bilirubin and ferritin as protectors against hemin-induced oxidative stress in rat liver. Cell Mol Biol (Noisy-le-grand). 2002;48:877-884. [PubMed] |
| 21. | Gebel TW. Unanswered questions in arsenic toxicology. J Environ Pathol Toxicol Oncol. 2001;20:299-309. [PubMed] [DOI] |
| 22. | Berberat PO, Katori M, Kaczmarek E, Anselmo D, Lassman C, Ke B, Shen X, Busuttil RW, Yamashita K, Csizmadia E. Heavy chain ferritin acts as an antiapoptotic gene that protects livers from ischemia reperfusion injury. FASEB J. 2003;17:1724-1726. [PubMed] |
| 23. | Tasab M, Batten MR, Blleid NJ. Hsp47: a molecular chaperone that interacts with and stablizes correctly-folded procollagen. EMBO J. 2000;19:2204-2211. [PubMed] [DOI] |
| 24. | Lee CL, Hsiao HH, Lin CW, Wu SP, Huang SY, Wu CY, Wang AH, Khoo KH. shotgun proteomics approach for efficient construction of an expression map of targeted protein families in hepatoma cell lines. Proteomics. 2003;3:2472-2486. [PubMed] [DOI] |
| 25. | Kang SH, Song JH, Kang HK, Kang JH, Kim SJ, Kang HW, Lee YK, Park DB. Arsenic trioxide-induced apoptosis is independent of stress-responsive signaling pathways but sensitive to inhibition of inducible nitric oxide synthase in HepG2 cells. Exp Mol Med. 2003;35:83-90. [PubMed] [DOI] |
| 26. | Cheng HY, Li P, David M, Smithgall TE, Feng L, Lieberman MW. Arsenic inhibition of the JAK-STAT pathway. Oncogene. 2004;23:3603-3612. [PubMed] [DOI] |
| 27. | Zavrski I, Jakob C, Schmid P, Krebbel H, Kaiser M, Fleissner C, Rosche M, Possinger K, Sezer O. Proteasome: an emerging target for cancer therapy. Anticancer Drugs. 2005;16:475-481. [PubMed] [DOI] |
| 28. | Han YG, Liu HL, Zheng HJ, Li SG, Bi RC. Purification and refolding of human alpha5-subunit (PSMA5) of the 20S proteasome, expressed as inclusion bodies in Escherichia coli. Protein Expr Purif. 2004;35:360-365. [PubMed] [DOI] |