修回日期: 2005-05-07
接受日期: 2005-05-14
在线出版日期: 2005-07-15
目的: 研究对应FLIP基因的siRNA片段对大肠癌细胞株HT-29凋亡的影响, 明确FLIP在Fas介导的凋亡途径中的作用.
方法: 体外培养大肠癌细胞HT-29, 通过电穿孔技术将特异性siRNA片段转染入细胞, 半定量RT-PCR法判断干扰前后FLIP mRNA水平的变化, 分析RNA干扰的特异性、时效性, 并比较对应不同位点的两个siRNA片段对FLIP的干扰效果.经凋亡诱导型抗体激活后, 以Annexin V染色法及DNA降解片段检测分析干扰前后HT-29细胞对Fas介导的凋亡敏感性的改变.
结果: 特异性siRNA片段能有效降低FLIP mRNA水平, 最大干扰效率达65.02%, 明显高于作为对照的非相关片段; 干扰作用于转染后24 h即可出现, 48 h达高峰, 72 h稍有降低; 对应不同位点的两个siRNA片段对FLIP均可产生干扰作用, 彼此间差别不大.在诱导型抗体的刺激下, 与未转染细胞相比, 转染siRNA的HT-29细胞中凋亡细胞所占比例明显增加.
结论: 特异性siRNA片段可显著降低FLIP基因mRNA的表达水平, 并提高HT-29细胞对Fas介导的凋亡敏感性.以FLIP为靶点的RNA干扰技术可望成为大肠癌基因治疗的新方法.
引文著录: 孙保存, 臧凤琳, 牛瑞芳, 魏熙胤, 赵秀兰, 张诗武. FLIP干扰性小RNA促进大肠癌细胞的凋亡. 世界华人消化杂志 2005; 13(13): 1519-1523
Revised: May 7, 2005
Accepted: May 14, 2005
Published online: July 15, 2005
AIM: To investigate the promotion effect of small interfering RNA of FADD-like IL-1β converting enzyme inhibitory protein (FLIP) on the cell apoptosis in colorectal cancer.
METHODS: Human colorectal cancer cell line HT-29 was cultured in vitro and transfected with two siRNAs (different loci) of FLIP by electroporation technique. The level of FLIP mRNA expression before and after interfering was detected by semi-quantitative polymerase chain reaction (PCR). The specificity and time effect for interference and the interfering effect between the two siRNAs were compared. Then the cells were treated with agonistic anti-Fas antibody to induce apoptosis. The apoptosis before and after interfering was determined by Annexin V and DNA degration.
RESULTS: The level of FLIP mRNA in HT-29 cells was inhibited by the specific siRNAs. The decrease of FLIP mRNA expression began to appear 24 hours after transfection. And the most apparent interfering efficiency was 65.02% 48 hours after transfection, which was markedly higher than that in the cells transfected with the control siRNAs. Both siRNAs (siRNA-F1 and siRNA-F2) from different loci had interfering effect on FLIP mRNA expression, but there was no significant difference between them. Compared with those in non-transfected cells (1.76%), the apoptotic rates were significantly higher in siRNA transfected cells (29.50%) after treated with agonistic anti-Fas antibody.
CONCLUSION: Small interfering RNA of FLIP can markedly decrease the expression of FLIP mRNA and sensitize the Fas-mediated apoptosis of colorectal cancer cell line HT-29. The RNA interfering technique targeted on FLIP may provide a new method in the gene therapy of colorectal cancer.
- Citation: Sun BC, Zang FL, Niu RF, Wei XY, Zhao XL, Zhang SW. Effect of FLIP small interfering RNA on apoptosis of colorectal cancer cells. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1519-1523
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1519.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1519
FLIP(FADD-like IL-1β converting enzyme inhibitory protein)是近年来发现的一类凋亡抑制蛋白.现已证实, FLIP的高表达与恶性黑色素瘤[1]、Burkitt淋巴瘤[2]、卡波氏肉瘤[3]等的发生、发展具有密切相关性.FLIP在蛋白水平上包括短型FLIP(FLIPS)和长型FLIP(FLIPL)2种形式, 前者只含有2个与caspase-8相似的死亡效应域(DED), 后者除此之外还含有一个caspase同源结构域, 但其中具有催化功能的半胱氨酸残基被酪氨酸残基所取代[4].因此, 虽然2种形式的蛋白均缺乏蛋白水解酶活性, 但FLIPL 与caspase-8在结构上似乎更为相近.本研究以大肠癌细胞为研究对象, 采用新近发现的RNA干扰技术, 将对应FLIPL的干扰性小RNA(small interfering RNA, siRNA)片段转染入细胞, 观察肿瘤细胞对Fas介导的凋亡敏感性的变化, 以期为肿瘤的基因治疗提供新的靶点和思路.
siRNA片段: 对应FLIPL选用2对大小为20 nt的siRNA片段, 化学合成法制备, 由德国Stuggart大学Harald Wajant教授惠赠, 对应序列: siRNA-F1(FLIPL 472-492): 正义5'-ACAUUAGGUGGAACCACAUCU-3', 反义5'-AGAUGUGGUUCCACCUAAUGU-3'; siRNA-F2(FLIPL 908-928): 正义5'-GUAACUUGUCCCUGCUCCUUG-3', 反义5'-CAAGGAGCAGGGACAAGUUAC-3'[5].对应Ι型人类T细胞白血病病毒转录激活区(HTLV-1 Tax), 选用一条siRNA片段(siRNA-H), 由国家新药筛选中心李佳副研究员惠赠, 对应序列: 正义5'-GAUGGACGCGUUAUCGGCU-3', 反义5'-AGCCGAUAAC GCGUCCAUC-3'.经BLAST检索, 该片段与FLIPL之间不存在同源性, 故可作为非相关对照.主要试剂及仪器: Hypo-osmolar电穿孔缓冲液购自Eppendorf公司; ImProm-ⅡTM反转录酶购自Promega公司, 其余RT-PCR试剂购自TaKaRa公司; 凋亡诱导型小鼠抗人Fas单抗(CH-11)、Annexin V-FITC凋亡检测试剂盒购自Beckman Coulter公司.电穿孔仪(Eppendorf Multiporator型), PCR仪(Perkin Elemer GeneAmp PCR System 9700型), 凝胶成像分析仪(Kodak 440CF型), 流式细胞仪(Beckman Coulter公司EPICS-XL型).
1.2.1 细胞培养: 大肠癌细胞株HT-29由天津肿瘤医院中心实验室保存, 常规培养在含100 mL/L胎牛血清、青霉素100 U/mL、链霉素100 mg/L的RPMI1640培养基中, 培养条件为37℃、50 mL/L CO2饱和湿度.
1.2.2 转染细胞: 取对数生长期的HT-29细胞, 胰酶消化, 重悬于含5 mL/L胎牛血清的RPMI 1640培养液中, 计数106个细胞, 800 r/min离心, 以800 μL的Hypo-osmolar电穿孔缓冲液轻柔重悬, 室温静置25 min, 加入100 nmol/L的siRNA片段, 于500 V、70 μs条件下电穿孔(4 mm gap width电转杯).电转后室温静置5-10 min, 接种于6孔板(每个转染条件接种3个复孔), 每孔加入2.5 mL含100 mL/L胎牛血清的RPMI 1640培养液, 37℃培养, 4 h后更换常规培养液, 继续培养.实验中, 以未经任何处理的细胞为对照, 并设仅施以电穿孔组和转染非相关片段(HTLV-1 Tax)组.
1.2.3 RT-PCR: 于转染后24、48、72 h, 收集细胞, PBS洗涤, 以TRIZOL试剂(Gibco公司)提取总RNA, 逆转录, 并进行PCR扩增(按试剂说明操作).FLIPL上游引物: 5'-ACCGAGACTACGACAGCTTTGTG-3', 下游引物: 5'-CAATGTGAAGATCCAGGAGTGGG-3', 扩增产物大小为429 bp[6]; 内参照β-actin上游引物: 5'-ATCATGTTTGAGACCTTCAACA-3', 下游引物: 5'-CATCTCTTGCTCGAAGTCCA-3', 扩增产物大小为318 bp.PCR反应条件为: 94℃预变性3 min; 94℃变性45 s, 65℃退火45 s, 72℃延伸2 min, 共35个循环, 最后72℃延伸7 min.扩增产物经13 g/L琼脂糖凝胶电泳, 并用Kodak 440凝胶成像系统进行灰度扫描密度分析, 计算目的基因的相对含量及干扰效率.目的基因相对含量(%) = 目的基因Net.Int./β-actin Net.Int.×100%; 干扰效率 = [未处理组FLIP相对含量(%)-处理组FLIP相对含量(%)]/未处理组FLIP相对含量(%)×100%.
1.2.4 凋亡检测: 以凋亡诱导型小鼠抗人Fas单抗(CH-11)刺激细胞, 37℃孵育16 h[6-7], 收集细胞, PBS洗涤2次.一方面, 取5×105个细胞加入5 μL Annexin V-FITC溶液(5 mg/L)和2.5 μL的PI溶液(250 mg/L), 轻轻混匀, 冰上避光孵育10 min.另一方面, 取106个细胞, 加入950 mL/L冷乙醇4℃过夜, 离心后加入含Rnase的PI染料(20 mg/L), 避光孵育30 min.2种不同方式处理后的细胞均经流式细胞仪检测, 计数凋亡细胞百分比.
1.2.5 重复性评价: 以上各种实验方法均独立进行3次以上.
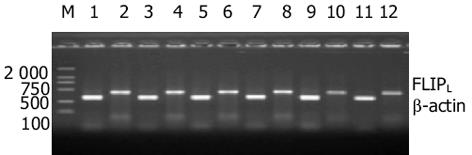
以siRNA-F2为外源片段, 转染细胞, 半定量RT-PCR检测发现, 与未处理的细胞相比, 仅进行电穿孔和转染siRNA-H的细胞中, FLIPL mRNA含量无明显变化, 而转染siRNA-F2后, FLIPL mRNA含量明显下降(图1), 最大干扰效率达65.02%; 于转染后24 h, FLIPL mRNA的含量已出现下降, 最显著的干扰作用出现在转染后48 h, 72 h后FLIPL mRNA的表达水平略有回升(表1).
| 条带 | 扩增基因 | 分子量(bp) | 净密度 | 相对含量(%) | 干扰效率(%) | |
| 未处理组 | 1 | β-actin | 319.4 | 7 381.73 | ||
| 2 | FLIPL | 444.4 12 | 957.70 | 78.55 | ||
| 仅电穿孔组 | 3 | β-actin | 319.4 | 18 209.25 | ||
| 4 | FLIPL | 430.6 | 13 073.23 | 71.79 | 8.61 | |
| siRNA-H | 5 | β-actin | 319.4 | 17 978.57 | ||
| 6 | FLIPL | 430.6 | 13 117.16 | 72.96 7.12 | ||
| 24 h组 | 7 | β-actin | 319.4 | 18 726.56 | ||
| 8 | FLIPL | 430.6 | 9 492.42 | 50.69 | 35.47 | |
| 48 h组 | 9 | β-actin | 305.6 | 20 367.85 | ||
| 10 | FLIPL | 430.6 | 5 597.09 | 27.48 | 65.02 | |
| 72 h组 | 11 | β-actin | 305.6 | 19 230.38 | ||
| 12 | FLIPL | 416.7 | 6 146.03 | 31.96 | 59.31 |
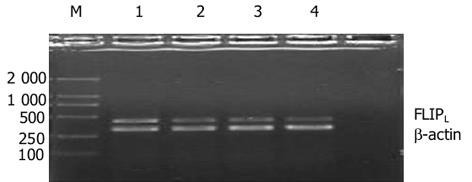
分别转染siRNA-F1、siRNA-F2以及二者的等量混合物, 收集转染48 h后的细胞, 进行半定量分析.结果发现, 转染3种不同类型的siRNA均可对FLIP产生干扰效果(图2); 相对而言, siRNA-F2的干扰作用(64.73%)略强于siRNA-F1(50.39%)以及二者的等量混合物(54.68%), 但彼此间差别不大(表2).
| 条带 | siRNAs | 扩增基因 | 分子量(bp) | 净密度 | 相对含量(%) | 干扰效率(%) |
| 1 | 未处理组 | β-actin | 343.7 | 30 484.50 | ||
| FLIPL | 437.5 | 23 768.76 | 77.97 | |||
| 2 | siRNA-F1 | β-actin | 328.1 | 26 850.23 | ||
| (100 nmol/L) | FLIPL | 437.5 | 10 385.67 | 38.68 | 50.39 | |
| 3 | siRNA-F2 | β-actin | 328.1 | 28 411.53 | ||
| (100 nmol/L) | FLIPL | 453.1 | 7 813.17 | 27.50 | 64.73 | |
| 4 | F1(50 nmol/L) | β-actin | 343.7 | 29 146.41 | ||
| +F2(50 nmol/L) | FLIPL | 453.1 | 10 300.34 | 35.34 | 54.68 |
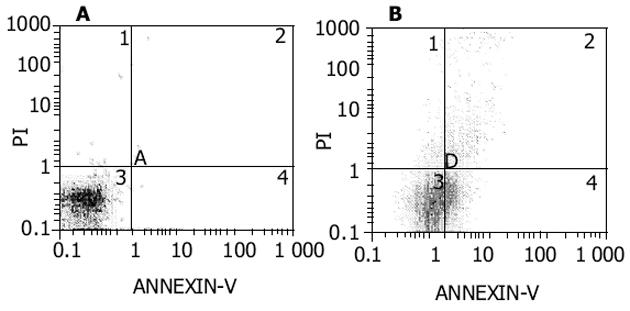
2.3.1 AnnexinV染色法判断胞膜的改变: 与未处理的HT-29细胞相比, 转染siRNA-F2后细胞在各成分的组成上发生了明显的变化(图3).其中, 活细胞所占比例下降, 凋亡细胞和死细胞所占比例上升, 且凋亡细胞在细胞总体中所占的比例上升得尤为显著, 由1.76%升至29.5%(表3).
| 细胞类型 | 活细胞(%) | 凋亡细胞(%) | 坏死细胞及碎屑(%) |
| 未处理 | 96.7 | 1.76 | 0.35 |
| 转染siRNA-F2 | 63.5 | 29.50 | 5.04 |
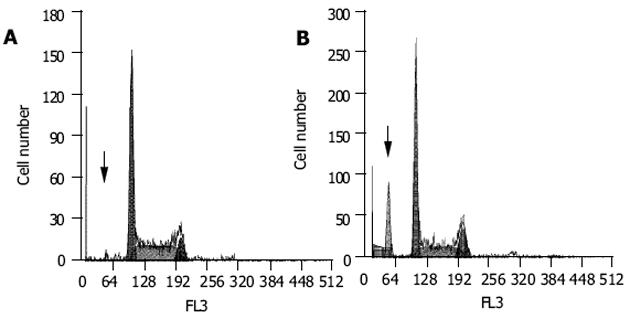
2.3.2 DNA降解片段: 转染siRNA后的细胞在G0/G1期前, 出现了明显的亚二倍体峰, 经软件分析确认其为凋亡峰; 未处理组中虽也存在一凋亡峰, 但峰值显然很低(图4).
FLIP作为新近发现的凋亡相关因子, 由于其与caspase-8在结构上具有相似性, 故可竞争性与Fas相关死亡结构域(FADD)结合, 阻断caspase蛋白酶级联反应, 从而抑制Fas、TNFR-1、DR5、TRAILR等死亡受体介导的凋亡.到目前为止, FLIP对大肠癌的凋亡抑制作用尚未见报道.在本研究中, 我们采用RNA干扰技术, 将对应FLIPL的siRNA片段转染入大肠癌细胞株HT-29, 在mRNA水平上封闭其表达, 从而推测大肠癌中FLIPL在Fas介导的凋亡途径上起重要作用.RNA干扰是由双链RNA始动的、序列特异性转录后基因沉默现象, 主要通过双链RNA被核酸酶切割成约21-25 nt大小的RNA双链复合物, 即siRNA介导识别并靶向切割同源性靶mRNA分子而实现[8].研究发现, 转染对应FLIPL的siRNA片段可特异性降低目的基因的mRNA水平, 而转染非同源的、对应HTLV-1 Tax的siRNA-H却几乎不产生任何干扰作用, 充分证实了RNA干扰的高度特异性.此外, 对应某一基因可能设计出许多对siRNA, 但并非所有的片段都能产生高效的沉默作用.因此, 设计、选择最佳的siRNA片段已成为RNA干扰研究的关键点之一.在目前的RNA干扰实验中, 常需设计3-5对不同的siRNA片段, 逐一实验以确定最有效的封闭位点.在本实验中, 转染100 nmol/L的siRNA-F1、siRNA-F2 48 h后, 干扰效率分别为50.39%和64.73%, 这提示对应这2个不同位点的siRNA片段均具有一定强度的基因沉默功能.Abedini et al[9]将对应另外4个不同位点的siRNA片段转染入人类卵巢癌细胞株, 也达到了较好的封阻效果.但这种封阻能力的相接近性是否与细胞类型、FLIPL表达水平等因素有关, 还有待于进一步探讨.
siRNA封阻FLIPL mRNA表达后, 以凋亡诱导型抗体激活细胞, 通过检测凋亡早期细胞膜表面磷脂酰丝氨酸的变化, 并结合DNA降解片段分析, 发现RNA干扰组的细胞对Fas介导的凋亡敏感性明显上升, 从反向基因功能研究的角度证实在大肠癌细胞中FLIP对Fas介导的凋亡受体通路起到了阻断作用.目前, 对于这种阻抑作用的机制仍未得到清晰的阐释.比较公认的观点是: FLIP主要通过阻断凋亡途径中的关键因子-caspase-8的剪切和活化, 起到抑制凋亡的作用.进一步研究发现, caspase-8的活化由连续的两步酶切水解作用完成: 第一步反应依靠分子内部的蛋白酶即可完成, 但需要来自另一分子的caspase样区域作为其补足集团, 该集团可以来自具有催化活性的caspase-8, 也可以来自无催化活性的FLIPL; 第二步反应则通过分子间的相互作用才能完成, 此时作为补足集团的caspase区域必须具有活性.因而当FLIPL过表达时, 胞质中可检测到第一步酶切产物caspase-8的p10亚基和FLIPL的p12亚基, 而检测不到caspase-8的第二步酶切产物p18亚基, 无法形成完整的caspase-8活性形式, 从而阻断了后续的蛋白酶级联反应[10].
本研究将特异性siRNA片段转染入肿瘤细胞, 为大肠癌细胞中存在RNA干扰现象提供了实验依据; 更重要的是, 封闭FLIP的表达后, 可显著提高大肠癌细胞对Fas介导的凋亡敏感性, 提示以FLIP为靶点的RNA干扰技术可望成为肿瘤基因治疗的新途径.
感谢Harald Wajant教授(University of Stuggart, Stuggart, Germany)和李佳副研究员(国家新药筛选中心, 上海, 中国)为本研究提供所需的特异性siRNAs片段.
编辑: 王谨晖 审读: 张海宁
| 1. | Bullani RR, Huard B, Viard-Leveugle I, Byers HR, Irmler M, Saurat JH, Tschopp J, French LE. Selective expression of FLIP in malignant melanocytic skin lesions. J Invest Dermatol. 2001;117:360-364. [PubMed] [DOI] |
| 2. | Tepper CG, Seldin MF. Modulation of caspase-8 and FLICE-inhibitory protein expression as a potential mechanism of Epstein-Barr virus tumorigenesis in Burkitt's lymphoma. Blood. 1999;94:1727-1737. [PubMed] |
| 3. | Sturzl M, Hohenadl C, Zietz C, Castanos-Velez E, Wunderlich A, Ascherl G, Biberfeld P, Monini P, Browning PJ, Ensoli B. Expression of K13/v-FLIP gene of human herpesvirus 8 and apoptosis in Kaposi's sarcoma spindle cells. J Natl Cancer Inst. 1999;91:1725-1733. [PubMed] [DOI] |
| 4. | Irmler M, Thome M, Hahne M, Schneider P, Hofmann K, Steiner V, Bodmer JL, Schroter M, Burns K, Mattmann C. Inhibition of death receptor signals by cellular FLIP. Nature. 1997;388:190-195. [PubMed] [DOI] |
| 5. | Siegmund D, Hadwiger P, Pfizenmaier K, Vornlocher HP, Wajant H. Selective inhibition of FLICE-like inhibitory protein expression with small interfering RNA oligonucleotides is sufficient to sensitize tumor cells for TRAIL-induced apoptosis. Mol Med. 2002;8:725-732. [PubMed] |
| 6. | Nagaraju K, Casciola-Rosen L, Rosen A, Thompson C, Loeffler L, Parker T, Danning C, Rochon PJ, Gillespie J, Plotz P. The inhibition of apoptosis in myositis and in normal muscle cells. J Immunol. 2000;164:5459-5465. [PubMed] [DOI] |
| 7. | Johnson DE, Gastman BR, Wieckowski E, Wang GQ, Amoscato A, Delach SM, Rabinowich H. Inhibitor of apoptosis protein hILP undergoes caspase-mediated cleavage during T lymphocyte apoptosis. Cancer Res. 2000;60:1818-1823. [PubMed] |
| 8. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] [DOI] |
| 9. | Abedini MR, Qiu Q, Yan X, Tsang BK. Possible role of FLICE-like inhibitory protein (FLIP) in chemoresistant ovarian cancer cells in vitro. Oncogene. 2004;23:6997-7004. [PubMed] [DOI] |
| 10. | Krueger A, Baumann S, Krammer PH, Kirchhoff S. FLICE-inhibitory proteins: regulators of death receptor-mediated apoptosis. Mol Cell Biol. 2001;21:8247-8254. [PubMed] [DOI] |