修回日期: 2005-04-17
接受日期: 2005-05-06
在线出版日期: 2005-07-15
目的: 建立一人直肠癌细胞系并探讨其生物学特性.
方法: 取人直肠癌新鲜手术标本, 经组织块体外培养并克隆建系, 命名为HRC-99.采用光镜、电镜、免疫组化、染色体核型分析及异种移植瘤实验对细胞系生物学特性进行观察.
结果: 原位肿瘤、细胞系及移植瘤标本经光镜、电镜证实该细胞系具有腺上皮性恶性细胞特征, 并观察了其体外生长曲线、倍增时间和分裂指数; 免疫组化CEA和CK-20呈阳性表达; 染色体核型分析众数为60, 为亚三倍体, G显带出现标记染色体和染色体易位; 裸鼠皮下异种移植形成移植瘤.
结论: HRC-99为一株新的来源于直肠中分化腺癌的细胞系.
引文著录: 郑雪莲, 周总光, 辜俊, 李红光, 林立, 邓伊伶. 人直肠腺癌细胞系HRC-99的建立及其生物学特性. 世界华人消化杂志 2005; 13(13): 1510-1513
Revised: April 17, 2005
Accepted: May 6, 2005
Published online: July 15, 2005
AIM: To establish a cell line from human moderately differentiated rectal adenocarcinoma, and to investigate its biological characteristics.
METHODS: Cancer tissues taken from freshly resected specimens of patients with primary rectal adenocarcinoma were incubated in vitro. The cell line, we named HRC-99, was established. The biological characteristics of these cells were studied by light microscopy, electron microscopy, immunohistochemistry, chromosome analysis and heterogenic transplantation experiment.
RESULTS: Cells from specimens of the primary tumor, the HRC-99 cell line and transplanted tumor were confirmed possessing the characteristics of malignant glandular epithelium under light and electron microscope. The cell growth curve, duplicating time and cleavage index in vitro were also observed. CEA and CK-20 were positively expressed in the cells. Nuclear chromosome analysis revealed that the tumor was a subtriploid with a mode of 60 per cell, and marker chromosome and chromosome translocation were found in G band as well. Tumor nodes were induced under the skin of nude mice by heterogenic transplantation.
CONCLUSION: The HRC-99 cell line is a new cell line out of rectal moderately differentiated adenocarcinoma.
- Citation: Zheng XL, Zhou ZG, Gu J, Li HG, Lin L, Deng YL. Establishment and characterization of a cell line HRC-99 from human rectal adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(13): 1510-1513
- URL: https://www.wjgnet.com/1009-3079/full/v13/i13/1510.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i13.1510
直肠癌是最常见的消化道恶性肿瘤之一, 发病率逐年上升[1-3], 其病因及生长因素与其他肿瘤一样尚不清楚.对直肠癌的深入研究需要建立一系列具有不同生物学特性的细胞系[4-5].目前, 国内外报道的直肠癌细胞株较少[9-13], 不能满足实验研究需要, 为了进一步探索直肠癌的特性并满足实验研究需要, 我们建立了来源于人直肠中分化腺癌的细胞系, 并进行了克隆, 建立了HRC-99细胞株, 探讨了其部分生物学特性.
肿瘤组织来源于一女性直肠癌患者, 46岁, 术前纤维结肠镜检确诊为直肠腺癌.于2004-09-06由四川大学华西医院普外三科行直肠癌根治术, 我们将一部分标本送本院病理会诊中心作病理诊断, 一部分标本送消化外科研究室作原代培养.术后病理诊断: 直肠中分化腺癌.本研究采用的主要试剂有: FBS、DMEM/F12(1∶1混合)培养液、RPMI 1640培养液、丙酮酸钠、多聚赖氨酸(GIBCO公司); 胰岛素和EGF(Sigma公司); 角蛋白CK-20和癌胚抗原CEA(DAKO公司).液体配制: (1)洗液: PBS液+青霉素5 000 U/L+链霉素5 mg/L+两性霉素30 mg/L; (2)原代培养液: DMEM/F12培养液+FBS 200 mL/L+L-谷氨酰胺2 mmol/L+胰岛素10 μg/L+EGF 200 ng/L+丙酮酸钠1.1 mg/L+青霉素4 000 U/L+链霉素4 mg/L; (3)传代培养液: RPMI1640培养液+FCS 100 mL/L + L-谷氨酰胺2 mmol/L+青霉素1 000 U/L+链霉素1 mg/L.
在无菌条件下迅速切取术后直肠癌标本中的癌组织, 用无菌生理盐水冲洗3次, 立即浸泡在4℃加5倍抗菌素的无菌PBS液中, 迅速送至实验室, 用PBS洗液冲洗三次, 参见薛庆善[4]肿瘤组织细胞的原代培养方法, 将组织块接种于25 cm2的一次性塑料培养瓶中, 放入培养箱贴壁培养4 h后, 加入原代培养液, 培养液的量以不使植块浮起为准, 置37℃ 50 mL/L CO2培养箱内静置培养, 根据培养液pH变化, 每2-3 d进行半量换液.组织块培养38 d, 光镜观察到在部分癌组织边缘有细胞伸出, 待细胞分裂繁殖汇合成片后, 于培养49 d第1次传代.每次传代用胰酶2.5 g/L +乙二胺四乙酸二钠100 mg/L混合液原瓶消化, 利用差速黏附法去除成纤维细胞.经第3次传代后, 细胞较纯上皮样, 生长速度稳定, 基本每隔3 d传代1次, 传至20代时用无限稀释法进行克隆, 然后每隔5代冻存1批, 每隔1 mo复苏1支, 至目前已传至50代, 经多次冻存、复苏培养, 细胞均能生长增殖.在倒置显微镜下观察培养中的活细胞形态, 取对数生长期的传代培养细胞, 离心固定后送四川大学电镜室包埋和超薄切片, 在H-600IV型透射电镜下观察并摄影.第10代细胞制成悬液后计数, 然后平均分配于8个25 cm2培养瓶中, 每天取一瓶观察并计数, 绘制生长曲线, 求得细胞的群体倍增时间.将25代细胞培养1-7 d的细胞盖片, 逐日将盖片取出, 固定, Giemsa染色, 在光镜下计算有核分裂的细胞数.将生长于用100 g/L多聚赖氨酸处理的盖玻片上的细胞用预冷丙酮固定15 min, 室温晾干后, 采用SABC法对细胞进行CK-20和CEA免疫组化抗体染色.将14代的2×106个细胞分别接种于裸鼠前、后肢腋窝皮下, 1 wk后观察, 有皮下结节形成者为阳性, 将移植瘤做常规病理组织学检查.取传代后生长48 h的第3, 50代细胞, 按鄂征[5]培养细胞的染色体显示法, 对染色体进行G带核型分析.
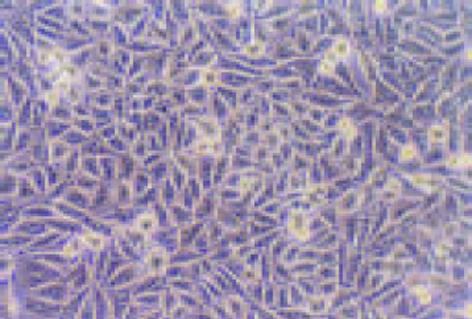
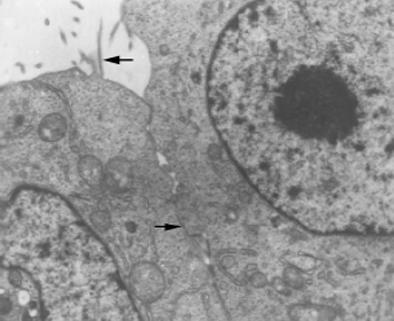
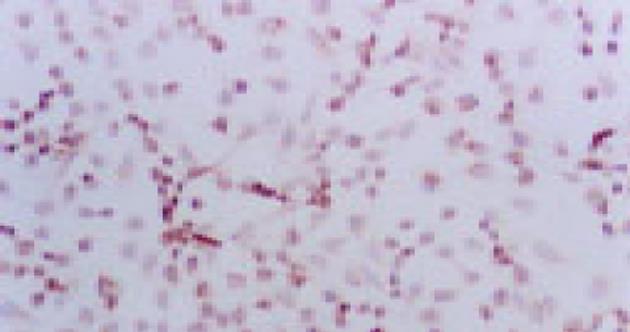
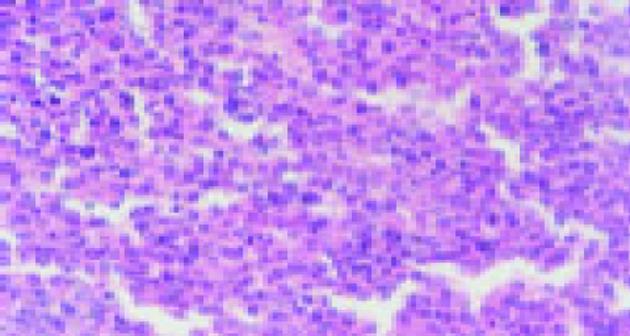
在倒置显微镜下可直接观察.活细胞经传代, 一般在12-24 h大都贴壁, 细胞呈不规则多角形, 少数为梭形及圆形, 生长密集时呈镶嵌排列(图1).生长在盖玻片上的细胞经Giemsa染色后, 多数细胞呈多边形, 梭形, 少数呈圆形; 胞质丰富, 淡粉色, 可见分泌颗粒及空泡; 核椭圆形, 圆形, 核浆比例增大(接近1:1), 核仁清晰可见1-4个不等.透射电镜观察, 结果显示细胞核较大, 呈椭圆形, 圆形, 有多个核仁, 染色质分布均匀, 常染色质较丰富, 胞质内有丰富的核糖体、线粒体、粗面内质网、溶酶体等细胞器, 清晰可见, 细胞表面有许多微绒毛, 可见细胞间紧密联接(图2).免疫组化染色见癌细胞的胞质均被染成棕黄色, CEA表达强阳性, CK-20阳性, 证实为腺上皮来源的癌细胞(图3).传代接种细胞后, 1-2 d增殖较慢, 3-5 d细胞增殖逐日上升, 7 d达高峰, 8 d开始下降, 按Patterson公式计算, 细胞的群体倍增时间为24.8 h.细胞分裂指数在培养3 d的细胞达最高峰, 为49.2%, 细胞培养4 d后分裂指数逐日下降.
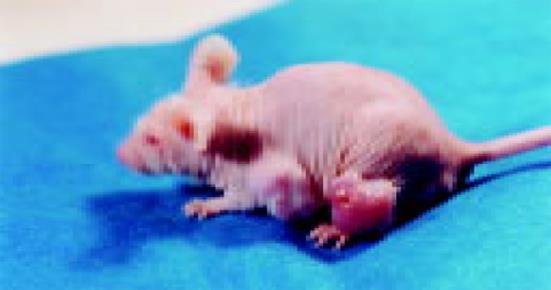
接种于裸鼠前、后肢的癌细胞, 8 d后在接种处见长出黄豆大小的肿块, 质软, 呈圆形结节状, 裸鼠4 wk时的成瘤性(图4).处死裸鼠称质量, 均值为1.6 786 g, 瘤均体积为2.16 cm3, 病理组织学检查, 可见癌细胞生长旺盛呈片状, 核分裂相多, 细胞核不均匀增大(图5), 与该患者原肿瘤标本病理结果基本一致.
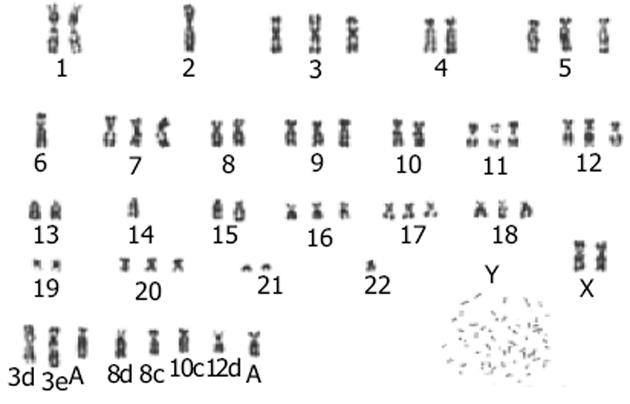
将第3, 50代细胞各分析20个中期细胞核型, 观察到染色体数目主要分布于57-62之间, 染色体众数为60, 多为亚三倍体.染色体G带核型分析几乎在每个核型里发现了结构异常的标记染色体, 有6个标记染色体在所分析的核型里, 出现频率高达100%(图6).另外, 在多数核型里发现t(10, 14)和t(1, 17)易位, 在个别核型里还观察到双着丝点染色体.
直肠癌是消化道最常见恶性肿瘤之一, 在我国近几年来其发病率、死亡率都有上升趋势[1-3], 发病年龄也有明显提前[2,6], 其病因及生长因素与其他肿瘤一样尚不清楚.对直肠癌的深入研究需要建立一系列具有不同生物学特性的细胞系, 按常规方法建立体外培养的人类癌细胞系, 一般成功率较低, 而肠道肿瘤建系更为困难, 因肠道属于开放性器官, 造成污染机会比较大, 不易成功.国内外迄今为止, 仅见少数几例报道[9-13], 而国内报道的3例细胞系中, 有2例细胞系来源于结肠腺癌, 其中SIC-8101[8]为低分化腺癌; THC-8908[12]为高分化腺癌; 另1例来源于直肠的HR-8348[13], 为低分化腺癌, 而我们建立的HRC-99细胞系来源于直肠中分化腺癌, 这一新细胞系的建立有利于直肠癌的深入研究.我们自2004-05起, 先后用45例人直肠癌标本做原代培养, 每例均采用了组织块培养法和酶消化法, 最后建系成功的2例标本, 均为组织块培养法培养.酶消化法分离的癌细胞, 数量少, 而成纤维细胞多, 细胞排列稀疏, 培养到6-8 d, 细胞体积增大, 胞质出现空泡状变性, 细胞难以汇合成单层, 同时可见体积较大的巨型细胞, 最后形成"拉网"而自然脱落死亡.而采用组织块培养法, 不但减少了操作步骤, 节约了成本, 而且还降低了污染机率, 只是癌细胞在体外的适应期较长.本实验在38 d时才见细胞从组织块边缘长出, 一旦长出癌细胞便迅速生长分裂增殖, 并能传代建系.我们建立的HRC-99细胞系具有以下特点: (1)培养细胞形态, 超微结构及生长特性均显示恶性上皮细胞特征; (2)角蛋白和癌胚抗原免疫组化染色均呈阳性反应; (3)染色体分析, 众数为60, 为亚三倍体; G带核型分析染色体结构异常, C组和E组染色体明显增多, 并发现6个标记染色体; (4)裸鼠经接种细胞后产生移植瘤, 其病理组织学特征与患者行根治术时原发肿瘤的特征一致.根据以上特点, 可以初步确认HRC-99为一新的来源于直肠中分化腺癌的细胞系.
癌胚抗原(carcinoembryanic antigen, CEA)正常情况下仅存在于胚胎组织中, 但在一些肿瘤组织-如胃肠道肿瘤中常见其表达, 因而可作为肿瘤的特异标记物, 在诊断和鉴别诊断上具有重要价值.研究表明, 70%以上的直肠癌组织CEA呈阳性表达[12-17], 本细胞系免疫组化染色发现CEA呈强阳性表达, CK-20阳性, 证实为腺上皮来源的癌细胞; 经异种移植瘤实验更证明了本细胞系的恶性特征; 染色体G带核型分析几乎在每个核型里发现了结构异常的标记染色体, 有6个标记染色体在所分析的核型里, 出现频率高达100%, 另外, 在多数核型里发现t(10, 14)和t(1, 17)易位, 在个别核型里还观察到双着丝点染色体.这是否与直肠癌的发生发展有关, 有待对该细胞系从分子遗传水平上做更深入的研究.细胞和分子遗传学方法的结合将为最终阐明染色体畸变在直肠癌发生发展中的意义提供有力的帮助.
编辑: 潘伯荣 审读: 张海宁
| 1. | Zhang YL, Zhang ZS, Wu BP, Zhou DY. Early diagnosis for colorectal cancer in China. World J Gastroenterol. 2002;8:21-25. [PubMed] [DOI] |
| 2. | Zheng S, Liu XY, Ding KF, Wang LB, Qiu PL, Ding XF, Shen YZ, Shen GF, Sun QR, Li WD. Reduction of the incidence and mortality of rectal cancer by polypectomy: a prospective cohort study in Haining County. World J Gastroenterol. 2002;8:488-492. [PubMed] [DOI] |
| 3. | Zhou ZG, Wang Z, Yu YY, Shu Y, Cheng Z, Li L, Lei WZ, wangTC . Laparoscopic total mesorectal excision of low rectal cancer with preservation of anal sphincter: A report of 82 cases. World J Gastroenterol. 2003;9:1477-1481. [PubMed] [DOI] |
| 4. | Okabe S, Arai T, Yamashita H, Sugihara K. Adenovirus-mediated prodrug-enzyme therapy for CEA-producing colorectal cancer cells. J Cancer Res Clin Oncol. 2003;129:367-373. [DOI] |
| 5. | Li S, Yu B, An P, Chen G, Lu W, Cai H, Guo W, Zuo F. Combined liposome-mediated cytosine deaminase gene therapy with radiation in killing rectal cancer cells and xenografts in athymic mice. Clin Cancer Res. 2005;11:3574-3578. [DOI] |
| 6. | 薛 庆善. 体外培养的原理和技术. 北京: 科学出版社 2001; 710-711. |
| 7. | 鄂 征. 组织培养和分子细胞学技术. 北京: 北京出版社 1995; 164-165. |
| 9. | Kokuba Y, Otani Y, Kakita A, Yamashita K. Establishment of alpha-fetoprotein producing human rectal cancer cell line (RKK-YK) and its features. Nippon Shokakibyo Gakkai Zasshi. 1999;96:809-816. [PubMed] |
| 10. | Shibusawa M, Tsunoda Y, Tsunoda A, Yoshizawa H, Nakao K, Yasuda N, Choh H, Numabe K, Koike T. Establishment and characterization of a human rectal cancer cell line, SRM from primary diffuse infiltrating type cancer. Hum Cell. 1993;6:57-61. [PubMed] |
| 11. | Morita A, Tsao D, Kim YS. Effect of sodium butyrate on alkaline phosphatase in HRT-18, a human rectal cancer cell line. Cancer Res. 1982;42:4540-4545. [PubMed] |
| 15. | Wu WX, Sun YW, Hua YB, Shen LZ. Laparoscopic versus conventional open resection of rectal carcinoma: A clinical comparative study. World J Gastroenterol. 2004;10:1167-1170. [PubMed] |