修回日期: 2005-03-25
接受日期: 2005-04-01
在线出版日期: 2005-06-28
目的: 研究Survivin ASODN联合三氧化二砷(As2O3)对食管鳞癌细胞系EC109凋亡的影响.
方法: 设计合成特异性Survivin反义寡核苷酸(ASODN).细胞分成6组: 空白对照组、空脂质体转染对照组、正义链转染对照组、160、200、240 nmol/L 反义链转染组.以阳离子脂质体为载体转染至EC109细胞内, 用Western blot法检测各组细胞Survivin蛋白表达情况; TUNEL法检测细胞凋亡情况; MTT法检测As2O3和5-氟尿嘧啶(5-Fu)对转染前后细胞的生长抑制情况.
结果: 各浓度ASODN 转染组癌细胞Survivin蛋白表达有不同程度减少, 而各对照组细胞Survivin蛋白表达无明显变化.各ASODN 转染组细胞凋亡指数明显高于各对照组(5.48±1.56, 6.04±1.95, 11.92±1.76 vs 1.52±0.73, P<0.05), 以240 nmol/L转染组明显高于160和200 nmol/L组(11.92±1.76% vs 5.48±1.56%, 6.04±1.95%, P<0.05).240 nmol/L转染组中As2O3对肿瘤细胞生长抑制率明显高于5-Fu组(56.40±1.27% vs 43.49±0.83%, P<0.05).
结论: Survivin ASODN转染食管鳞癌细胞能下调Survivin蛋白的表达, 诱导食管鳞癌细胞凋亡, 抑制细胞增值, 增加食管鳞癌细胞对化疗药物As2O3的敏感性.
引文著录: 赵晶, 刘铁夫, 董春燕, 博挽澜. 反义Survivin诱导食管鳞癌细胞凋亡. 世界华人消化杂志 2005; 13(12): 1447-1449
Revised: March 25, 2005
Accepted: April 1, 2005
Published online: June 28, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1447-1449
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1447.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1447
Survivin是新近发现的一种抗凋亡因子[1], 针对此基因的反义核酸能够诱导细胞自发性凋亡和明显抑制肿瘤的生长, 为肿瘤的基因治疗提供了新的靶位.As2O3是我国传统中药砒霜的主要成分, 近年As2O3用于急性早幼粒白血病(APL)临床治疗收到良好的疗效, 其在治疗实体瘤方面的研究也取得了一定的成果[2].为探讨靶向Survivin在食管鳞癌治疗中的意义和价值以及As2O3在食管鳞癌化疗方面的应用, 我们设计合成Survivin反义寡核苷酸(antisense oligonucleotide, ASODN), 将Survivin ASODN转染至食管鳞癌细胞株EC109中, 观察不同浓度的ASODN对食管鳞癌细胞凋亡的影响, 以及转染后食管鳞癌细胞对As2O3敏感性的变化.
人食管鳞癌细胞株EC109购自中科院上海细胞所, 用含10 mL/L小牛血清的RPMI 1640培养液常规条件下培养.阳离子脂质体(Oligofectamine Reagent)购自Invitrogen公司.
1.2.1 细胞转染: 根据Survivin的mRNA序列[3], 设计合成Survivin mRNA 232-251序列的20个碱基组成的ASODN链, 序列为: 5'-CCC AGC CTT CCA GCT CCT TG-3', 并同时合成正义链, 均全程硫代修饰, 反义链5'端以荧光蛋白标记.全部寡核苷酸均由上海生工公司合成.取对数生长期的食管鳞癌EC109细胞, 分设对照组和160、200和240 nmol/L ASODN转染组.转染过程按照转染试剂盒说明书进行, 24 h后收集各组细胞用于后续实验.
1.2.2 Western blot法检测食管鳞癌细胞系: Survivin蛋白表达 各组细胞胰酶消化离心后裂解, SDS-PAGE凝胶电泳分离, 一抗(兔抗人Survivin抗体)和二抗(辣根过氧化物酶标记的羊抗兔IgG)的稀释浓度分别为1∶500和1∶1 000, 用DAB染色法染色, 观察结果.
1.2.3 TUNEL法检测食管鳞癌细胞系的凋亡情况: 用多聚赖氨酸处理玻片, 转染后各组细胞爬片, 检测方法按照说明书进行.光学显微镜下分析结果, 凋亡指数(AI)计算方法: 数5个高倍镜>500个细胞, 分别计数凋亡细胞和总细胞数.凋亡指数(AI) = 凋亡细胞数/总细胞数×100%.
1.2.4 MTT法检测三氧化二砷对各组细胞的生长抑制率: 取对数生长期的待检各组细胞, 胰酶消化后用1640培养液配成1×107/L细胞悬液, 接种于96孔板内, 每孔200 μL上述细胞悬液, 每组细胞均设化疗药物As2O3(2 μmol/L)实验孔、5-Fu(1 mg/L)[4]实验孔和空白对照孔, 每组设置4个平行孔.常规条件下培养48 h, 每孔加入5 g/L MTT 20 μL, 继续培养4 h, 去上清液, 每孔加入DMSO 0.2 mL, 振摇10 min.用酶标仪在570 nm处检测各孔光密度(A)值, 计算细胞生长抑制率(IR) = (1-实验组A值/对照组A值)×100%.
统计学处理 实验结果用均数±标准差(mean±SD)表示, 用SPSS 12.0统计软件进行分析, 其中凋亡指数结果采用单因素方差分析, 生长抑制率结果用单变量双因素方差分析.
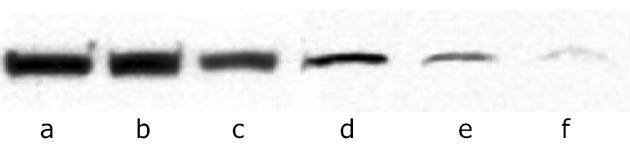
各浓度ASODN转染组Survivin蛋白表达有不同程度的下调, 以240 nmol/L转染组最明显.各对照组之间Survivin蛋白表达无明显变化(图1).
各浓度ASODN转染可不同程度诱导EC109细胞凋亡, 各ASODN转染组细胞凋亡指数明显高于各对照组(P<0.05), 以240 nmol/L ASODN组最为明显(P<0.05), 而各对照组间比较差异无显著性(P>0.05)(表1).
各组化疗药物对各浓度组ASODN转染的EC109细胞生长抑制率明显高于各对照组(P<0.05)(表1).
细胞凋亡是生物机体清除受伤细胞或无用细胞的一种生理机制, 是在进化上非常保守的细胞死亡程序, 而执行细胞凋亡的核心物质是一组半胱氨酸-天冬氨酸蛋白水解酶(caspase), 又称胱冬肽酶.机体在行使凋亡抑制作用时, 凋亡抑制蛋白发挥着极为重要的作用, 他主要包括Bcl-2家族中抗凋亡成员, 死亡受体阻断分子和凋亡抑制蛋白(IAP)家族.Survivin是凋亡抑制蛋白(inhibitor of apoptosis proteins, IAP)家族的新成员, 正常人主要见于胚胎和发育的胎儿组织, 但不见于终末分化的成人组织(胸腺和生殖腺除外), 当细胞发生转化或者细胞恶变时又重新获得表达, 在大多数肿瘤组织内均可检测到Survivin有不同程度的表达[5-6].Survivin与细胞周期调控和细胞凋亡的关系已经被大多数实验所证实[7-10].
目前国内外就反义核酸Survivin诱导肿瘤细胞凋亡的研究正在逐渐展开, 主要集中在白血病、胃癌[11]、肝癌[12]和胰腺癌[13]上, 而对食管鳞癌的研究尚未见报道.As2O3用于肿瘤治疗的研究是近几年开展起来的, 在治疗血液系统肿瘤中取得了良好的疗效.目前认为, 其可能的作用机制是通过线粒体依赖途径诱导肿瘤细胞凋亡[14].在实体瘤治疗方面的研究显示其对肺腺癌GLC-82, 胃腺癌MGC-803和SGC-7901、肝癌HepG-2, BEL-7402等肿瘤细胞系比较敏感, 而对食管鳞癌EC109敏感性稍差[15], 限制了As2O3在食管鳞癌治疗方面的应用.
我们将不同浓度的Survivin ASODN转染至食管鳞癌EC109细胞内, 观察转染后癌细胞的Survivin基因表达, 癌细胞凋亡情况和癌细胞对化疗药物As2O3的敏感性变化.Western Blot法结果显示各浓度ASODN转染组Survivin蛋白表达有不同程度的下调, 以240 nmol/L转染组最明显, 说明Survivin ASODN封闭了Survivin基因, 抑制了Survivin基因的表达.用TUNEL法检测转染后癌细胞的凋亡指数, 结果显示各浓度ASODN转染组癌细胞凋亡指数均增高, 和对照组比较有显著性差异, 并与ASODN浓度成正相关.由此可见, 封闭Survivin基因, 可减少Survivin蛋白的表达, 解除Survivin对凋亡的抑制作用, 从而在一定程度上恢复癌细胞的凋亡机制, 使癌细胞凋亡增多, 抑制了肿瘤的发展.
食管鳞癌细胞对As2O3不敏感, 限制他在食管鳞癌治疗方面的应用.本实验用Survivin ASODN转染食管鳞癌细胞后, 使癌细胞的凋亡机制在一定程度上有所恢复, 再给予化疗药物As2O3, 结果显示转染后食管鳞癌细胞对As2O3的敏感性增高, 与5-Fu组对比, 对肿瘤细胞的生长具有更显著的抑制作用, 这提示我们封闭Survivin基因表达和As2O3在诱导癌细胞凋亡方面具有协同作用, 但Survivin ASODN和As2O3在诱导肿瘤细胞凋亡方面的协同作用机制还有待于进一步的研究.
总之, 本实验的研究结果显示以Survivin作为靶位的基因治疗具有可行性, 并为As2O3在食管鳞癌治疗方面的应用奠定了一定的实验基础.
编辑: 张海宁
| 1. | Ambrosini G, Adida C, Altieri DC. A novel antiapoptosis gene, survivin, expression in cancer and lymphoma. Nature Med. 1997;3:917-921. [PubMed] [DOI] |
| 3. | Xia C, Xu Z, Yuan X, Uematsu K, You L, Li K, Li L, McCormick F, Jablons DM. Induction of apoptosis in mesothelioma cells by antisurvivin oligonucleotides. Mol Cancer Ther. 2002;1:687-694. [PubMed] |
| 4. | 韩 锐. 抗癌药物研究与实验技术. 第一版. 北京: 北京医科大学中国协和医科大学联合出版社 1997; 447-448. |
| 5. | Adida C, Crotty PL, McGrath J, Berrebi D, Diebold J, Altieri DC. Developmentally regulated expression of the novel cancer anti-apoptosis gene survivin in human and mouse differentiation. Am J Pathol. 1998;152:43-19. [PubMed] |
| 6. | Li F, Ambrosini G, Chu EY, Plescia J, Tognin S, Marchisio PC, Altieri DC. Control of apoptosis and mitotic spindle checkpoint by survivin. Nature. 1998;396:580-584. [PubMed] [DOI] |
| 7. | Suzuki A, Hayashida M, Ito T, Kawano H, Nakano T, Miura M, Akahane K, Shiraki K. Survivin initiates cell cycle entry by the competitive interaction with Cdk4/p16 (INK4a) and Cdk2/cyclin E complex activation. Oncogene. 2000;19:3225-3234. [PubMed] [DOI] |
| 8. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |
| 9. | Ito T, Shiraki K, Sugimoto K, Yamanaka T, Fujikawa K, Ito M, Takase K, Moriyama M, Kawano H, Hayashida M. Survivin promotes cell proliferation in human hepatocellular carcinoma. Hepatology. 2000;31:1080-1085. [PubMed] [DOI] |
| 10. | Shin S, Sung BJ, Cho YS, Kim HJ, Ha NC, Hwang JI, Chung CW, Jung YK, Oh BH. An anti-apoptotic protein human survivin is a direct inhibitor of caspase-3 and-7. Biochemistry. 2001;40:1117-1123. [PubMed] [DOI] |
| 11. | Yang JH, Zhang YC, Qian HQ. Survivin antisense oligodeoxynucleotide inhibits growth of gastric cancer cells. World J Gastroenterol. 2004;10:1121-1124. [PubMed] [DOI] |
| 12. | Cheng SQ, Wang WL, Yan W, Li QL, Wang L, Wang WY. Knockdown of survivin gene expression by RNAi induces apoptosis in human hepatocellular carcinoma cell line SMMC-7721. World J Gastroenterol. 2005;11:756-759. [PubMed] |
| 13. | 王 亚利, 宋 天保, 王 西京, 王 中卫, 宋 潍, 郝 小静. Survivin mRNA反义寡核苷酸诱导胰腺癌细胞凋亡. 世界华人消化杂志. 2004;12:1872-1874. [DOI] |
| 14. | Shen ZY, Shen WY, Chen MH, Shen J, Cai WJ, Yi Z. Nitric oxide and calcium ions in apoptotic esophageal carcinoma cells induced by arsenite. World J Gastroenterol. 2002;8:40-43. [PubMed] [DOI] |