修回日期: 2005-04-25
接受日期: 2005-04-27
在线出版日期: 2005-06-28
目的: 利用质谱检测技术和差异比较方法, 对肝癌组织中自然呈递的黑色素瘤抗原基因(melanoma antigen gene, MAGE)表位进行鉴定分析.
方法: 肝癌细胞和癌旁无瘤肝细胞取自同1例肝癌患者, 弱酸洗涤法分离肝癌细胞和肝细胞表面所有肽段; 利用表位预测法挑选出HLA-A2限制的MAGE-1, MAGE-3理论侯选肽作为质谱筛选目标; 利用弱酸洗涤法从肝癌细胞和肝细胞表面分离肽段, 这些肝癌细胞和肝细胞都来自同1例肝癌患者.然后用HPLC分离纯化这些肽段, 并将二种细胞的各峰段(fractions)进行差异比较, 挑选出肿瘤特异性的峰段进行质谱分析.
结果: 经表位预测, 共选出80条目标肽.从肝癌细胞样品中检测出2条自然呈递的MAGE抗原肽: FLWGPRALV (MAGE-3271-279)和FPSLREAAL(MAGE-1294-302), 他们分别来自HCC的峰45.246和峰34.801, m/z分别为1 058.49和1 003.62.
结论: 这是首次从肿瘤组织中分离、鉴定出自然呈递的MAGE抗原表位.本实验证实质谱检测法可以对组织中自然呈递的肿瘤相关抗原表位进行快速准确检测, 而检测的准确性和高效性对于表位的鉴定和肿瘤疫苗的设计都是非常重要的.
引文著录: 周迈, 彭吉润, 王红霞, 钟朝辉, 郭晏同, 潘秀英, 冷希圣. 利用质谱技术对肝癌组织中自然呈递的MAGE表位进行鉴定. 世界华人消化杂志 2005; 13(12): 1395-1399
Revised: April 25, 2005
Accepted: April 27, 2005
Published online: June 28, 2005
AIM: To detect the naturally processed antigenic peptides of melanoma antigen gene (MAGE) in tissues of hepatocellular carcinoma (HCC) by the technology of mass spectrometry (MS) and the strategy of differential analysis.
METHODS: Epitope prediction was performed to select HLA-A2-restricted protein sequence of MAGE-1 and MAGE-3 (theoretic peptides) to serve as the targets for MS screening. Peptides were isolated by mild acid elution from the surfaces of HCC cells and non-neoplastic liver cells, which were obtained from the same patient with HCC. Then the mixtures of peptides were fractionated by HPLC and a differential comparison was made between the two kinds of cells. Finally, the fractions contained tumor-specific peptides were analyzed by MS.
RESULTS: Eighty target peptides were selected after epitope prediction. Two naturally processed peptides of MAGE antigen were detected from HCC samples: FLWGPRALV (MAGE-3271-279) and FPSLREAAL (MAGE-1294-302). They were from peak 45.246 and 34.801, and the m/z was 1 058.49 and 1 003.62 respectively.
CONCLUSION: It is the first evidence that naturally presented peptides of MAGE antigen can be isolated and identified from the tumor tissues. MS-based approach can determine naturally processed peptides of tumor antigen rapidly and precisely, which is important in epitope identification and vaccine designation.
- Citation: Zhou M, Peng JR, Wang HX, Zhong ZH, Guo YT, Pan XY, Leng XS. Identification of naturally presented MAGE epitopes from tissues of hepatocellular carcinoma by mass spectrometry. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1395-1399
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1395.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1395
原发性肝癌(hepatocellular carcinoma, HCC)是常见的恶性肿瘤之一, 好发于东南亚地区[1].早期HCC手术治疗效果良好, 而进展期HCC治疗效果欠佳.由于化疗不敏感, HCC术后的复发率高, 患者的预后和生活质量较差[2].免疫治疗既能杀灭机体各处散在癌灶又能有效地区分癌变细胞和正常细胞, 是理想的抗癌治疗手段[3].正确地鉴定和选择抗原肽-即表位(epitopes)是研制肿瘤疫苗的一个关键步骤[4-5].然而, 传统的肿瘤表位鉴定方法是基于基因水平的[6-7], 该过程不但费时费力, 而且更重要的是他不能真正反应肿瘤组织内表位呈递情况.因此, 对肿瘤组织内自然呈递的抗原肽进行直接检测似乎更为合理和可靠.我们利用表位预测、液-质联用技术和差异比较方法, 对肝癌组织中自然呈递的黑色素瘤抗原基因(melanoma antigen gene, MAGE)表位进行直接检测和鉴定.
柠檬酸、Na2HPO4和NaOH购自北京化学公司.色谱级的三氟乙酸、乙睛购自Sigma公司.超滤离心管(Centriplus YM-3型)购自Millipore公司.C-18 Spe-Pak柱(经典型)购自Waters公司.Trizol试剂购自Invitrogen公司.组织取自1例男性肝癌患者(HLA-A2, 32; -B38, 67), 肿瘤位于肝右叶, 直径10 cm.165 g肿瘤组织和180 g周围无瘤的正常肝组织被切下.切下的组织立即用0℃ PBS冲洗浸泡.肿瘤细胞和无瘤肝细胞的分离肿瘤细胞和无瘤肝细胞利用机械法直接分离.组织用剪刀绞碎, 然后在金属网上轻轻研磨, 500 r/min×5 min离心3次, 共获得6×109肿瘤细胞和8×109肝细胞.
使用Trizol试剂(Invitrogen)提取总RNA.用Superscript II逆转录酶(Gibco)和 oligo dT(Promega)为引物合成cDNA.PCR引物选自不同外显子, 序列如下: MAGE-1: 5'CGG CCC AAG GAA CCT GAC CCAG-3'(CHO-14)and 5'GCT CGA ACC CTC ACT GGG TGG CC-3'(CHO-12); MAGE-3: 5'TGG AGG ACC AGA GGC CCC C-3'(AB 1197)and 5'GGA CGA TTA TCA CGA GGC CTG C-3'(BLE-5).PCR反应条件为: 先预变性4 min; 变性94℃ 45 s, 退火55℃ 45 s, 延伸72℃ 45 s, 进行35个循环; 后延伸72℃ 12 min.
利用SYFPEITHI数据库中的软件进行表位预测.从MAGE-1、MAGE-3蛋白序列筛选出能与HLA-A2各亚型结合, 且分值≥20的8肽、9肽、10肽序列, 并计算出分子量(MW).将所有预测肽列表排序, 作为质谱筛选目标.
每109细胞与10 mL的柠檬酸缓冲液(柠檬酸0.067 mol/L+ Na2HPO4 0.123 mol/L, 用0.1 mol/L Na0H调至pH3.3)在室温下作用2 min, 使细胞表面的蛋白变性, 结合肽释放到上清液中.酸洗液用超滤离心管(Millipore, MW3000)超滤, 条件4℃, 3 000 r/min×6 h.每109细胞的滤液加载到一个C-18 Spe-Pak柱(Waters, 经典型)上, 该柱准备过程如下: 先以10 mL色谱级乙睛过蛀, 再冲20 mL含1 g/L 三氟乙酸(TFA)的蒸馏水.含肽滤液在室温下以1-2 mL/min速度过柱, 然后用20 mL含1 g/L TFA的蒸馏水洗柱, 再用10 mL乙睛洗脱.含肽洗脱液冻干, -20℃保存
从肿瘤细胞和肝细胞提取的肽分别用反相HPLC系统(安捷伦, HP1100型)进行分馏.样品注入C18柱(4.6 mm×150 mm, Waters), 进行梯度洗脱, B液为0-100%乙睛, A液为1 g/L TFA, 梯度设置如下: 0-0% B 10 min, 0-60% B 60 min, 60%-100% B 10 min, 100%-100% B 10 min, 流速1 mL/min.紫外检测 215 nm, 254 nm和280 nm.每分钟收集一个馏分, 冻干, -20℃保存.将肿瘤细胞和肝细胞的色谱图进行比较, 确定肿瘤特异的峰段.
挑选肿瘤样品中含有肿瘤特异峰段的馏分以及肝细胞样品的相对应馏分, 将他们分别溶于10 mL 0.1% TFA中, 注入带有电喷雾离子源的Micromass Q-TOF型串联质谱仪(Waters)中.质谱仪的扫描范围500-15 000, 用于测定每个样品中肽段的分子量和质荷比.为了对天然肽进行MS测序, 每个肽段的撞击诱导解离(CID)的质谱结果都按单电荷的离子形式记录.肽段的序列对比利用互联网上的序列查询软件(NCBI-Blast)进行.
人工合成的FLWGPRALV(MAGE-3271-279)作为标准肽, 他购自华大生物科技公司.取10 fmol, 20 fmol, 50 fmol, 75 fmol, 100 fmol, 250 fmol, 500 fmol, 1 pmol, 2 pmol的标准肽分别溶于10 mL 1 g/L TFA中, 注入同一台Micromass Q-TOF型串联质谱仪内检测.发现质谱仪的检测下限为20 fmol.通过各浓度样品的峰强度推导出标准曲线, 并以此计算出样品肽的数量.根据以下公式推算出每个细胞的肽copy数: 每个细胞的肽copy数 = 肽数量(mol)×Avogadro 常数(6.02×1023)/细胞数.
统计学处理 采用直线回归进行统计分析, P<0.05被认为有统计学意义.
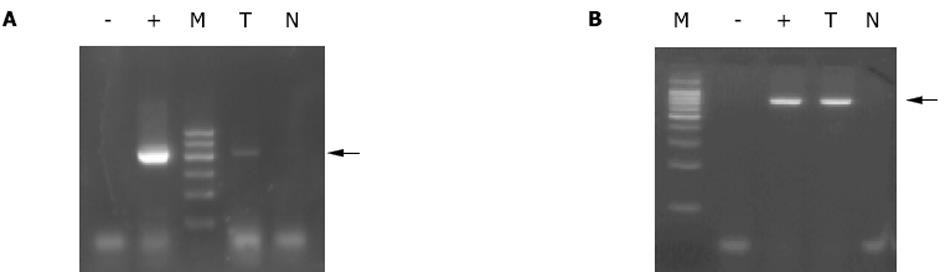
利用RT-PCR技术检测MAGE-1和MAGE-3 mRNA在HCC细胞和无瘤肝细胞中的表达.在HCC样品中MAGE-1和MAGE-3均阳性, 在肝细胞中均阴性(图1).
对MAGE-1、MAGE-3蛋白序列进行扫描, 筛选出能与HLA-A2各亚型结合, 且分值≥20的8肽、9肽、10肽序列, 共获得80条目标肽.
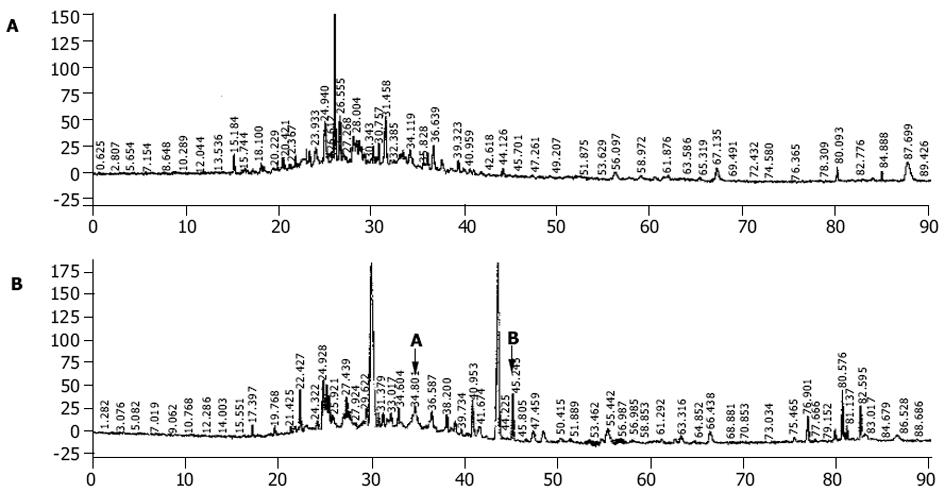
利用弱酸洗涤法从HCC细胞和肝细胞表面分离肽段, 并以反相HPLC分别分离这些肽段, 以215 nm, 254 nm, 280 nm进行紫外吸收监测.将HCC细胞和肝细胞的HPLC色谱图进行比较, 一些细微差异被发现.这说明肿瘤导致细胞表面肽池发生了某些改变(图2).包含有肿瘤特异峰段的馏分被挑选出来, 进行质谱分析.
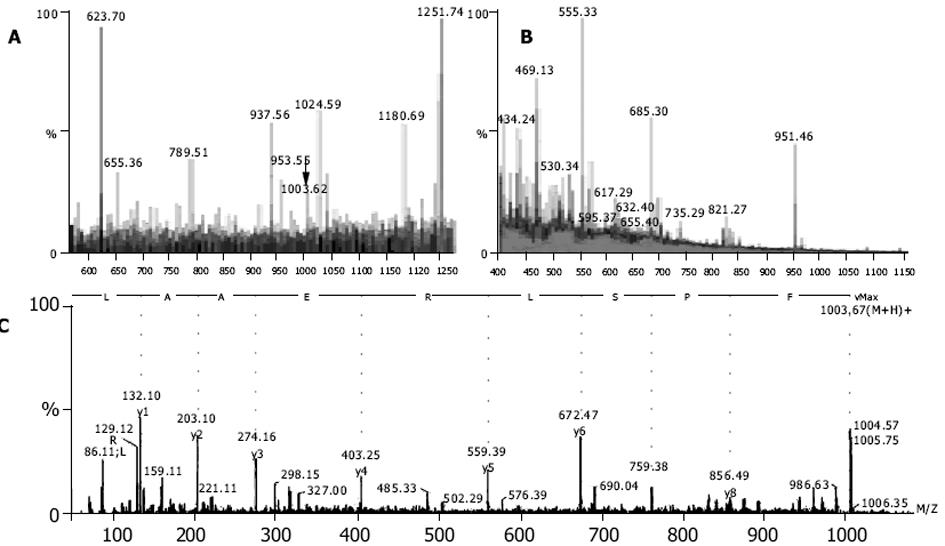
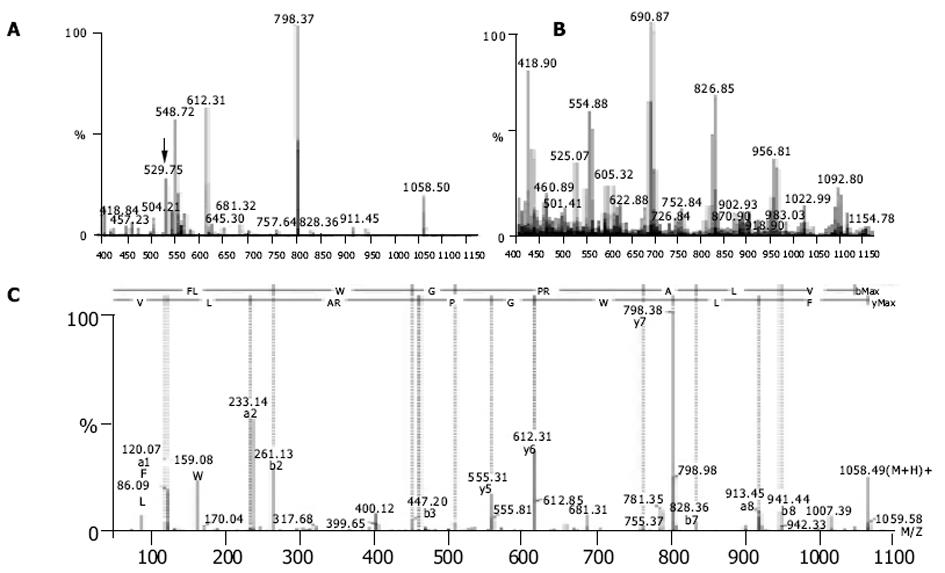
每个含有肿瘤特异峰段的馏分以及肝细胞的相对应馏分一起送检质谱.对那些仅出现于HCC细胞的特异性肽段进行测序分析, 结果发现大多数肽段源自血红蛋白, 且功能不明(数据将另文发表).其中有两条肽段与众不同, 他们分别来自HCC的峰34.801和峰45.246.第一条肽的m/z为1003.62, 第二条肽的m/z为1058.49.测序后证实他们是FPSLREAAL(MAGE-1294-302)(图3)和FLWGPRALV(MAGE-3271-279)(图4).
我们用人工合成的FLWGPRALV(MAGE-3271-279)作为标准肽, 从50 fmol, 75 fmol, 100 fmol, 250 fmol, 500 fmol, 1 pmol, 2 pmol肽的峰强度分别为30, 74, 100, 150, 480, 1300, 2000推导出标准曲线.通过直线回归计算出公式: Y = 0.923X+22.751(P = 0.000), Y: 肽分子数(fmol), X: 峰强度(counts/scan).HCC样品中MAGE-3271-279 的峰强度是397 counts/scan, 6×109的HCC细胞共拥有389 fmol的肽, 那么每个细胞大约具有38-39个copy.
CD8+ T细胞是抗肿瘤免疫反应的主要效应细胞, 而他只能有效识别结合于MHC I类分子上并被呈递到细胞表面的抗原肽[8]-即细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)表位.故准确鉴别CTL表位是肿瘤免疫治疗的一个关键.但目前常用的肿瘤表位鉴定方法是基于基因水平的[6-7]: 首先根据MHC分子的构型从cDNA文库中, 推测出侯选表位; 然后合成这些肽, 并用他们来刺激T 细胞; 最后检测致敏后的T 细胞能否识别这些肽/相应肿瘤细胞系.该过程费时费力, 而且有较高的失败率.因为他建立在下列假设之上的: (1)预测的抗原肽在体内真正地被呈递到肿瘤细胞表面; (2)cDNA编码的抗原肽序列在加工、呈递过程中未发生改变.而事实上, 内源性抗原的加工和呈递过程是相当复杂的, 至少包括以下主要步骤[9]: (1)胞质内通过蛋白降解产生抗原肽; (2)抗原肽从胞质转运至内质网中; (3)内质网中, 抗原肽与MHC I类分子组装成复合体; (4)最后Golgi体输送到细胞表面, 呈递给CD8+ T 细胞.抗原的加工和蛋白翻译后修饰可以使呈递的抗原肽发生重要的改变.而且细胞在癌变过程中也可以对多个抗原加工和呈递的环节产生影响[9].近来, 有研究发现抗原肽可以产生自基因组的非编码区, 即抗原肽可以来源于所有DNA序列, 而不是仅仅限于cDNA.这些都意味着用传统的基因方法来鉴别抗原肽是十分困难和不准确的[10].因此, 对肿瘤自然呈递的抗原肽进行直接检测更为合理和可靠.
目前对自然呈递的抗原肽进行直接检测, 在技术上难度较大.正常情况下, 一个细胞表面拥有105-106个MHCI类分子, 他们呈递大约104个不同种类的肽.不同种类肽的丰度相差极大.而病理衍生肽往往是低丰度的, 在检测时他们常常会被高丰度的自身肽掩盖[5].因此, 对MHC I类分子结合肽进行研究, 需要先进的分离和检测技术.近10年, 在高效液相(high performance liquid chromatography, HPLC)和质谱技术方面的进步使得对微量而又复杂的多肽混合物的分析变得较为便捷, 液-质联用技术大大提高了检测的敏感度和精确度[11-12].但迄今为止, 相关的研究报道还很少.
在本实验中, 我们利用液-质联用技术和差异比较的方法成功地从HCC组织中检测出两条自然呈递的CT抗原肽FLWGPRALV(MAGE-3271-279)和FPSLREAAL(MAGE-1294--302).通过文献检索证实这是首次从肿瘤组织中分离和直接检测出CT抗原肽.
肿瘤-睾丸抗原(cancer-testis antigens), 简称CT抗原[13], 该基因异常表达于多种类型的肿瘤中, 在正常组织不表达(睾丸、卵巢、胎盘除外).黑色素瘤抗原基因(melanoma antigen gene, MAGE)是CT抗原家族中最常见最具代表性的一个成员.以往的研究提示MAGE-1和MAGE-3基因在HCC组织中的表达率高达40%-80%[3], 而且他们的表达常常呈现"群聚"现象[14].这些提示MAGE抗原产物是肿瘤免疫治疗的理想靶目标[15].
MAGE-3是表达频率最高的CT抗原之一.研究已证实MAGE-3271-279肽(HLA-A2呈递)能够在体内、体外的实验中激发CD8+ T细胞反应[2], 故被认为是具有一定应用前景的侯选疫苗肽.但自然呈递的MAGE-3271-279还是首次从HCC组织中检测出来.本研究显示每个HCC细胞拥有40个copy的MAGE-3271-279肽, 这一数量在体内足以激活T细胞[5].我们的结果为该表位在肝癌患者中的应用提供了一定的理论依据.MAGE-1294-302以前未见报道, 从序列看, 2位是Pro, C-端是Leu, 符合B7超基序的结构特点, 再结合患者的HLA分型, 推断他是由HLA-B67分子呈递的.其免疫原性和抗原性尚待进一步检测.
本实验证实了对肿瘤组织中自然呈递的表位肽进行直接检测的可行性, 并初步展示了该方法快捷和准确的优点.研究发现肿瘤抗原的表达在mRNA和蛋白水平存在个体差异, 即异质性表达问题(Heterogeneous expression)[16], 而表位的表达异质性的问题将更为突出.对每个患者进行抗原表位检测, 以制定出适合于每个个体的免疫治疗方案(即免疫治疗的个体化)是合理的.表位肽直接检测法在这方面具有较好的施展空间.有理由相信, 随着相关技术的发展, 表位肽直接检测法将在表位鉴定和肽疫苗设计方面发挥越来越重要的作用.
编辑: 潘伯荣 审读: 张海宁
| 1. | Kobayashi Y, Higashi T, Nouso K, Nakatsukasa H, Ishizaki M, Kaneyoshi T, Toshikuni N, Kariyama K, Nakayama E, Tsuji T. Expression of MAGE, GAGE and BAGE genes in human liver diseases: utility as molecular markers for hepatocellular carcinoma. J Hepatol. 2000;32:612-617. [PubMed] [DOI] |
| 2. | Zerbini A, Pilli M, Soliani P, Ziegler S, Pelosi G, Orlandini A, Cavallo C, Uggeri J, Scandroglio R, Crafa P. Ex vivo characterization of tumor-derived melanoma antigen encoding gene-specific CD8+ cells in patients with hepatocellular carcinoma. J Hepatol. 2004;40:102-109. [PubMed] [DOI] |
| 3. | Chen CH, Chen GJ, Lee HS, Huang GT, Yang PM, Tsai LJ, Chen DS, Sheu JC. Expressions of cancer-testis antigens in human hepatocellular carcinomas. Cancer Lett. 2001;164:189-195. [PubMed] [DOI] |
| 4. | Kawashima I, Hudson SJ, Tsai V, Southwood S, Takesako K, Appella E, Sette A, Celis E. The multi-epitope approach for immunotherapy for cancer: identification of several CTL epitopes from various tumor-associated antigens expressed on solid epithelial tumors. Hum Immunol. 1998;59:1-14. [PubMed] [DOI] |
| 5. | Lemmel C, Stevanovic S. The use of HPLC-MS in T-cell epitope identification. Methods. 2003;29:248259. [PubMed] [DOI] |
| 6. | Skipper JC, Gulden PH, Hendrickson RC, Harthun N, Caldwell JA, Shabanowitz J, Engelhard VH, Hunt DF, Slingluff CL Jr. Mass-spectrometric evaluation of HLA-A0201-associated peptides identifies dominant naturally processed forms of CTL epitopes from MART-1 and gp100. Int J Cancer. 1999;82:669-677. [PubMed] [DOI] |
| 7. | Schirle M, Keilholz W, Weber B, Gouttefangeas C, Dumrese T, Becker HD, Stevanovic S, Rammensee HG. Identification of tumor-associated MHC class I ligands by a novel T cell-independent approach. Eur J Immunol. 2000;30:2216-2225. [PubMed] [DOI] |
| 8. | Hunt DF, Henderson RA, Shabanowitz J, Sakaguchi K, Michel H, Sevilir N, Cox AL, Appella E, Engelhard VH. Characterization of peptides bound to the class I MHC molecule HLA-A2. 1 by mass spectrometry. Science. 1992;255:1261-1263. [PubMed] [DOI] |
| 9. | Seliger B, Maeurer MJ, Ferrone S. Antigen-processing machinery breakdown and tumor growth. Immunol Today. 2000;21:455-464. [PubMed] [DOI] |
| 10. | Yewdell JW. Immunology. Hide and seek in the peptidome. Science. 2003;301:1334-1335. [PubMed] [DOI] |
| 11. | Christinck ER, Luscher MA, Barber BH, Williams DB. Peptide binding to class I MHC on living cells and quantitation of complexes required for CTL lysis. Nature. 1991;352:67-70. [PubMed] [DOI] |
| 12. | van Els CA, Herberts CA, van der Heeft E, Poelen MC, van Gaans-van den Brink JA, van der Kooi A, Hoogerhout P, Jan ten Hove G, Meiring HD, de Jong AP. A single naturally processed measles virus peptide fully dominates the HLA-A*0201-associated peptide display and is mutated at its anchor position in persistent viral strains. Eur J Immunol. 2000;30; 1172-1181. [PubMed] [DOI] |
| 13. | Jager E, Jager D, Knuth A. CTL-defined cancer vaccines: Perspectives for active immunotherapeutic interventions in minimal residual disease. Cancer Metas Rev. 1999;18:143-150. [PubMed] [DOI] |
| 14. | Scanlan MJ, Altorki NK, Gure AO, Williamson B, Jungbluth A, Chen YT, Old LJ. Expression of cancer-testis antigens in lung cancer: definition of bromodomain testis-specific gene (BRDT) as a new CT gene, CT9. Cancer Lett. 2000;150:155-164. [PubMed] [DOI] |
| 15. | Tajima K, Obata Y, Tamaki H, Yoshida M, Chen YT, Scanlan MJ, Old LJ, Kuwano H, Takahashi T, Takahashi T. Expression of cancer/testis (CT) antigens in lung cancer. Lung Cancer. 2003;42:23-33. [PubMed] [DOI] |
| 16. | Valmori D, Dutoit V, Ayyoub M, Rimoldi D, Guillaume P, Lienard D, Lejeune F, Cerottini JC, Romero P, Speiser DE. Simultaneous CD8+ T cell responses to multiple tumor antigen epitopes in a multipeptide melanoma vaccine. Cancer Immun. 2003;3:15. [PubMed] |