修回日期: 2005-03-20
接受日期: 2005-04-08
在线出版日期: 2005-06-28
目的: 研究人B7-2瘤苗和负载了肿瘤细胞冻融抗原的DC瘤苗体外联合诱导抗食管癌的免疫作用.
方法: 应用脂质体转染技术,将融合基因表达载体pEGFP-N3-B7-2转染人食管癌细胞株EC9706.采用密度梯度离心法从脐血中分离单个核细胞(MNC)后,获得单核细胞(Mo).在细胞因子作用下诱导分化, 第3 d加入EC9706的冻融抗原, 共培养4 d后获得负载肿瘤抗原的成熟树突状细胞(MDC).将致敏DC与从脐血中分离的T淋巴细胞共培养3 d, 获得细胞毒T淋巴细胞(CTL); 四甲基偶氮唑蓝(MTT)法检测CTL对转染和未转染的EC9706的细胞毒作用.
结果: 融合基因在食管癌细胞株EC9706的胞膜上定位表达.脐血来源的DC可负载并递呈肿瘤抗原, 激活自体T淋巴细胞, 诱导肿瘤特异性CTL产生, 对转染pEGFP-N3-B7-2的EC9706细胞有显著杀伤作用(F = 21.672, P = 0.000).
结论: 人B7-2瘤苗和DC瘤苗体外联合应用,诱导出明显的杀伤食管癌细胞的免疫效应.
引文著录: 路静, 赵军, 宋谦, 崔自由, 赵国强, 黄幼田, 杨洪艳, 赵继敏, 董子明. 人B7-2瘤苗与DC瘤苗体外联合诱导抗食管癌的作用. 世界华人消化杂志 2005; 13(12): 1382-1385
Revised: March 20, 2005
Accepted: April 8, 2005
Published online: June 28, 2005
AIM: To investigate the roles of human B7-2 combined with dentric cell (DC) vaccine in inducing anti-tumor immunity against esophageal cancer in vitro.
METHODS: Human esophageal cancer cell line EC9706 was transfected with the vector of pEGFP-N3-B7-2 by lipofectamine method. The mononuclear cells (MNCs) were separated from cord blood by density gradient centrifugation (Ficall-Hypaque) and then were induced to differentiate by cell factors. On the 3rd day, EC9706 cytolysis antigen was added into the medium, in which DCs gradually matured and expressed special tumor antigen. After the matured DCs were co-cultured with autologous T cells derived from cord blood for 3 days, the T cells were activated to become tumor specific cytotoxic T lymphocytes (CTL). The inhibition of CTL on the transfected and untransfected EC9706 cells was detected by methyl thiazolyl tetrazolium (MTT) assay.
RESULTS: The EGFP-B7-2 fusion gene was expressed mainly on the membrane of EC9706 cells, which proved the transfection was successful. Mature DCs with tumor cytolysis antigene was able to activate naive T cells to become tumor specialized CTL, and the CTL had significant inhibitory effect or killing response on EC9706 cells transfected with pEGFP-N3-B7-2(F = 21.672,P = 0.000).
CONCLUSION: The human B7-2 combined with DC vaccine can induce significant killing response on esophageal cancer cell.
- Citation: Lu J, Zhao J, Song Q, Cui ZY, Zhao GQ, Yang HY, Huang YT, Zhao JM, Dong ZM. Combination effect of human B7-2 and dentric cells vaccines in anti-esophageal cancer in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1382-1385
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1382.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1382
机体对肿瘤细胞的免疫排斥主要依赖于体内的T细胞, T细胞的激活需要两类信号: 一类是特异的抗原提呈信号, 另一类是非MHC限制的共刺激信号.若缺乏共刺激信号, 则T细胞处于无能状态或凋亡.绝大多数肿瘤细胞不表达B7分子或仅弱表达导致肿瘤免疫逃逸.利用B7分子进行免疫基因治疗, 是肿瘤免疫基因治疗的一个重要研究方向.其中B7-2分子因其在抗原提呈细胞(antigen presenting cell, APC)上表达时间早、表达丰度高、易诱导表达, 被认为在免疫应答起始阶段发挥重要作用[1].树突状细胞(dendritic cell, DC)是最强有力的专职APC, 不但能高表达Ⅰ类和Ⅱ类分子, 而且还能高表达B7-1, B7-2等共刺激分子.若将肿瘤细胞的抗原转移至DC细胞, 则可使DC细胞既具有肿瘤特异性, 又能提供激活T细胞所必需的共刺激信号, 大大增强其肿瘤免疫原性.目前, DC主要来源于骨髓、外周血和脐血.脐血来源的DC, 具有来源广、费用低廉、对供需双方无痛苦、免疫原性较弱等特点, 具有更好的应用前景.食管癌具有异质性大、抗原性弱, 缺乏特异性肿瘤抗原的特点, 其B7分子表达缺陷是其不能激发有效的免疫应答的主要原因之一[2].目前尚未有将共刺激分子转入食管癌细胞以增强其免疫原性的文献报道.本研究体外联合应用B7-2瘤苗、DC瘤苗观察其诱导抗食管癌细胞的免疫作用, 旨在为食管癌的免疫治疗提供新的思路.
RNA提取试剂盒、快速凝胶回收试剂盒、质粒提取试剂盒(Qiagen公司); AMV逆转录酶、pGEM-Teasy载体、TaqDNA聚合酶、T4DNA连接酶、G418(Promega公司); 限制性内切酶KpnI, XhoI(TaKaRa公司); 细胞培养试剂RPMI1640(Gibco公司); 小牛血清(Corning公司); LPS(Sigma公司); rhGM-CSF, rhIL-4, rhIL-2(Immunogenex公司); 淋巴细胞分离液(中国医学科学院血液学研究所); 二甲基亚砜、四甲基偶氮唑蓝(Sigma公司).E.Coli DH5a为本室保存菌种; 增强绿色荧光蛋白质粒pEGFP-N3由北京解放军301医院母义明教授惠赠; 引物合成及核苷酸序列测定由上海生工生物工程公司完成.食管癌细胞株EC9706由中国医学科学院肿瘤研究所分子肿瘤学国家重点实验室提供; 脐血来源于省妇幼保建院, 无菌条件下采取健康足月胎儿的脐血, 肝素抗凝终浓度为20 kU/L, 平均采血样50-70 mL/份.人B7-2和增强绿色荧光蛋白融合基因表达载体pEGFP-N3-B7-2的构建参见文献[3].
1.2.1 人B7-2瘤苗的制备: pEGFP-N3-B7-2转染EC9706细胞.EC9706细胞用含100 mL/L FBS的RPMI1640培养液, 置于37℃, 50 mL/L CO2箱中培养.转染前1 d将处于对数生长期的EC9706细胞种至24孔板, 按照Gibco公司提供的Lipofectamine操作步骤进行, DNA与脂质体的体积比例为1∶2, 转染24 h后, 在荧光倒置显微镜下观察融合基因的表达情况.上述转染48 h后, 加入G418加压筛选(初始浓度为600 mg/L, 最大浓度增至12 000 mg/L, 维持浓度为200 mg/L), 经过1 mo的筛选, 获得稳定表达融合基因的EC9706细胞株.
1.2.2 人DC瘤苗的制备: 取生长状态良好对数生长期的EC9706细胞1×107个, 1 000 r/min离心5 min后, 沉淀用2 mL 100 mL/L FBS的RPMI1640悬浮, 移入EP管.置于液氮中10 min, 再迅速放入37℃水浴中, 反复3次后, 15 000 g离心30 min, 收集上清经微孔滤膜过滤作为可溶性抗原(TAA), 1∶10稀释, -20℃保存.脐血标本中加入生理盐水(5∶1)稀释后沿管壁缓缓加入到含淋巴细胞分离液(1∶1.5)的离心管内, 室温1 500 r/min离心25 min, 最上层吸出作自体血浆备用后, 用毛细吸管吸出界面灰黄单个核细胞层(MNC), 加入适量生理盐水吹打混匀后离心1 200 r/min 8 min, 洗涤细胞3次.弃上清, 用含150 mL/L自体血浆的RPMI1640培养基悬浮细胞, 接种入24孔板, 每孔4×109细胞/L培养基.37℃ 50 mL/LCO2孵箱培养2 h后, 轻轻吸出上清置培养瓶中获得T淋巴细胞, 加入因子rhIL-2(5 mg/L), 置温箱中继续培养.24孔板中获得单核细胞(Mo), 每孔加入细胞因子rhGM-CSF(10 mg/L)、rhIL-4(10 mg/L), 置于温箱中培养, 每3 d半量换液1次, 细胞因子同前.第3 d换液时加入肿瘤抗原(TAA)100 mL.第6 d每孔加入LPS(5 mg/L), 第7 d收获成熟DC.取TAA致敏的成熟DC(DC瘤苗)与T淋巴细胞以1∶20比例混合, 共培养3 d.DC递呈抗原并激活幼稚T淋巴细胞, 促使T淋巴细胞活化为细胞毒性T淋巴细胞(CTL).
1.2.3 B7-2瘤苗与DC瘤苗体外联合抗食管癌细胞效应: 致敏的T细胞(CTL)为效应细胞, 稳定转染pEGFP-N3的EC9706、稳定转染pEGFP-N3-B7-2的EC9706、未转染的EC9706为靶细胞, 效靶比为20∶1, 按以下分组进行培养: A组: 靶细胞对照组(EC9706); B组: 效应对照组(未致敏的T淋巴细胞+EC9706)C组: CTL+ EC9706: D组: CTL+EC9706(pEGFP-N3)E组: CTL+ EC9706(pEGFP-N3-B7-2)以上细胞接种于96孔板, 每组复种8孔, 并且重复3次.培养72 h, 最后4 h加入MTT20 mL(5 g/L).培养4 h后1 000 r/min离心5 min弃上清, 补入二甲基亚砜(DMSO)150 mL, 20 min后充分震荡用酶联免疫检测仪在波长570 nm检测A值.CTL杀伤活性 = [(效应对照组A值-实验组A值)/靶细胞对照组A值]×100%并比较实验组间对食管癌细胞的杀伤效果.
统计学处理 采用SPSS11.0统计软件.所有数据用 表示, 采用单因素方差分析, 以a = 0.05为检验水准.
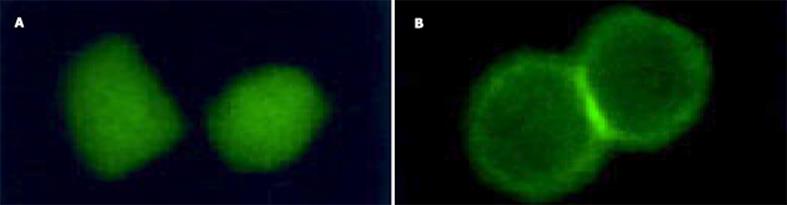
采用脂质体转染技术用重组质粒转染EC9706细胞, 24 h后在488 nm波长激发光荧光倒置显微镜下观察, 已有一定比例的细胞发出绿色荧光, 转染空质粒组细胞表达荧光强度及数目, 均高于转染重组质粒组, 且其绿色荧光蛋白在细胞内均匀表达.转染重组质粒组可见融合基因固定表达于细胞膜上.用G418筛选1 mo, 获得稳定表达株(图1A-B).
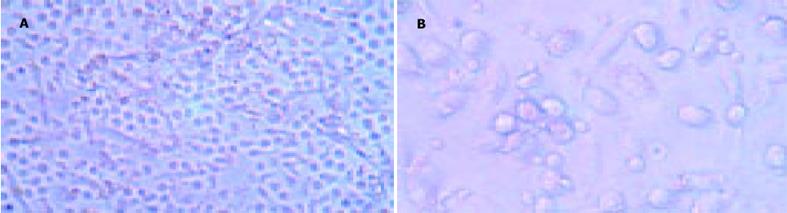
从脐血中获得单个核细胞(MNC), 贴壁2 h后吸出悬浮淋巴细胞, 获得贴壁良好的小而圆的单核细胞(Mo), 加入GM-CSF和IL-4, 细胞培养24 h后均可见贴壁的Mo聚集成均匀散布的细胞聚体(粒-巨噬细胞集落形成单位, GM-CPU).3 d后可见部分细胞有突起伸出, 5 d后大量突起交织在一起.培养7 d后, 大量树突状形态细胞从贴壁、半悬浮状态变为悬浮状态, 细胞变大变圆, 均匀散布于培养基中, 为典型DC形态(图2A-B).
EC9706抗原致敏DC活化的CTL与靶细胞EC9706, EC9706(pEGFP-N3), EC9706(pEGFP-N3-B7-2)效靶比20∶1培养72 h后, MTT法检测CTL对食管癌细胞的杀伤率.CTL对转染重组质粒组与转染空质粒组、未转染组的杀伤率(%)(24.69±3.51、18.21±2.89、10.52±3.12, 对比F = 21.672, P = 0.000<0.05), 有显著差异, DC瘤苗与B7-2基因修饰的肿瘤疫苗联合应用可诱导出明显的抗瘤效应.
当前, 如何能使机体内肿瘤细胞成为好的抗原递呈细胞, 进而激活抗肿瘤免疫成为至关重要的问题.就肿瘤细胞活化细胞而言, B7分子提供共刺激信号以顺式共刺激方式最为有效[4], B7基因修饰的瘤细胞能诱导有效的免疫反应[5].抗原特异性CD8+T细胞介导的抗肿瘤免疫效应中, 要求肿瘤细胞本身表达MHCI类分子并提呈抗原.对于MHCI类分子阴性的低免疫原性肿瘤来说, 即使导入B7基因也难以诱导CTL免疫应答, 但是B7分子能通过增强NK细胞活性杀伤低免疫原性肿瘤[6-7].Wilson et al[7]报道, 鼠黑色素瘤细胞B16.F1转染人B7-1或B7-2增加了人NK细胞介导的肿瘤杀伤作用.用特异性抗体封闭B7-1或B7-2分子后, 该杀伤作用显著降低.
肿瘤患者的DC存在表型和功能上的缺陷, 不能引发有效的抗肿瘤免疫反应[8].反复大量抽取肿瘤患者的外周血去诱导DC, 使大多数肿瘤患者不能耐受.我们采用脐血单个核细胞诱生DC是基于: (1)纯化CD34+干细胞费用高昂, 不利于将来用于临床; (2)虽然CD34+干细胞是DC的主要前体细胞但并不是唯一的, 脐血中的单核细胞也能在细胞因子的诱导下生成DC; (3)CD34+细胞来源的DC形成晚, 分化成熟需12-14 d, 单个核细胞诱生DC周期短, 仅需7-9 d, 更方便于应用, 并且两种方法获得的DC的形态、CDla表面抗原的表达没有显著的差异, 二者均具有刺激同种T细胞增殖的能力[9].DC在抗肿瘤免疫中发挥重要作用, 有关运用DC治疗恶性肿瘤已成为热点.由于肿瘤免疫逃逸的机制之一是其阻止了DC的成熟, 而非直接抑制DC的功能[10], 因此在体外将DC扩增或同时用肿瘤抗原致敏DC, 使其分化成熟, 然后将这种功能正常且携带相应的肿瘤抗原的DC回输体内, 可有效地诱导机体产生肿瘤特异性CTL反应[11].
食管癌组织B7分子表达缺陷, 不能引起有效的免疫应答[4].我们应用脂质体转染技术将pEGFP-N3-B7-2转染人食管癌细胞株EC9706, 制备B7-2瘤苗.其抗瘤免疫机制是将T细胞活化所需要共刺激分子B7-2导入食管癌细胞EC9706, 通过B7-CD28途径将瘤细胞与T细胞联系在一起, 诱导出不依赖于APC的直接的T细胞激活; 但有文献报道非免疫系肿瘤缺乏第一信号, 即使提供共刺激信号也不能有效激活T细胞[7].故我们考虑联合应用DC瘤苗, 利用DC高效的加工提呈抗原能力, 尤其是已负载了抗原的DC-Pr瘤苗能更快速地直接将抗原提呈给T细胞, 使之识别而活化.食管癌具有异质性大、抗原性弱, 缺乏特异性肿瘤抗原的特点, 和多数肿瘤一样不能激发有效的免疫反应[12].我们将上述两种途径有机结合在一起, 在体外诱导出了有效的抗食管癌细胞效应, 为食管癌的生物治疗提供一定的实验依据.如前所述, B7分子在体内还能通过增强NK细胞活性杀伤低免疫原性肿瘤, 这为B7-2肿瘤疫苗的应用提供了进一步的理论依据.
编辑: 潘伯荣 审读: 张海宁
| 1. | Boussiotis VA, Freeman GJ, Gribben JG, Nadler LM. The role of B7-1/B7-2: CD28/CLTA-4 pathways in the prevention of anergy, induction of productive immunity and down杛egulation of the immune response. Immunol Rev. 1996;153:5-26. [PubMed] [DOI] |
| 4. | Chen L. Manipulation of T cell response to tumors by targeting on costimulatory pathway. Leukemia. 1997;11:567-569. [PubMed] |
| 5. | Pizzoferrato E. B7-2 expression above a threshold elicits anti-tumor immunity as effective as interleukin-12 and prolongs survival in murine B-cell lymphoma. Int J Cancer. 2004;110:61-69. [PubMed] [DOI] |
| 6. | Yoon SK, Kim TG, Cho HI, Lee BS, Cho SH, Han NI, Lee YS, Jang JW, Chung KW, Sun HS. Suppression of tumor formation and induction of natural killer cell activity in BALB/c nude mice by human B7-1 (CD80) gene transfer subcutaneously injected with human hepatocellular carcinoma cells (Huh-7). Taehan Kan Hakhoe Chi. 2003;9:124134. [PubMed] |
| 7. | Wilson JL, Charo J, Martin-Fontecha A, Dellabona P, Casorati G, Chambers BJ, Kiessling R, Bejarano MT, Ljunggren HG. NK cell triggering by the human costimulatory molecules CD80 and CD86. J Immunol. 1999;163:4207-4212. [PubMed] |
| 8. | Steinbrink K, Wolfl M, Jonuleit H, Knop J, Enk AH. Induction of tolerance by IL-10-treated dendritic cells. J Immunol. 1997;159:4772-4780. [PubMed] |
| 10. | Steinman RM, Turley S, Mellman I, Inaba K. The induction of tolerance by dendritic cells that have captured apoptotic cells. J Exp Med. 2000;191:411-416. [PubMed] [DOI] |
| 11. | Geiger JD, Hutchinson RJ, Hohenkirk LF, McKenna EA, Yanik GA, Levine JE, Chang AE, Braun TM, Mule JJ. Vaccination of pediatric solid tumor patients with tumor lysate-pulsed dendritic cells can expand specific T cells and mediate tumor regression. Cancer Res. 2001;61:8513-8519. [PubMed] |
| 12. | Chen LP. Immunological ignorance of silent antigens as an explanation of tumor evasion. Immunol Today. 1998;19:27-30. [PubMed] [DOI] |