修回日期: 2005-03-25
接受日期: 2005-04-13
在线出版日期: 2005-06-15
目的: 探讨上皮钙粘蛋白(E-cadherin)在大肠癌转移淋巴结内癌细胞的再表达情况及其与肿瘤生物学特性的关系.
方法: 用免疫组织化学染色的方法分别检测了上皮钙粘蛋白在62例大肠癌原发灶及其相应转移淋巴结内癌细胞的表达情况.
结果: 98.39%(61/62)大肠癌原发灶上皮钙粘蛋白表达减低.22.58%(14/62)大肠癌转移淋巴结内癌细胞上皮钙粘蛋白再表达阳性, 其中高分化腺癌再表达阳性率为33.33%(12/36), 中低分化腺癌再表达阳性率为7.69%(2/26), 上皮钙粘蛋白在转移淋巴结的再表达与肿瘤的分化程度密切相关(χ2 = 5.678, P = 0.017).
结论: 上皮钙粘蛋白在大肠癌转移淋巴结内癌细胞的再表达是存在的, 并可能对癌细胞在转移灶的聚集生长起着重要作用.
引文著录: 赵晶, 王凤安, 刘津, 闫庆辉, 张杰英, 薛平, 蔡建辉. 上皮钙粘蛋白在大肠癌转移淋巴结癌细胞中的再表达及意义. 世界华人消化杂志 2005; 13(11): 1351-1352
Revised: March 25, 2005
Accepted: April 13, 2005
Published online: June 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1351-1352
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1351.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1351
E钙粘蛋白(cadherin, cad), 即上皮钙粘蛋白, 又称CAM120/180, 属于钙依赖经典钙黏着素亚族成员, 主要分布在非神经上皮组织, 介导同种亲和性的上皮细胞-细胞间黏附.其与连环蛋白构成E-钙粘蛋白/连环蛋白复合体(cadherin/catenin complex)主要分布于细胞连接的黏合带, 在胚胎发育、形态学发生、以及成熟上皮组织的极性以及完整性的维持等方面起着重要的作用[1].E-cadherin表达的减少或缺失可能促使肿瘤细胞的淋巴结转移[2].我们应用SP免疫组织化学染色方法检测了E-cadherin在大肠癌及相应转移淋巴结中的表达状况, 探讨其与大肠癌的转移及与临床病理间的关系.
本研究的对象为在1992-12/2001-12期间在河北医科大学第二医院外科接受治疗的全部62例原发性大肠癌并有淋巴结转移的患者, 标本经4 g/L甲醛固定、石蜡包埋、4 μm连续切片、HE染色病理确诊.其中男性25例, 女性37例, 在院期间年龄22-82岁, 平均49.3±14.8岁.所有患者术前均未接受抗癌治疗.
应用免疫组织化学SP染色法.E-钙粘蛋白抗体(小鼠抗人单克隆抗体)及SP试剂盒均购自北京中杉金桥试剂公司, 其余试剂为国产分析纯.免疫组化步骤: 石蜡切片常规脱蜡, 30 mL/L H2O2清除内源性过氧化物酶.微波修复抗原92-98℃ 15 min, 冷却至室温后加50 mL/L正常羊血清置37℃ 15 min以封闭非特异抗原.加第一抗体(小鼠抗人E-钙粘蛋白单克隆抗体1∶50稀释)4℃过夜.加第二抗体(羊抗鼠单克隆IgG抗体1∶300稀释)37℃ 30 min.加辣根酶标记的链霉卵白素(1∶300稀释)37℃ 30 min.DAB显色10 min, 复染封片.以磷酸盐缓冲液(PBS)作为阴性对照, 以每张切片上相对正常的黏膜作为阳性对照.结果判断: 只有明显胞膜染色的细胞被判定为正常染色; 如染色不连续, 明显减弱或缺失, 或出现胞质染色, 则被评定为不正常染色.每张切片按照其全部癌细胞中出现的正常染色细胞的百分率评定为三级: 1级为0-50%, 2级为51-80%, 3级为81-100%[3].对于原发灶切片, 如被评定为3级, 则此病例被认为是E-cadherin的正常表达; 而1级和2级染色则被认为是E-cadherin的不正常表达; 对于转移淋巴结切片, 如其染色等级高于原发灶染色等级, 则此病例被评定为E-cadherin再表达阳性; 否则为再表达阴性.
统计学处理 应用χ2检验分析各研究对象间E-cadherin表达的差异.
正常大肠黏膜E-cadherin表达于肠腔柱状上皮和腺上皮的细胞膜上, 表达呈强阳性, 胞质中染色阴性; 间质细胞、平滑肌细胞、内皮细胞均为阴性.这一结果与正常情况下E-cadherin分布于细胞连接的黏合带相一致.
62例大肠癌中有36例高分化腺癌、26例中低分化腺癌, 其中40例为管状及乳头状腺癌, 其余22例为黏液腺癌(表1).在全部62例大肠癌中, 只有1例E-cadherin正常表达.在36例高分化腺癌中有25例评为1级、10例评为2级、1例评为3级, 而全部26例中低分化腺癌染色评分均为1级; 在40例管状及乳头状腺癌中有29例评分为1级, 10例评分为2级, 1例评分为3级, 而全部22例黏液腺癌评分均为1级.
| 临床病理因素 | n | 转移灶 | χ2值 | P值 | |
| + | - | ||||
| 分化程度 | |||||
| 高分化 | 36 | 12 | 24 | 5.678 | 0.017 |
| 中、低分化 | 26 | 2 | 24 | ||
| 组织类型 | |||||
| 管状、乳头状腺癌 | 40 | 12 | 28 | 2.454 | 0.117 |
| 22 | 2 | 20 | |||
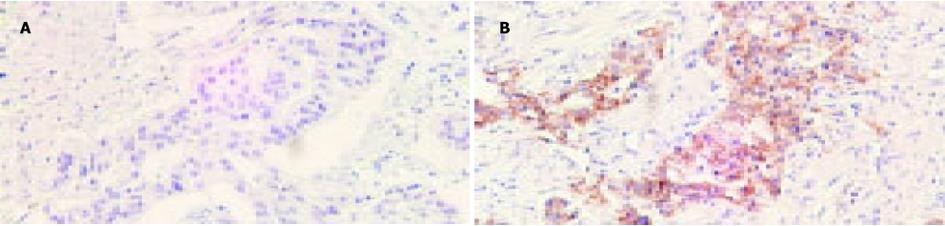
E-cadherin的再表达阳性率为22.58%(14/62)(图1).其中, 高分化腺癌再表达阳性率为33.33%(12/36), 中低分化腺癌再表达阳性率为7.69%(2/26).高分化腺癌较中低分化腺癌更易出现E-cadherin的再表达(χ2 = 5.678, P = 0.017<0.05).管状及乳头状腺癌再表达阳性率为30%(12/40), 黏液腺癌再表达阳性率为9.09%(2/22).不同组织学类型大肠癌之间再表达情况没有显著差别(表1).
钙粘蛋白链蛋白复合体各组成成分在某些原因作用下发生的功能障碍会直接影响E-cadherin介导的细胞间黏着, 进而导致癌细胞脱离原发灶, 促进了癌细胞的浸润性生长和癌转移的发生.
本研究的主要目的是评估E-cadherin在大肠癌转移淋巴结内癌细胞的再表达情况.可能是由于所选病例均已发生淋巴结转移的原因, 我们得到了E-cadherin在原发灶的高不正常表达率(98.39%, 61/62).同时通过对E-cadhrin在原发灶的表达的研究, 发现有肿瘤分化程度越低, 恶性程度越高, E-cadherin表达水平越低的趋势.这显示了其在维持上皮组织正常结构上可能起着重要的作用.
癌细胞由原发灶脱落本身并不足以致命, 癌细胞在其他部位的再聚集并出现多发性转移灶才是主要的致死原因.在2000年, Bukholm et al[4]注意到乳腺癌患者转移灶内癌组织E-钙粘蛋白/连环蛋白复合体再表达的情况.本研究中E-cadherin在转移淋巴结内再表达阳性率为22.58%, 这一结果支持了Jawhari[5]的发现, 即在转移淋巴结内常可以见到E-cadherin复合体在癌细胞的不正常表达, 同时也说明其在转移灶内的再表达阳性可能与癌细胞在转移部位的再聚集和生长有关, E-cadherin复合体在转移灶内的再表达在大肠癌的转移过程中可能起着重要作用, 但其是否有着必然的联系及其作用机制仍有待进一步的研究.
在本研究中, E-cadherin在转移灶内的再表达的出现与肿瘤的分化程度密切相关, 高分化腺癌较中低分化腺癌更易出现E-cadherin的再表达.同时, 研究结果发现, 有一些转移癌细胞与其原发灶相比分化程度较好.结合上述研究结果, 我们认为, 分化程度较低的原发肿瘤, 由于常有E-cadherin的表达缺失, 故而可能较容易从原发灶脱落; 而在转移灶内, 分化程度较好的肿瘤, 由于其分化程度更接近正常组织, 并且常有E-cadherin的表达, 从而可能更容易在转移灶内增殖、存活.因此, 我们认为E-cadherin在转移灶内的再表达可能成为判断大肠癌患者预后的又一重要指标.
编辑: 张海宁
| 1. | Takechi M. Cadherin cell adhesion receptors as a morphorgenetic regulator. Science. 1991;251:1451-1455. [PubMed] [DOI] |
| 2. | Oka H, Shiozaki H, Kobayashi K, Inoue M, Tahara H, Kobayashi T, Takatsuka Y, Matsuyoshi N, Hirano S, Takeichi M. Expression of E-cadherin cell adhesion in human breast cancer tissues and its relationship to metastasis. Cancer Res. 1993;53:1696-1701. [PubMed] |
| 3. | Andrews NA, Jones AS, Helliwell TR, Kinsella AR. Expression of the E-cadherin-catenin cell adherin complex in primary squamous cell carcinoma of the head and neck and their nodal metastases. Br J Cancer. 1997;75:1474-1480. [PubMed] [DOI] |
| 4. | Bukholm IK, Nesland JM, Borresen-Dale AL. Re-expression of E-cadherin, α-catenin and β-catenin, but not of γ-catenin, in metastatic tissue from breast cancer patients. J Pathol. 2000;190:15-19. [PubMed] [DOI] |
| 5. | Jawhari A, Jordan S, Poole S, Browne P, Pignatelli M, Farthing MJ. Abnormal immunoreacticity of the E-cadherin-catenin complex in gastric carcinoma: relationship with patient survival. Gastroenterology. 1997;112:46-54. [PubMed] [DOI] |