修回日期: 2005-04-08
接受日期: 2005-04-09
在线出版日期: 2005-06-15
目的: 研制出具有缓释作用的盐酸洛拉曲克长循环脂质体并考察其理化特性以及在体外的抗瘤效应.
方法: 用两亲性聚乙二醇-二硬脂酰磷脂酰乙醇胺(PEG-DSPE)对脂质体膜进行修饰, 以薄膜挤压-硫酸铵梯度法制备盐酸洛拉曲克长循环脂质体; 用MTT法比较盐酸洛拉曲克长循环脂质体与盐酸洛拉曲克普通脂质体及游离的盐酸洛拉曲克的体外细胞毒性.
结果: 制备的盐酸洛拉曲克隐形脂质体包封率达68%左右, 粒径110 nm左右; 与普通脂质体及游离的盐酸洛拉曲克相对照, 长循环脂质体显示了较好长效的毒性作用, 2 h组长循环脂质体的ID50明显高于另外两组, 而48 h组的ID50则与另外两组无显著差别.
结论: 新制备的盐酸洛拉曲克长循环脂质体在体外显示了其较好的缓释效应, 可以弥补盐酸洛拉曲克在体内半衰期比较短的缺点.
引文著录: 陈斯泽, 汪森明, 张积仁. 盐酸洛拉曲克长循环脂质体的制备及其对肝癌细胞的体外毒性. 世界华人消化杂志 2005; 13(11): 1346-1348
Revised: April 8, 2005
Accepted: April 9, 2005
Published online: June 15, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1346-1348
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1346
盐酸洛拉曲克(nolatrexed dihydrochloride, AG337)是根据胸苷合成酶(thymidylatesynthase, TS)催化活性中心三维结构设计并合成的特异性抑制剂[1-3], 因干扰DNA合成, 阻止细胞分裂增殖而发挥抗肿瘤作用[4-5].初步临床研究已证实其对肝癌、头颈癌、子宫直肠癌及非小细胞肺癌等多种实体瘤有较好临床疗效[6].盐酸洛拉曲克通过被动扩散进入细胞, 且在细胞内半衰期非常短, 必须持续静脉给药来维持其对癌细胞的毒性, 这种毒性同时对正常组织也起作用, 最常见的不良反应包括皮疹、黏膜炎、中性粒细胞减少和血小板减少等[7].这种剂量限制性毒性影响临床疗效发挥.长循环脂质体(long circulating liposomes, LCL)比普通脂质体(conventional liposomes, CL)能更持久地延长药物在血流中的时间, 避免网状内皮系统(reticuloendothlelial system, RES)的吞噬, 以获得更充足的时间到达靶向部位, 增加与肿瘤组织的靶向性和缓释性, 降低用药剂量, 提高疗效, 降低毒副作用[8-10], 正好弥补了盐酸洛拉曲克的不足, 是盐酸洛拉曲克的理想载体.为此我们对以长循环脂质体为盐酸洛拉曲克的载体进行了初步的研究.
氢化大豆磷脂(HSPC)和聚乙二醇2000-二硬脂酰磷脂酰乙醇胺(DSPE-PEG2000)(Lipoid公司)、胆固醇(Chol)(Sigma公司)盐酸洛拉曲克(AG337)(康辰医药发展有限公司)、Sephadex G50(Pharmacia)、聚碳酸酯核微孔滤膜[Nuclepore(r)0.2、0.4、0.8 μm, Whatman]、人肝癌细胞株HepG2、QSQ7706(南方医科大学药物研究所赠)、DMEM 培养液(Gibco); 真空旋转蒸发器(ZFO86A, 上海)、探针超声(JY88-II, 宁波新芝科器研究所)、激光粒度分析仪(Malvern-3000HS, British)、透射电镜(GEOL-120EX, Japan)、紫外分光光度计(Beckman DU series 530)、酶标仪(Model 680, Bio-Rad)等.
1.2.1 长循环空白脂质体制备(薄膜挤压法[11]): 按摩尔比1∶1∶0.15精密称取HSPC、Chol、DSPE-PEG2000, 置梨形瓶中, 用氯仿溶解, 真空旋转蒸发器旋转真空蒸发成膜(50℃), 将120 mmol/L硫酸铵溶液加至脂膜中, 探针超声10 min得空白脂质体混悬液.将此混悬液于60℃左右过聚碳酸酯核微孔滤膜0.2、0.4、0.8 μm各3次, 得空白长循环脂质体.同法制备普通脂质体, 不同的是在载体材料中不加DSPE-PEG2000.
1.2.2 主动载药(硫酸铵梯度法[12]): 将上述空白脂质体置透析袋中, 封牢两端, 置于盛有100 mL生理盐水的锥形瓶中, 室温下透析5次, 每次8 h.另精密称取盐酸洛拉曲克适量, 溶于水中, 将此溶液加入到空白脂质体混悬液, 于60℃放置30 min, 不时振摇, 即得盐酸洛拉曲克长循环脂质体.
1.2.3 脂质体的形态、粒径和及分布的考察: 适量生理盐水稀释脂质体后, 用激光粒度分析仪检测其粒径大小及分布; 取用生理盐水稀释的盐酸洛拉曲克脂质体, 滴至载玻片上, 以1%(m/v)磷钨酸负染色后, 再滴至专用铜网上, 自然挥干, 使粒子在铜网上浓缩沉积, 用透射电镜观察并拍片记录.
1.2.4 盐酸洛拉曲克标准曲线: 取空白脂质体0.1 mL, 加生理盐水稀释至5 mL; 精密称取盐酸洛拉曲克400 mg, 加生理盐水溶解并定容至100 mL量瓶中, 作为贮备液.空白脂质体稀释液0.5 mL, 用混合溶媒(10%(v/v)tritionX-100∶乙醇∶水 = 1∶14∶35)溶解, 加一定量贮备液, 用生理盐水定容, 配制成盐酸洛拉曲克浓度分别为2.5、5.0、7.5、10、15和20 mg/L标准溶液, 用紫外分光光度计于297 nm测定吸光度, 用空白脂质体作对照.以吸光度A对浓度C(mg/L)进行回归, 求回归方程.
1.2.5 脂质体包封率的测定: 取脂质体约0.2 mL, 加在Sephadex G50葡聚糖凝胶柱上, 用自制生理盐水以1 mL/min的流速洗脱, 每份收集3 mL.用紫外分光光度计检测流份, 流出的顺序依次为空白洗脱液、脂质体、空白洗脱液、游离盐酸洛拉曲克、空白洗脱液.收集合并脂质体流份, 加入适量混合溶媒, 摇匀; 另取包封过的脂质体, 加混合溶媒.于297nm处测吸收度, 按下式计算包封率
E% = W1/W2×100%
E%为包封率; W1为经柱分离后的盐酸洛拉曲克脂质体含药量; W2为未经柱分离的盐酸洛拉曲克脂质体含药量.
1.2.6 稳定性考察: 取长循环脂质体样品适量, 分装于5 mL安瓿中, 充氮后熔封.分别置于冰箱冷藏室(2-8℃)和室温(15-25℃)3 mo, 分别观察其外观、粒径和包封率.
1.2.7 盐酸洛拉曲克脂质体体外细胞毒性试验(MTT法): 我们同时采用两种人肝癌细胞株HepG2、QSQ7706, 当细胞呈对数级增殖时, 将细胞接种于96孔培养板中, 调整每孔细胞数为1×107/L, 加DMEM培养液180 μL, 分别加入不同浓度的盐酸洛拉曲克长循环脂质体(LCL-AG337)、盐酸洛拉曲克普通脂质体(CL-AG337)和游离盐酸洛拉曲克溶液(F-AG337), 分别继续培养2 h和 48 h.每孔中加入5 g/L的 MTT 20 μL, 继续培养4 h, 小心吸去每孔中的上清液, 每孔加入DMSO 200 μL, 振荡5 min后放置在酶标仪上, 测定A490吸收值, 用不含药物的空白脂质体和DMEM培养液作对照, 计算细胞杀伤率:
杀伤率 = (1-实验组A值/对照组A值)×100%
统计学处理 用SPSS软件进行直线回归和方差分析.
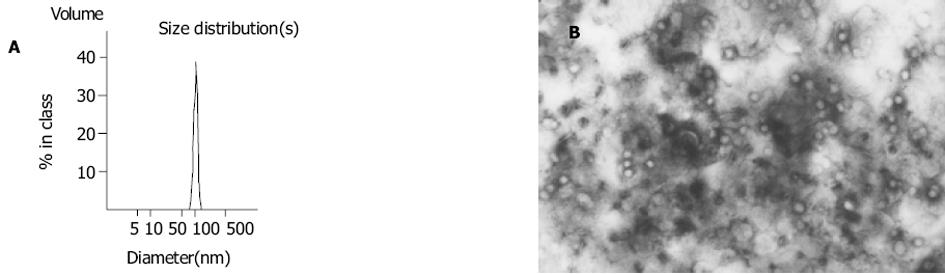
用薄膜挤压法-硫酸铵梯度法制备的盐酸洛拉曲克长循环脂质体的粒径为110±21 nm, 其粒径分布见图1A.电镜下可见LCL呈圆球状, 直径约110 nm左右, 见图1B.
盐酸洛拉曲克回归方程为A = 31.05C+0.081, r = 0.9999, P<0.001.回收率为(99.8±0.56%)(n = 3).
长循环脂质体的包封率为68%.脂质体在室温与冰箱中放置3 mo后, 平均粒径分别为105 nm 和109 nm, 包封率分别为原来的62%和95%, 由此可见室温贮藏3 mo脂质体的包封率下降较显著, 粒径则无明显变化.
由2 h组的IC50, 可见LCL-AG337对HepG2细胞株和QSG7703细胞株的杀伤作用与F-AG337和CL-AG337相较小得多, 而后二者则比较接近; 由48 h组的IC50, 虽然LCL- AG337的杀伤作用仍较弱, 但三者的值已较为接近(表1).
为了提高盐酸洛拉曲克的疗效, 采用两亲性DSPE-PEG2000制备LCL-AG337.由于DSPE-PEG2000的PEG部分提供了脂质体亲水表面, 交错重叠覆盖于脂质体表面, 形成致密的"蘑菇云".这种立体位阻降低了血浆蛋白与细胞表面配体的相互作用, 其立体位阻可同时屏蔽RES系统对脂质体的识别, 明显延长在血液中驻留时间, 有利于肿瘤组织的有效吸收.PEG链的长度和分子质量与脂质体的稳定性关系密切, 对于胶态脂质体, 分子质量在1-2 ku之间的PEG长循环效果最好[13].
应用长循环脂质体避免RES细胞摄取, 可以靶向到血管外肿瘤.许多实质性肿瘤血液供应比正常组织丰富, 血管通透性高, 粒径小于100 nm的隐形脂质体能从毛细血管渗漏出来, 并集中于肿瘤组织的内部间隙, 而正常组织其完整的毛细血管使得大部分脂质体不能渗透[14].但我们获得的LCL-AG337的粒径为110±21 nm, 仅小部分可以靶向血管外肿瘤, 是否确实还有待进一步的体内试验.我们下一步准备采用亲肿瘤活性小分子作为靶向装置, 掺入LCL-AG337, 提高其趋肿瘤靶向性, 使到达肿瘤的药物增加, 提高治愈率.
由表1的结果, 可以推测出由于DSPE-PEG2000的加入, LCL-AG337较CL-AG337有较好的稳定性和缓释性.2 h组的LCL-AG337由于稳定性较好, 释放较少的药物, 故其IC50比较大; 而CL-AG337由于稳定性没有LCL-AG337好, 释放较多的药物出来, 故其IC50比较接近F-AG337.48 h组的LCL- AG337由于经历时间较长, 药物基本已释放出来, 故三者的IC50较为接近.目前的这些资料仅仅显示了LCL-AG337在体外具有较好的稳定性和缓释性, 但尚缺体内的情况, 这是我们下一步的工作重点.
盐酸洛拉曲克为抗代谢类肿瘤化疗药物, 是具有我国独立知识产权的国家一类抗肿瘤新药.目前该药在美国进行Ⅲ期临床试验[15], 我国基本与美国同步.我们如能在此药尚未上市之前, 研制出能弥补盐酸洛拉曲克本身缺点的长循环脂质体以至靶向长循环脂质体, 则此药应用前景未可限量.
编辑: 张海宁
| 1. | Stout TJ, Stroud RM. The complex of the anti-cancer therapeutic, BW1843U89, with thymidylate synthase at 2. 0 A resolution: Implication for a new mode of inhibition. Structure. 1996;4:67-77. [PubMed] [DOI] |
| 2. | Rustum YM, Harstrick A, Cao S, Vanhoefer U, Yin MB, Wilke H, Seeber S. Thymidylate synthase inhibitors in cancer therapy: direct and indirect inhibitors. J Clin Oncol. 1997;15:389-400. [PubMed] [DOI] |
| 3. | Schiffer CA, Clifton IJ, Davisson VJ, Santi DV, Stroud RM. Crystal structure of human thymidylate synthase: a structural mechanism for guiding substrates into the active site. Biochemistry. 1995;34:16279-16287. [PubMed] [DOI] |
| 4. | Sakoff JA, Howitt IJ, Ackland SP, McCluskey A. Serine/threonine protein phosphatase inhibition enhances the effect of thymidylate synthase inhibition. Cancer Chemother Pharmacol. 2004;53:225-232. [PubMed] [DOI] |
| 5. | Wells P, Aboagye E, Gunn RN, Osman S, Boddy AV, Taylor GA, Rafi I, Hughes AN, Calvert AH, Price PM. 2-[11C]thymidine positron emission tomography as an indicator of thymidylate synthase inhibition in patients treated with AG337. J Natl Cancer Inst. 2003;95:675-682. [PubMed] [DOI] |
| 6. | Mok TS, Leung TW, Lee SD, Chao Y, Chan AT, Huang A, Lui MC, Yeo W, Chak K, Johnston A. A multi-centre randomized phase II study of nolatrexed Versus doxorubicin in treatment of Chinese patients with advanced hepatocellular carcinoma. Cancer Chemother Pharmacol. 1999;44:307-311. [PubMed] [DOI] |
| 7. | Staurt K, Tessitore J, Rudy J, Clendinnen N, Johnston A. A phaseII trial of nolatrexed dihydrochloride in patients with advanced hepatocellular carcinoma. Cancer. 1999;86:410-414. [PubMed] [DOI] |
| 9. | Moghimi SM, Szebeni J. Stealth liposomes and long circulating nanoparticles: critical issues in pharmacokinetics, opsonization and protein-binding properties. Prog Lipid Res. 2003;42:463-478. [PubMed] [DOI] |
| 10. | Bakker-Woudenberg IA. Long-circulating sterically stabilized liposomes as carriers of agents for treatment of infection or for imaging infectious foci. Int J Antimicrob Agents. 2002;19:299-311. [PubMed] [DOI] |
| 11. | Kallinteri P, Fatouros D, Klepetsanis P, Antimisiaris SG. Arsenic trioxide liposomes: encapsulation efficiency and in vitro stability. J Liposome Res. 2004;14:27-38. [PubMed] [DOI] |
| 12. | Maswadeh H, Demetzos C, Dimas K, Hatziantoniou S, Georgopoulos A, Rallis M, Dallas P, Papaioannou G. Accumulation of vinblastine into transfersomes and liposomes in response to a transmembrane ammonium sulfate gradient and their cytotoxic/cytostatic activity in vitro. Anticancer Res. 2001;21:2577-2583. [PubMed] |
| 13. | Kenworthy AK, Simon SA, McIntosh TJ. Structure and phase behavior of lipid suspensions containing phospholipids with covalently attached poly (ethylene glycol). Biophys J. 1995;68:1903-1920. [PubMed] [DOI] |
| 14. | Wu NZ, Da D, Rudoll TL, Needham D, Whorton AR, Dewhirst MW. Increased microvascular permeability contributes to preferential accumulation of Stealth liposomes in tumor tissue. Cancer Res. 1993;53:3765-3770. [PubMed] |
| 15. | Chu E, Callender MA, FarreII MP, Schmitz JC. Thymidylate synthase inhibitors as anticancer agents: from bench to bedside. Cancer Chemother Pharmacol. 2003;52:S80-89. [PubMed] [DOI] |