修回日期: 2005-03-27
接受日期: 2005-04-01
在线出版日期: 2005-06-15
目的: 对国产荧光标记杂交双探针PCR融解曲线法(FH-PCR-MC)检测乙型肝炎病毒聚合酶酪氨酸-蛋氨酸-天门冬氨酸-天门冬氨酸基序(HBV YMDD)变异的试剂进行临床应用评价.
方法: 慢性乙型肝炎患者外周血浆标本217份, 分别采用荧光标记Taqman探针定量PCR法(FT-PCR)和荧光标记杂交双探针PCR融解曲线法(FH-PCR-MC)检测HBV DNA含量和YMDD及其变异; 其中78份HBV DNA阳性标本采用基因型特异性多引物对巢式PCR法进行基因分型(A-F), 30份标本用PCR产物克隆测序法检测HBV YMDD及其变异.
结果: 血浆标本HBV DNA阳性率(≥1.0×106 copies/L)为75.6%(164/217).YMDD及其变异检出率为67.7%(147/217), 其中YMDD 44.9%(66/147), YIDD 22.5%(33/147), YVDD 17.7%(26/147), YIDD/YVDD混合株10.9%(16/147), 其他混合株4.0%(6/147); 结合HBV DNA含量, HBV YMDD及其变异的检出下限为HBV DNA = 5.0×106 copies/L, 但在106 copies/L时检出率较低, 仅为36.4%, 随着HBV DNA含量增高, 检出率显著增高(>80%), 且在107 copies/L时即有显著增高(χ2 = 7.177, P <0.01).在基因分型的78份标本中, C基因型占89.8%, B和D基因型分别占8.9%和1.3%, YMDD及其变异总检出率为100%,变异总检出率为59.0%; 1份D基因型YMDD及其变异检测为YIDD/YVDD混合变异; B, C两种基因型变异检出率分别为71.4%和55.7%, 但二者无统计学差异.以测序法的检测结果为相对标准,则FH-PCR-MC法检测HBV YMDD及其变异的相对敏感性、特异性和符合率分别为96.3%(26/27), 100%(3/3)和96.7%(29/30); 对于HBV YMDD及其变异的类型, 两种方法检测结果一致.
结论: FH-PCR-MC法是一种快速、特异的HBV YMDD及其变异检测方法, 具有较高的检出率, 且能区分YMDD及其变异的类型.
引文著录: 张淑云, 刘伟, 李迪, 谷鸿喜, 仰曙芬, 周志红, 杜博, 金茜, 常曼丽. 荧光标记杂交双探针PCR融解曲线法在临床的应用评价. 世界华人消化杂志 2005; 13(11): 1291-1294
Revised: March 27, 2005
Accepted: April 1, 2005
Published online: June 15, 2005
AIM: To evaluate a fluorescent hybridization biprobe PCR and melting curve assay for detection of (hepatitis B virus) YMDD mutation associated with lamivudine therapy.
METHODS: HBV DNA and YMDD mutations in the 217 clinical serum specimens from patients with chronic HBV infection who were treated with lamivudine (100 mg/d) were detected by the fluorescence quantitative polymerase chain reaction (PCR) using TaqMan probe (FT-PCR) and the fluorescent hybridization biprobe PCR and melting curve assay (FH-PCR-MC), respectively. Seventy-eight positive sera were then genotyped by nested PCR with six pairs of HBV genotype-specific primes (A to F), and the cloned DNA fragments derived from conventional PCR of HBV YMDD of 30 positive sera were sequenced.
RESULTS: Among 217 samples, 75.6%(164/217) were HBV DNA positive, and 67.7% (147/217) were HBV YMDD positive, including YMDD 44.9%(66/147), YIDD 22.5%(33/147),YVDD 17.7%(26/147),YI/VDD 10.9%(16/147), and others 4.0%(6/147). In HBV DNA≥107copies/L, all the positive and mutant rates of YMDD have no significant difference in different HBV DNA levels. Among 78 genotype samples (genotype C 89.8%, B 8.9% and D 1.3%), the positive and mutant rates of YMDD were 100%(78/78) and 58.97%(46/78) respectively. One genotype D was YIDD/YVDD. The mutant rates of YMDD in genotype B and C were 71.4% and 55.7% respectively, but have no marked difference (P >0.5). Using the results by DNA sequencing as reference standard, the relative specificity, sensitivity and over-all accordance of FH-PCR-MC were 96.3% (26/27), 100% (3/3) and 96.7% (29/30) respectively. The results of YMDD typing by FH-PCR-MC were confirmed by the sequencing of clones.
CONCLUSION: The fluorescent hybridization biprobe PCR and melting curve assay kit in detection of HBV YMDD mutation has high sensitivity and specificity. It is a convenient and rapid test kit, and may be used in YMDD genotyping.
- Citation: Zhang SY, Liu W, Li D, Gu HX, Yang SF, Zhou ZH, Du B, Jin X, Chang ML. Evaluation of fluorescent hybridization biprobe PCR and melting curve assay. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1291-1294
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1291.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1291
乙型肝炎病毒(HBV)可引起隐性感染、急性肝炎、慢性肝炎、肝硬化和肝癌等一系列疾病的发生[1-2].拉米夫定是目前较为有效的抗HBV药物, 但临床应用中不断有病毒对治疗无反应, 或长期用药后出现病毒含量升高和转氨酶异常等现象, 即存在或发生了拉米夫定耐药[2-3].研究发现拉米夫定耐药是由于HBV P基因区的变异所致, 在HBV基因序列上主要表现为739位A→G或741位G→T, 在HBV聚合酶上表现为酪氨酸-蛋氨酸-天门冬氨酸-天门冬氨酸(YMDD)基序改变, 即第522位蛋氨酸(M)被缬氨酸(V)或异亮氨酸(I)所取代, 形成M552V(YVDD)与M552I(YIDD)变异株[2-8].所以可应用HBV YMDD及其变异检测监控拉米夫定的疗效.目前常用的检测方法有基因克隆测序、限制性片断长度多态性分析(RFLP)、融解曲线法等[7-14].他们均应用PCR反应产物, 但克隆测序和RFLP较繁琐, 而且RFLP不能进行变异分型, 融解曲线法则是在荧光PCR后由仪器按程序自动完成, 无需PCR产物后处理, 简单、快速、防污染.我们用国产荧光标记杂交双探针PCR融解曲线法(FH-PCR-MC)检测YMDD及其变异的试剂对217份经拉米夫定治疗的慢性乙型肝炎患者外周血浆标本进行检测, 并以部分标本的PCR产物克隆测序结果为参比, 对该方法进行临床应用评价.
2003-03/2004-10慢性乙型肝炎患者外周血(EDTA抗凝)217份, 男177份, 女40份, 年龄13-63(平均39)岁, 诊断符合第10次全国病毒性肝炎及肝病学术会议讨论修订的诊断标准[15].所有患者均口服拉米夫定(100 mg/d)进行治疗, 时间为8-40 mo.乙肝病毒(HBV)核酸扩增(PCR)荧光定量检测(FT-PCR)试剂盒(灵敏度为5.0×105 copies/L)和HBV YMDD突变核酸扩增(PCR)荧光检测(FH-PCR-MC)试剂盒, 均购于深圳匹基生物工程有限公司; 基因分型、常规PCR、和测序引物由北京赛百盛公司合成, 其他试剂均购于Promega公司.仪器主要使用罗氏公司LightCycler荧光定量PCR仪、Bio-Rad基因扩增仪、Beckmen低温高速离心机天能凝胶成像分析仪等.
FT-PCR定量检测HBV DNA, 阳性率(≥1.0×106copies/L)为75.6%(164/217).FH-PCR-MC法检测YMDD及其变异, 检出率为67.7%(147/217), 其中YMDD 44.9%(66/147), YIDD 22.5%(33/147), YVDD 17.7%(26/147), YIDD/YVDD混合变异10.9%(16/147), 其他混合变异4.0%(6/147).结合HBV DNA含量, HBV YMDD及其变异的检出下限为HBV DNA≥5.0×106 copies/L, 但在106 copies/L时检出率较低, 仅为36.4%; 随着HBV DNA含量增高, 检出率明显增高(>80%), 且在107 copies/L时即有明显增高(χ2 = 7.177, P<0.01, 表1).基因分型的78份标本中, 共分出C, B和D三种基因型, 分别占89.8%、8.9%和1.3, C基因型占优势; YMDD及其变异总检出率为100%, 变异检出率为59.0%; 1份D型为YIDD/YVDD混合变异; B, C两种基因型的YMDD及其变异分布和变异检出率见表2, 两种基因型变异检出率经统计学处理无显著差异(表2).
| HBV DNA(copies/L) | n | YMDD | 变异类型 | 阴性 | YMDD及其变异检出率(%) | 变异检出率(%) | |||
| YIDD | YVDD | YIDD/YVDD | 其他 | ||||||
| ≥1010 | 61 | 28 | 11 | 8 | 10 | 3 | 1 | 98.4(60/61) | 53.3(60/61) |
| 109 | 48 | 19 | 10 | 8 | 6 | 3 | 2 | 95.8(46/48) | 58.7(27/46) |
| 108 | 25 | 9 | 6 | 6 | 4 | 84.0(21/25) | 57.1(12/21) | ||
| 107 | 19 | 7 | 5 | 4 | 3 | 84.2(16/19) | 56.3(9/16) | ||
| 106 | 11 | 3 | 1 | 7 | 36.4(4/11) | 25.0(1/4) | |||
| <106 | 53 | 53 | 0 | 0 | |||||
| 合计 | 217 | 66 | 33 | 26 | 16 | 6 | 70 | 67.7(147/217) | 55.1(81/147) |
| 基因型 | n | YMDD | 变异类型 | 变异检出率(%) | |||
| YIDD | YVDD | YIDD/YVDD | 其他 | ||||
| B | 7 | 2 | 2 | 1 | 1 | 1 | 71.4 |
| C | 70 | 31 | 17 | 14 | 5 | 3 | 55.7 |
用FH-PCR-MC法和PCR产物克隆测序法, 同时检测30份HBV DNA阳性标本, 其中1份标本(HBV DNA 2.1×108 copies/L)基因分型和FH-PCR-MC检测结果均阴性, 但测序法检测为YMDD和YVDD混合株.其他29份标本两种方法检测的结果均相符, 分别为YMDD 7份、YIDD 9份、YVDD 4分、YIDD/YVDD 5份和YIDD/YMDD 1份.如以测序法的检测结果为相对标准, 则FH-PCR-MC法检测HBV YMDD及其变异的相对敏感性、特异性和符合率分别为96.3%(26/27)、100%(3/3)和96.7%(29/30)(表3).
| 测序法 | n | FH-PCR-MC法 | |
| 阳性 | 阴性 | ||
| 阳性 | 27 | 26 | 1 |
| 阴性 | 3 | 0 | 3 |
| 合计 | 30 | 26 | 4 |
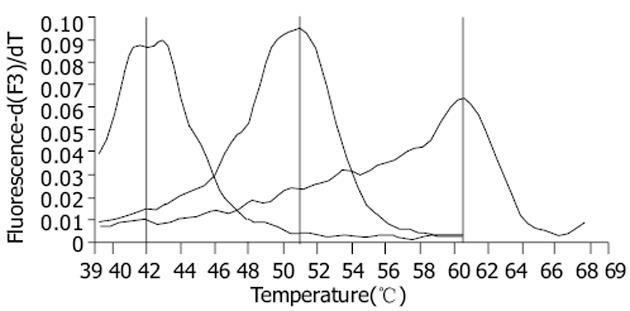
FH-PCR-MC法是基于LightCyclerTM杂交双探针技术和荧光共振能量转移(fluorescence resonance energy transfer FRET)原理, 再结合融解曲线分析的一种突变检测法[10-13].即杂交双探针荧光(定量)PCR完成后, 以恒定的变温速率缓慢地升高扩增产物的温度, 可测定PCR产物的解链温度(又称融解温度 Tm值).由于探针的设计是横跨预计的突变位点的, 在低温时, 探针与所有的DNA模板进行杂交, 信号量达到最大; 当温度缓慢升高时, 由于单个碱基的不同造成结合能力的不同, 最终表现为野毒株和变异株的解链温度不同.在此过程中仪器连续进行荧光信号监控, 可得到每一份标本的融解曲线图及Tm值, 与YMDD及其变异的标准质粒进行比较可以完全地区分YMDD及其变异类型, 从而达到突变检测及分型的目的, 此过程由仪器按照设定的程序自动完成, 仅需10 min.深圳匹基生物工程有限公司根据该原理开发的国产试剂盒, 标准质粒融解曲线图及Tm值见图1∶YVDD Tm值最高, 为(60.0±1.5)℃; 其次为野生型YMDD, 为(50.0±1.5)℃; 而YIDD Tm值最低, 为(42.5±1.5)℃.所以, FH-PCR-MC法具有简单、快速、直观, 且能最大限度防止PCR产物污染等优点.
国外有报道杂交双探针荧光定量PCR的敏感性2.0×105 copies/L[18-19], 与我们用的FT-PCR法检测HBV DNA的国产试剂一致.FH-PCR-MC法首先是通过杂交双探针荧光(定量)PCR对标本HBV DNA进行定性(定量), 再对阳性标本进行融解曲线分析.我们的临床应用结果表明, 该国产试剂的敏感性略低(5.0×106 copies/L), 分析原因可能与选择的扩增区域不同、检测的人群不同等有关, 其临床意义尚需进一步探讨, 他检测的阳性标本均可进行YMDD及其变异分型, 且无基因型差异.
通过部分标本的PCR产物克隆测序结果验证, 该方法的特异性和YMDD及其变异分型的准确性均较好, 相对敏感性略低.但该方法较测序法简便、易行和省时、省力, 且可多个样本同时检测, 更易于临床应用.另为国内外学者常用聚合酶链式反应-限制性片段长度多态性分析(PCR-RFLP)检测拉米夫定的相关变异[9-20], 国内也有PCR-ELISA法[21-22]的报道, 但二者操作步骤均相对繁琐(有PCR产物后处理), 而且只能检测有无变异, 不能检测变异类型.
总之, FH-PCR-MC法融合了PCR的高灵敏性、DNA杂交的高特异性和光谱技术的高精确度等优点, 直接检测PCR产物, 实行单管、闭管操作, 并能实时监测PCR后解链过程中荧光信号的变化, 操作简便快速, 结果直观明确.该方法不仅能准确、特异地检测YMDD及其变异, 而且能区分野生型、不同变异类型和混合型, 是一种较好的HBV YMDD及其变异检测方法.
编辑: 潘伯荣 审读: 张海宁
| 1. | Tran TT, Martin P. Hepatitis B: epidemiology and natural history. Clin Liver Dis. 2004;8:255-266. [PubMed] [DOI] |
| 2. | Humphries JC, Dixon JS. Antivirals for the treatment of chronic hepatitis B: current and future options. Intervirology. 2003;46:413-420. [PubMed] [DOI] |
| 3. | Quan DJ, Peters MG. Antiviral therapy: nucleotide and Nucleoside analogs. Clin Liver Dis. 2004;8:371-385. [PubMed] [DOI] |
| 4. | Allen MI, Deslauriers M, Andrews CW, Tipples GA, Walters KA, Tyrrell DL, Brown N, Condreay LD. Identification and characterization of mutations in hepatitis B virus resistant to lamivudine. Hepatology. 1998;27:1670-1677. [PubMed] [DOI] |
| 5. | Melegari M, Scaglioni PP, Wands JR. Hepatitis B virus mutants associated with 3TC and famiciclovir administration are replication defective. Hepatology. 1998;27:628-633. [PubMed] [DOI] |
| 6. | Wai CT, Fontana RJ. Clinical significance of hepatitis B virus genotypes, variants, and mutants. Clin Liver Dis. 2004;8:321-352. [PubMed] [DOI] |
| 7. | Ling R, Mutimer D, Ahmed M, Boxall HE, Elias E, Dusheiko GM, Harrison TJ. Selection of mutations in the hepatitis B virus polymerase during therapy of transplant recipients with lamivudine. Hepatology. 1996;24:711-713. [PubMed] [DOI] |
| 8. | Tipples GA, Ma MM, Fischer KP, Bain VG, Kneteman NM, Tyrrell DL. Mutation in HBV RNA-dependent DNA polymerase confers resistance to lamivudine in vivo. Hepatology. 1996;24:714-717. [PubMed] [DOI] |
| 9. | Suzuki F, Tsubota A, Arase Y, Suzuki Y, Akuta N, Hosaka T, Someya T, Kobayashi M, Saitoh S, Ikeda T. Efficacy of lamivudine therapy and factors associated with emergence of resistance in chronic hepatitis B virus infection in Japan. Interviology. 2003;46:182-189. [PubMed] [DOI] |
| 10. | Jardi R, Buti M, Cotrina M. Rapid detection of lamivudine-resistant hepatitis B virus polymerase gene variants. J Virol Methods. 1999;83:181-187. [PubMed] [DOI] |
| 11. | Cane PA, Cook P, Ratcliffe D, Mutimer D, Pillay D. Use of real-time PCR and fluorimetry to detect lamivudine resistance-associated mutations in hepatitis B virus. Antimicrob Agents Chemother. 1999;43:1600-1608. [PubMed] |
| 12. | Bernard PS, Wittwer CT. Homogeneous amplification and variant detection by fluorescent hybridization. Clin Chem. 2000;46:147-148. [PubMed] |
| 13. | Whalley SA, Brown D, Teo CG, Dusheiko GM, Saunders NA. Monitoring the emergence of hepatitis B virus polymerase gene variants during lamivudine therapy using the LightCycler. J Clin Microbiol. 2001;39:1456-1459. [PubMed] [DOI] |
| 16. | Naito H, Hayashi S, Abe K. Rapid and specific genotyping system for hepatitis B virus corresponding to six major genotypes by PCR using type-specific primes. J Clin Microbiol. 2001;39:362-364. [PubMed] [DOI] |
| 17. | 谷 鸿喜, 徐 子龙, 刘 建宇, 钟 照华, 王 华庆, 张 淑云, 李 迪, 张 海红, 阿 部贤治. 多引物对巢式PCR法检测HBV基因型的流行病学分析. 世界华人消化杂志. 2004;12:1073-1076. [DOI] |
| 18. | Brechtbuehl K, Whalley SA, Dusheiko GM, Saunders NA. A rapid real-time quantitative polymerase chain reaction for hepatitis B virus. J Virol Methods. 2001;93:105-113. [PubMed] [DOI] |
| 19. | Ho SK, Yam WC, Leung ET, Wong LP, Leung JK, Lai KN, Chan TM. Rapid quantification of hepatitis B virus DNA by real-time PCR using fluorescent hybridization probes. J Med Microbiol. 2003;52:397-402. [PubMed] [DOI] |