修回日期: 2005-04-05
接受日期: 2005-04-09
在线出版日期: 2005-06-15
目的: 探讨中药清肝排毒饮对刀豆蛋白A(Con A)所致免疫性肝损伤的保护作用.
方法: 40只NIH小鼠随机分为5组, 分别为正常对照组,模型组、清肝排毒饮大剂量组、小剂量组和联苯双酯治疗组.除正常对照组外, 其他组于实验首日iv Con A 20 mg/kg后, 清肝排毒饮大剂量组、小剂量组和联苯双酯组均灌胃口服, 每天1次, 连续3 d, 末次给药后4 h, 再次iv Con A 20 mg/kg, 8 h后检测血浆ALT活性、IFN-γ和TNF-α含量, 观察肝组织病理学变化.
结果: 清肝排毒饮大剂量组小鼠ALT活性、IFN-γ和TNF-α含量均明显低于模型组(ALT: 1 314.8±831.3 vs 2 373.3±957.9 nkat/L, t = 2.36, P = 0.03; IFN-γ: 34.0±14.4 vs 49.6±19.0 ng/L, t = 2.20, P = 0.04; TNF-α: 56.3±6.0 vs 114.5±8.4 ng/L, t = 15.90, P = 0.00, 但与联苯双酯组比较, 差异无显著性意义(P均>0.05); 清肝排毒饮大剂量组肝脏病理改变明显减轻.
结论: 清肝排毒饮对Con A所致小鼠免疫性肝损伤具有较好的保护作用, 抑制T淋巴细胞活化和IFN-γ,TNF-α的释放是其主要的作用机制.
引文著录: 李常青, 刘丽丽, 朱宇同, 赵昉, 陈诗慧. 中药清肝排毒饮对刀豆蛋白A所致小鼠免疫性肝损伤的保护作用. 世界华人消化杂志 2005; 13(11): 1283-1286
Revised: April 5, 2005
Accepted: April 9, 2005
Published online: June 15, 2005
AIM: To investigate the protective effects of Qingganpaiduyin (QGPDY) against hepatic immune injury induced by concanavalin A (Con A).
METHODS: Forty NIH mice were randomly divided into 5 groups: normal control group (group A), model group (group B), high dosage group of QGPDY (group C), low dosage group of QGPDY (group D) and bifendate group (group E). Except the mice in group A, those in other groups were injected with Con A (20 mg/kg) via the tail vein at the 1st day of experiment. The mice in Group C and D were administered with QGPDY at a dose of 40 g/kg and 20 g/kg respectively. The mice in Group E were administered with bifendate by gastric perfusion (150 mg/kg). All the drugs were given once daily for 3 days consecutively. At the last time, when drugs were administered for 4 hours, the mice were injected with Con A once again at the same dosage. Blood sample were collected at the 8th hour after Con A administration for determining the activity of aminotransferase (ALT), the concentrations of interferon-gamma (IFN-γ) and tumor necrosis factor alpha (TNF-α). Histopathological examination for liver tissue was also performed.
RESULTS: The activity of ALT, the concentrations of IFN-γ and TNF-α in group C were obviously lower than those of group B(ALT: 1 314.8±831.3 vs 2 373.3±957.9 nkat/L, t = 2.36,P = 0.03; IFN-γ: 34.0±14.4 vs 49.6±19.0 ng/L, t = 2.20, P = 0.04; TNF-α: 56.3±6.0 vs 114.5±8.4 ng/L, t = 15.90, P = 0.00), but no significant difference as compared with group E (P>0.05 for ALT, IFN-γ and TNF-α respectively). Hepatic histopathological changes were alleviated in group C.
CONCLUSION: QGPDY has a good protective effects against hepatic immune injury induced by Con A by suppressing the activation of the T-lymphocytes and reducing the release of IFN-γ and TNF-α.
- Citation: Li CQ, Liu LL, Zhu YT, Zhao F, Chen SH. Protective effects of Qingganpaiduyin against hepatic immune injury induced by concanavalin A in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1283-1286
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1283.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1283
乙肝病毒持续感染是导致乙型肝炎慢性化、肝硬化和原发性肝癌的重要因素.目前认为乙型肝炎病毒并不直接损害肝细胞, 而是通过宿主免疫应答引起肝细胞损伤, 出现相应的临床表现.清肝排毒饮是由柴胡、连翘、大青叶、芍药等组成的中药复方制剂, 具有清热解毒、疏肝利胆作用, 主要用于慢性乙型肝炎的治疗.为探讨该复方对免疫性肝损伤的保护作用效果, 我们以NIH小鼠为实验对象, 对刀豆蛋白A(Con A)所致免疫性肝损伤模型进行治疗, 观察作用效果并探讨其作用机制.
NIH小鼠, ♂, 体质量18-22 g, 广东省医学实验动物中心提供, 刀豆蛋白A为美国华盛顿生物药品公司产品; 清肝排毒饮中的组方药材柴胡, 连翘, 大青叶, 芍药和甘草购自广州中医药大学第一附属医院, 经水提浓缩至相当于生药量40 g/L; 联苯双酯滴丸, 北京协和药厂生产, 每丸含联苯双酯7.5 mg.谷丙转氨酶检测试剂盒购自上海申索试剂有限公司, 小鼠IFN-γ和TNF-α定量检测试剂盒购自上海森雄科技实业有限公司, 752型紫外分光光度计(上海第三分析仪器厂), Bio-Tek ELX8000自动酶标仪(Bio-Tek instrument INC), Olympus CK40-F200显微镜(Olympus Optical Co.Ltd).
造模方法参照文献[1], NIH小鼠40只随机分为5组, 每组8只, 分别为正常对照组、模型组、清肝排毒饮大剂量组、小剂量组(40 g/kg, 20 g/kg, 分别相当于10倍、5倍临床用药剂量)和联苯双酯(150 mg/kg)治疗组, 除正常对照组外, 其余小鼠于实验首日上午尾iv Con A 20 mg/kg, 并于第1, 2, 3 d下午各给药1次, 清肝排毒饮大剂量组、小剂量组和联苯双酯组均灌胃口服, 末次给药后4 h, 模型组和各给药组小鼠一次性静脉注射Con A 20 mg/kg, 禁食, 不禁水, 8 h后摘小鼠眼球取血, 离心分离血浆; 取肝左叶组织, 40 g/L甲醛溶液固定, 石蜡包埋切片, 常规HE染色后行光镜病理观察.血浆ALT活性检测采用赖氏法, 按试剂盒说明操作, 用752型紫外分光光度计于波长505 nm处检测吸光值, 制定标准曲线, 换算成ALT值.血浆IFN-γ和TNF-α定量测定 采用双抗体夹心ABC-ELISA法, 按试剂盒说明操作, 用Bio-Tek ELX8000自动酶标仪于波长490 nm处检测吸光值, 制定标准曲线, 换算成IFN-γ和TNF-α定量值.
统计学处理 采用SPSS10.0软件包进行统计分析, 多组计量资料分析采用One way ANOVA, 多重比较采用LSD.
模型组小鼠ALT活性、IFN-γ和TNF-α含量较正常对照组明显升高, 二者比较差异有显著性意义(t = 5.19, 3.63, 16.91, P<0.01, 表1).清肝排毒饮大剂量组小鼠ALT活性、IFN-γ和TNF-α含量均明显低于模型组, 差异有显著性意义(t = 2.36, 2.20, 15.90, P<0.05, 0.01).清肝排毒饮大剂量组与联苯双酯组比较, 小鼠ALT活性、IFN-γ和TNF-α含量的差异无显著性意义(t = 0.62, 1.10, 0.64, P>0.05).
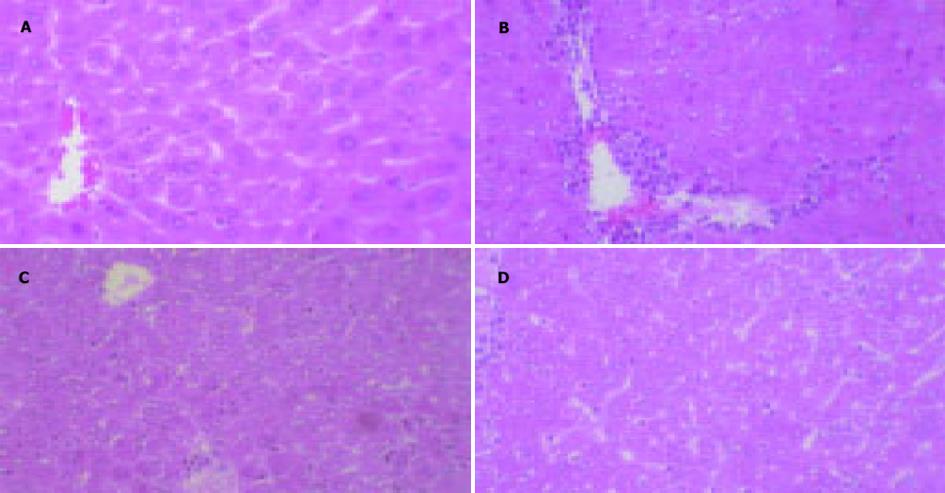
光镜下见正常组肝细胞以中央静脉为中心呈放射状排列, 肝窦未见异常.模型组全部小鼠肝组织均出现明显病变, 小叶内大多数肝细胞肿胀, 细胞质疏松化, 可见凋亡小体、有的呈气球样变, 可见明显的点状坏死和灶性坏死, 坏死灶可见大量炎性细胞浸润; 汇管区淋巴细胞和单核细胞炎性浸润尤为明显, 肝窦内可见红细胞瘀积.清肝排毒饮大剂量组和联苯双酯组部分肝组织可见散在点状坏死和灶性坏死, 肝细胞损伤程度明显减轻, 炎性细胞浸润显著减少(图1A-D).
Con A是一种可活化T细胞的有丝分裂原, ConA诱导的小鼠免疫性肝损伤模型, 与其他中毒性肝损伤模型如四氯化碳模型、D-氨基半乳糖模型相比, 被认为更适合研究人类病毒性肝炎和自身免疫性肝病的病理机制和进行抗肝损伤的药物筛选[2-23].辅助性T细胞(TH细胞)和巨噬细胞是该动物模型的效应细胞, ConA活化TH细胞后刺激TH细胞和巨噬细胞共同产生过量的IFN-γ和TNF-α等细胞因子, 已证实TNF-α为细胞因子网络中介导肝损伤的终末递质, 他既是肝细胞凋亡的正性触发因子, 且直接损伤血管内皮细胞, 亦可活化中性粒细胞促进其趋化聚集于肝脏, 释放蛋白酶或氧自由基引起肝细胞凋亡或坏死[24-25].细胞因子IFN-γ、TNF-α是引起急性肝损伤的重要炎症递质[26-27], T淋巴细胞活化后产生的IFN-γ是巨噬细胞的重要激活剂, 对促进肝内Kupffer细胞参与炎症反应和刺激巨噬细胞分泌TNF-α起作重要作用[28], 研究表明, 预先给予抗-IFN-γ, 或抗-TNF-α, 均可完全阻断Con A诱发的小鼠肝损伤[29-30] .
本研究结果显示, 3 d内两次静脉注射Con A 20 mg/kg, 模型组小鼠血浆ALT活性升高, IFN-γ、TNF-α含量增加; 病理学检查发现, Con A组小鼠肝组织汇管区内大量炎性细胞浸润, 且有点状和灶性坏死.该结果再次证实T淋巴细胞活化导致IFN-γ分泌增加及刺激巨噬细胞释放过多TNF-α是Con A性肝损伤的主要病理机制.
本研究结果显示, 清肝排毒饮大剂量组对Con A诱发的小鼠急性免疫性肝损伤模型, 具有明显的保护作用, 表现为谷丙转氨酶活性降低、肝组织病理变化减轻; 清肝排毒饮大剂量治疗组小鼠血浆IFN-γ和TNF-α含量明显低于模型组(P<0.05), 表明清肝排毒饮可通过抑制T淋巴细胞活化和IFN-γ、TNF-α的释放发挥抗肝损伤作用; 清肝排毒饮对小鼠ALT活性、TNF-α和IFN-γ含量的影响, 呈现明显的量效关系, 该结果为清肝排毒饮的进一步开发和临床应用提供了依据.
编辑: 潘伯荣 审读: 张海宁
| 1. | 李 向阳, 邝 幸华, 周 映云, 杨 子峰, 张 奉学, 朱 宇同. 叶下珠复方制剂对刀豆蛋白A所致小鼠肝损伤的保护作用. 中华癌症姑息医学杂志. 2002;1:19-25. |
| 2. | Tiegs G, Hentschel J, Wendel A. A T cell-dependent experimental liver injury in mice inducible by Concanavalin A. J Clin Invest. 1992;90:196-203. [PubMed] [DOI] |
| 6. | Knolle PA, Gerken G, Loser E, Dienes HP, Gantner F, Tiegs G, Meyer zum Buschenfelde KH, Lohse AW. Role of sinusoidal endothelial cells of the liver in Concanavalin A-induced hepatic injury in mice. Hepatology. 1996;24:824-829. [PubMed] [DOI] |
| 9. | Rehermann B. Intrahepatic T cells in hepatitis B: viral control versus liver cell injury. J Exp Med. 2000;191:1263-1268. [PubMed] [DOI] |
| 16. | 李 小刚, 王 天才, 唐 望先, 李 绍白. 肿瘤坏死因子在刀豆蛋白A诱导的肝损伤中的作用. 湖北省卫生职工医学院学报. 1999;1:1-4. |
| 17. | 张 修礼, 秦 一中, 韩 絮琳, 万 谟彬, 权 启镇, 孙 自勤, 王 要军, 江 学良, 李 文波. 环孢菌素A阻断刀豆蛋白A诱发昆明小鼠肝损害的研究. 解放军医学杂志. 2001;26:507-508. |
| 24. | Gantner F, Leist M, Lohse AW, Germann PG, Tiegs G. Concanavalin A-induced T-cell-mediated hepatic injury in mice: the role of tumor necrosis factor. Hepatology. 1995;21:190-198. [PubMed] |
| 27. | Kusters S, Gantner F, Kunstle G, Tiegs G. Interferon gamma plays a critical role in T cell-dependent liver injury in mice initiated by Concanavalin A. Gastroenterology. 1996;111:462-471. [PubMed] [DOI] |
| 29. | Mizuhara H, Uno M, Seki Y, Yamashita M, Yamaoka M, Ogawa T, Kaneda K, Fujii T, Senoh H, Fujiwara H. Critical involvement of interferon gamma in the pathogenesis of T-cell activation-associated hepatitis and regulatory mechanisms of interleukin-6 for the manifestations of hepatitis. Hepatology. 1996;23:1608-1615. [PubMed] [DOI] |