修回日期: 2005-03-25
接受日期: 2005-04-08
在线出版日期: 2005-06-15
目的: 研究反义核酸技术体外抑制MUC2的表达,观察MUC2反义脱氧寡核苷酸(antisense oligodeoxynucleotide, ASODN)对胃癌细胞生长的抑制作用.
方法: 应用硫代磷酸修饰的MUC2 ASODN 经阳离子脂质体包裹后转染入人胃癌细胞株SGC7901, 采用MTT法, 形态学观察, 免疫组化法及流式细胞仪检测MUC2 ASODN对胃癌细胞的增殖抑制作用.
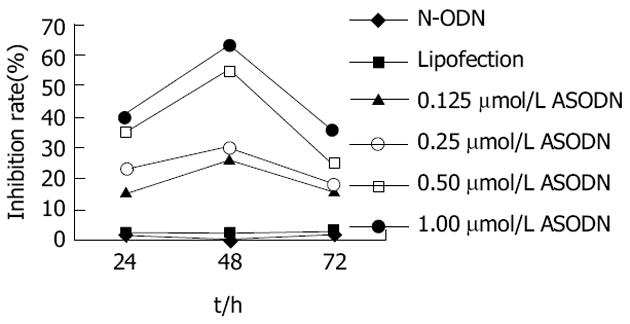
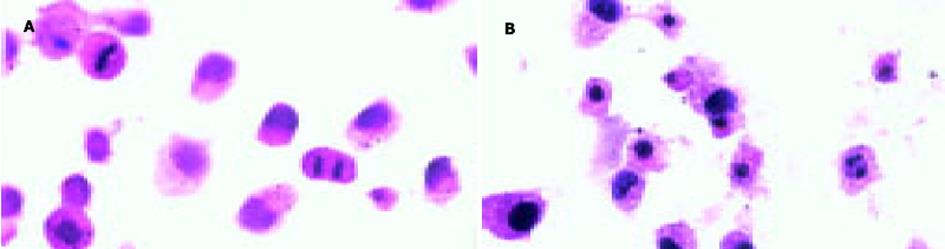
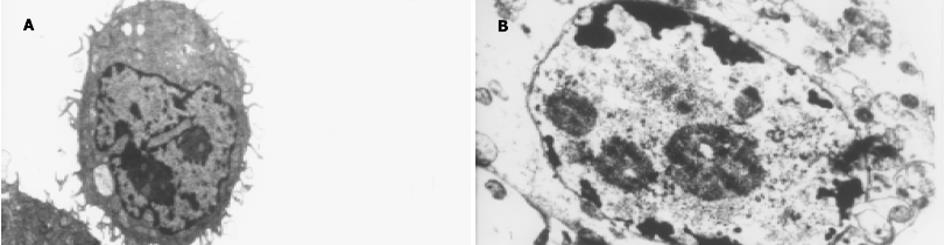
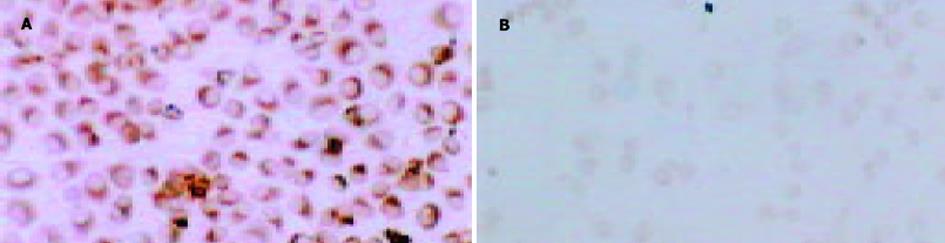
结果: 不同浓度ASODN均能抑制SGC7901细胞的增殖, 在48 h时最强, 0.5 mol/L ASODN对细胞的抑制率为55%, 随时间延长抑制作用逐渐减弱.SGC7901细胞转染MUC2 ASODN后, 与对照组相比, 光镜下观察到细胞数量减少, 体积变小, 核分裂明显减少, 同时可见较多的坏死.流式细胞仪检测发现细胞主要被阻滞在S期. 透射电镜下见细胞线粒体肿胀, 细胞内脂滴增多, 髓样结构, 染色质边集等.免疫组化S-P法染色显示转染ASODN后, SGC7901细胞 中MUC2, nm23蛋白表达水平明显降低, p16蛋白表达明显增强.
结论: 转染MUC2 反义寡核苷酸能有效抑制胃癌细胞株SGC7901的增殖.
引文著录: 张晓艳, 易永芬, 肖春卫. 反义MUC2体外抑制胃癌细胞的增殖活性. 世界华人消化杂志 2005; 13(11): 1278-1282
Revised: March 25, 2005
Accepted: April 8, 2005
Published online: June 15, 2005
AIM: To investigate the inhibitory effect of mucin gene (MUC2) antisense oligodeoxynucleotides (ASODNs) on proliferation of gastric cancer cells SGC7901.
METHODS: Phosphorothioate MUC2 ASODNs were synthesized and then transfected into gastric carcinoma SGC7901 cells mediated by lipofectin. The inhibitory effects on cell proliferation were determined by MTT method, light and electronic microscopy, flow cytometry (FCM) and immunohistochemistry.
RESULTS: MUC2 ASODN at varied concentration significantly inhibited the growth of SGC7901 cells in a dose- and time-dependent manner. The inhibitory peak appeared at 48th hour after transfection, and the inhibition rate reached 55% when the concentration of MUC2 ASODN was 0.5 mol/L. After transfected with MUC2 ASODN, SGC7901 cells decreased in number, volume and karyokinesis, increased in necrosis under light microscopy. And most of the cells arrested in S phase. Swollen mitochondrion, increased liposomes, myelin figures, chromatin margination were found under electronic microscopy. Immunohistochemistry indicated that after transfected with MUC2 ASODN, the expression of MUC2 and nm23 protein were down-regulated, but the expression of p16 protein was up-regulated.
CONCLUSION: MUC2 ASODN transfection can significantly inhibit the proliferation of gastric carcinoma SGC7901 cells.
- Citation: Zhang XY, Yi YF, Xiao CW. MUC2 antisense oligodeoxynucleotide inhibits proliferation of human gastric carcinoma cells in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1278-1282
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1278.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1278
流行病学研究显示83%的胃癌患者曾有胃黏膜肠型化生[1-2], 其是胃组织逐步向胃癌发展过程中的重要一步[3-5].胃黏膜肠型化生后表达多种肠黏膜的标志物如粘蛋白MUC2等.MUC2是以胶体形式存在的一种分泌型黏液基因蛋白, 正常时只在小肠和空肠的杯状细胞有表达, 在正常胃黏膜中并无表达.我们在前期研究中发现, MUC2在胃癌组织中的表达与肿瘤的生物学行为密切相关, 表达MUC2的肿瘤浸润程度深, 淋巴结转移较早[1].我们采用反义核酸技术观察MUC2反义寡核苷酸对SGC7901细胞的生长抑制作用.
人胃腺癌细胞株SGC7901由重庆医科大学病理教研室提供;RPMI1640培养基购自Gibco公司;小牛血清购自杭州四季清公司;MUC2, nm23, p16 mAb和SP试剂盒购于福州迈新公司;寡核苷酸委托上海生工合成;阳离子脂质体Lipofectin 购自Invitrogen life technologies公司.
人胃腺癌细胞株SGC7901培养于含100 mL/L小牛血清的RPMI 1640培养液中, 置于37℃, 50 mL/L CO2培养箱中使其贴壁生长.细胞贴壁80%时传代, 每周约2次.MUC2反义寡脱氧核苷酸(antisense oligodeoxynucleotide, ASODN)序列与MUC2基因的串联重复区互补[6], 由18个碱基组成, 其正义链为5'-GTGGTGGTGGTGATGGGT-3', 反义链序列为5'-ACCCATCACCACCACCAC-3', 反义链均用硫代磷酸修饰;无关对照寡聚核苷酸(N-ODN)由18个碱基随机组成, 序列为5'-GCTAGGATCTGGAGCTCG-3', 经基因库检索不与已有的已知编码序列互补.N-ODN及ASODN均用硫代磷酸修饰.制备脂质体-ODN复合物前将ODN稀释于100 L无血清无抗生素的RPMI 1640培养液中, 加入同样方法稀释的脂质体, 混匀, 室温放置5-10 min, 即可形成脂质体-ODN复合物, 并立即用于细胞处理, 脂质体及ODN用量参考说明书.取对数生长期细胞用无血清、无抗生素RPMI 1640稀释, 接种细胞悬液100 L于96孔培养板, 细胞密度为1×108/L, 实验分空白对照组、脂质体对照组(含脂质体2 mg/L)、1.0 mol/L N-ODN对照组(含1.0 mol/L N-ODN及脂质体2 mg/L)、0.125 mol/L ASODN处理组(含0.125 mol/L ASODN及脂质体0.25 mg/L)、0.25 mol/L ASODN处理组(含0.25 mol/L ASODN及脂质体0.5 mg/L)、0.5 mol/L ASODN处理组(含0.5 mol/L ASODN及脂质体1.0 mg/L)、1.0 mol/L ASODN处理组(含1.0 mol/L ASODN及脂质体2 mg/L)7组.每组接种5孔.转染时, 分别将细胞各处理组与总体积为50 L脂质体-ODN复合物充分混匀, 细胞对照组加入同等体积的无血清无抗生素的RPMI 1640培养液.培养5 h后, 各组另添加含血清RPMI 1640培养液70 L继续培养.分别于转染24, 48, 72 h后离心弃去上清液.加入无血清RPMI 1640培养液200 L及5 g/ L MTT 20 L继续培养4 h, 离心弃去上清液, 再加入200 L DMSO(二甲基亚砜)振荡, 并立即于自动酶标仪(EL312e型, Bio-Tek Instruments 公司)490 nm波长处测定各孔吸光度值.然后按下列计算细胞抑制率, 其公式为抑制率 = (1-实验组平均吸光度值/对照组平均吸光度值)×100%.实验均重复3次.
1.2.1 细胞形态与周期: 分为细胞空白对照组及0.5 mol/L脂质体-ASODN作用组2组.取对数生长期细胞用无血清无抗生素RPMI 1640稀释, 将1×108/L细胞10 mL接种到100 mL培养瓶中.转染时, 处理组将细胞与总体积为5 mL脂质体-ASODN复合物充分混匀, 空白对照组加入同等体积的无血清无抗生素RPMI 1640培养液.培养5 h后, 处理组和对照组另添加含血清RPMI 1640培养液7 mL继续培养48 h后, 常规胰酶消化, 离心, 弃上清, 用PBS 1 mL重悬细胞后, 移至EP管中, 再离心、弃上清, 用4℃戊二醛固定细胞团块.送电镜室制标本, 透射电镜观察.取爬片细胞(爬片细胞处理同免疫组化法)行HE染色, 光镜观察MUC2反义寡核苷酸封闭前后细胞形态的改变.另分为细胞空白对照组及0.5 mol/L脂质体-ASODN作用组2组.细胞处理后(细胞处理同电镜处理法), 常规胰酶消化、离心, PBS液洗涤, 再离心弃去PBS液, 加入4℃预冷的700 mL/L乙醇, 混匀, 4℃保存, 用流式细胞仪进行细胞周期分析.
1.2.2 MUC2, P16, nm23的表达: 细胞爬片时分为2组, 空白对照组和0.5 mol/L脂质体-ASODN作用组.取对数生长期细胞用无血清无抗生素RPMI 1640稀释, 将1×108/L的细胞500 L接种于预置无菌小盖玻片的24孔板中, 转染时将处理组细胞与总体积为250 L ASODN-脂质体复合物充分混匀, 空白对照组加入同等体积的无血清无抗生素RPMI 1640培养液.培养5 h后, 添加含血清RPMI 1640培养液250 L继续培养.48 h后取出盖玻片, PBS液漂洗3次, 4℃丙酮固定5 min, 然后按试剂说明书行S-P染色.阳性标准 :胞质出现棕黄颗粒为MUC2阳性细胞, 胞质出现棕黄颗粒为nm23阳性细胞;胞核/胞质中出现棕黄色颗粒为p16阳性细胞.
统计学处理 采用SPSS10.0专业统计软件, 用F检验, t检验, 采用P<0.05为统计学的显著差异.
空白对照组、脂质体对照组及N-ODN对照组之间, SGC7901细胞的增殖情况无明显差异.不同浓度ASODN均能抑制SGC7901细胞的增殖(与对照组比较P<0.05, F检验), 且对细胞生长抑制作用随ASODN浓度的增加而增高, 抑制作用在48 h最强.0.125 mol/L ASODN、0.25 mol/L ASODN、0.5 mol/L ASODN、1.0 mol/L ASODN作用48 h对细胞的抑制率分别为26%, 30%, 55%, 63%.随作用时间的延长, 抑制作用逐渐减弱(图1).
对照组肿瘤细胞圆形或短梭形, 细胞密度大, 体积大小不一, 核偏位, 异型性明显, 核浆比例增加, 有较多核分裂相.而脂质体-ASODN作用组细胞密度明显减小, 体积减小, 大小较一致, 几乎不见核分裂, 可见明显染色质边集、核固缩、核碎裂、核溶解(图2).透射电镜下对照组肿瘤细胞核浆比例大, 核膜清晰, 有明显核仁, 染色质清晰, 线粒体等细胞器正常, 细胞膜可见绒毛样结构.而ASODN作用组细胞有明显肿胀, 溶解, 染色质边集, 细胞内有较多脂滴, 线粒体肿胀, 出现髓样结构(图3).
流式细胞仪分析显示0.5 mol/L ASODN作用SGC7901细胞48 h后发现反义抑制MUC2 能诱导细胞凋亡, G1期峰左侧出现明显的亚G1期峰.与对照组相比较, S期细胞百分比明显增加, G0/G1 期细胞百分比下降, G2/M 期细胞二者相近, 细胞滞留于S期.处理组凋亡细胞占4.38%(表1).
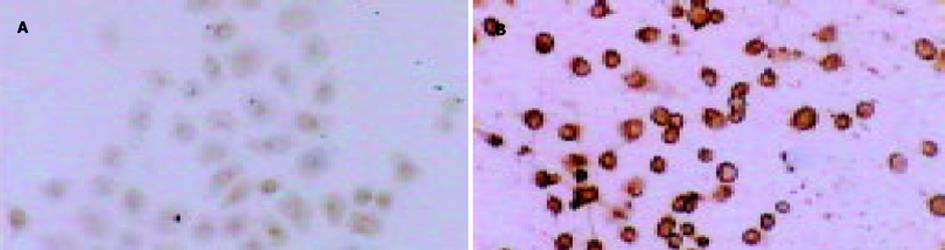
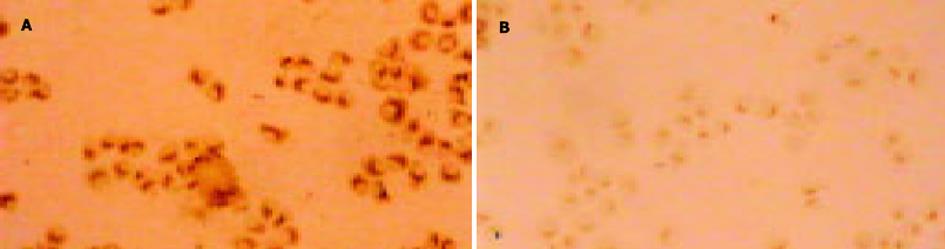
用0.50 mol/L ASODN作用SGC7901细胞48 h后, 免疫组化染色发现对照组MUC2蛋白染色强, 可见胞质均匀棕黄着色, 反义组无明显胞质着色, 说明转染MUC2 ASODN后, MUC2蛋白表达水平明显降低(图4).用0.5 mol/L ASODN作用SGC7901细胞48 h后, 免疫组化染色发现对照组p16蛋白染色极弱, 而反义组可见明显胞核/胞质棕褐色着色, 说明转染MUC2 ASODN后, p16蛋白表达水平显著增强(图5).用0.5 mol/L ASODN 作用SGC7901细胞48 h后, 免疫组化染色发现对照组胞质nm23蛋白着色较强, 反义组染色很弱, 说明转染MUC2 ASODN后, nm23蛋白表达水平明显降低(图6).
反义核酸技术是20世纪80年代出现的一种应用反义核酸类药物来抑制特定基因表达为目的的基因治疗技术.最常用的转移载体是阳离子脂质体, 他通过电荷的作用与核酸结合成颗粒将其携带进入细胞[7].MUC2基因位于染色体11p15.5位点上, 首先在小肠黏膜的cDNA表达文库中克隆得到, 是调节小肠杯状细胞表达粘蛋白的主要基因.其编码的MUC2蛋白是一种分泌型的糖蛋白, 包含有两个中央重复序列[8].MUC2正常时只在小肠和结肠的杯状细胞表达, 在正常的胃黏膜中没有表达, 胃黏膜肠型化生后, MUC2在杯状细胞及不成熟的柱状细胞和吸收细胞中都有表达, 在肿瘤细胞中, 其表达呈增高趋势, 并且呈弥漫的胞质着色[9].我们采用脂质体作为载体, 将与MUC2基因串联重复区互补的、经硫代磷酸修饰的反义寡核苷酸导入MUC2蛋白高表达的胃癌细胞株SGC7901中, 探讨其对胃癌细胞的增殖抑制作用及其机制.研究结果显示, 用脂质体介导的MUC2 ASODN转染SGC7901细胞后, 可有效降低MUC2蛋白的表达, 阻滞细胞的有丝分裂从而抑制胃癌细胞株SGC7901的增殖, 并可引起细胞的凋亡.而脂质体及无义对照组无此效应.MUC2 ASODN对肿瘤细胞增殖抑制作用具有明显的时效性及量效性, 作用时间以48 h为最佳, 随时间延长, 抑制作用减弱.经MUC2 ASODN转染的肿瘤细胞, 有明显的变性坏死, 光镜下见明显的核固缩, 核碎裂, 核溶解等.电镜下, 可见髓样结构, 细胞内脂滴增多, 线粒体肿胀, 染色质边集等改变.表明MUC2基因具有促进胃癌细胞增殖的作用.p16基因在生化功能上与细胞增殖周期紧密相关, 并通过细胞周期与其他癌基因及肿瘤抑制基因相互作用, 成为正常细胞增殖的负调控因子.p16基因表达产物p16INK4的作用是抑制CDK4和CDK6的活性, 使pRb磷酸化减少, 从而阻断cyclinD、pRb等介导的转录因子E2F的活化, 影响了众多的癌基因的转录, 最终抑制细胞增殖.在胃癌中p16蛋白的表达明显下降, 研究表明他与胃癌的浸润与转移密切相关[10-12].本研究结果显示, 胃癌细胞SGC7901中p16蛋白表达极弱, 说明p16蛋白失活, 但经用脂质体介导的MUC2 ASODN转染后, 肿瘤细胞p16蛋白表达显著增强.也即SGC7901细胞中MUC2经反义抑制后, 肿瘤抑制基因p16活性大大增强, 提示胃癌发生过程中, MUC2的畸形表达, 可导致肿瘤抑制基因p16的活性下降, 从而促进胃癌细胞的恶性增殖.曾普遍认为nm23基因是一种肿瘤转移抑制基因, 目前发现在侵袭转移中不同部位的癌肿他的作用不尽相同, 他的表达产物核苷二磷酸激酶在不同的组织中广泛存在, 其与细胞信号传导密不可分, 但在肿瘤中的作用存在争议.研究发现其与以往抑制肿瘤转移相反的结果, 他在实验中发现nm23在胃癌中的表达与恶性程度呈正相关, 随着TNM分期的逐级增加, nm23的表达增多.同时肠型胃癌表达的nm23比弥漫型胃癌要高[13-14].我们在实验中显示反义抑制MUC2后, nm23的表达下降.提示胃癌的发展与nm23的表达升高相关.此外, 近年来文献相关MUC2的报道存在争议:CDX2在调节细胞的增殖与分化方面起着很重要的作用[15], Mesquita et al发现在肠癌及胃癌中CDX-2同源蛋白可直接调控MUC2基因的转录从而促进MUC2的表达;Perrains et al对肺癌细胞系NCI-H292研究表明, MUC2是EGFR配体的目标基因, MUC2基因的上调, 导致EGFR/Ras/Raf细胞外信号调节激酶通路的激活, 从而促进细胞分裂和增殖;关于MUC2的作用也有相反的报道, 如Velcich et al在其构建的MUC2基因遗传缺陷鼠研究显示, MUC2具有维持肠的自稳态, 他的缺乏可导致细胞增殖增加, 凋亡减少, 及肠上皮细胞迁移率的增加, MUC2基因失活可引起肠肿瘤生成并伴有自发性进展成为浸润性癌;但是我们的试验结果提示反义抑制MUC2可以相对抑制胃癌细胞的生长, 导致细胞的凋亡, 部分逆转其恶性表型.
总之, 使用人工合成的MUC2反义寡核苷酸, 可特异抑制体外胃癌细胞株MUC2的表达, 抑制细胞的恶性增殖.本研究对MUC2在胃癌发生机制中的作用和对胃癌的基因治疗有一定的理论意义和潜在的应用价值.
编辑: 潘伯荣 审读:张海宁
| 1. | Zhang HK, Zhang QM, Zhao TH, Li YY, Yi YF. Expression of mucins and E-cadherin in gastric carcinoma and their clinical significance. World J Gastroenterol. 2004;10:3044-3047. [PubMed] [DOI] |
| 2. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 3. | Filipe MI, Linehan JM, Durrant LG, Price MR, Smeeton NC, Pathak S, Swallow DM. Expression of a peptide epitope of the colonic mucin MUC2 in precursor lesions to gastric carcinoma. Eur J Cancer Prev. 1996;5:287-295. [PubMed] [DOI] |
| 4. | Reis CA, David L, Correa P, Carneiro F, de Bolos C, Garcia E, Mandel U, Clausen H, Sobrinho-Simoes M. Intestinal metaplasia of human stomach displays distinct patterns of mucin (MUC1, MUC2, MUC5AC, and MUC6) expression. Cancer Res. 1999;59:1003-1007. [PubMed] |
| 5. | Silva E, Teixeira A, David L, Carneiro F, Reis CA, Sobrinho-Simoes J, Serpa J, Veerman E, Bolscher J, Sobrinho-Simoes M. Mucins as key molecules for the classification of intestinal metaplasia of the stomach. Virchows Arch. 2002;440:311-317. [PubMed] [DOI] |
| 6. | Bresalier RS, Ho SB, Schoeppner HL, Kim YS, Sleisenger MH, Brodt P, Byrd JC. Enhanced sialylation of mucin-associated carbohydrate structures in human colon cancer metastasis. Gastroenterology. 1996;110:1354-1367. [PubMed] [DOI] |
| 7. | Islam A, Handley SL, Thompson KS, Akhtar S. Studies on uptake, sub-cellular trafficking and efflux of antisense oligodeoxynucleotides in glioma cells using self-assembling cationic lipoplexes as delivery systems. J Drug Target. 2000;7:373-382. [PubMed] [DOI] |
| 8. | Gum JR, Byrd JC, Hicks JW, Toribara NW, Lamport DT, Kim YS. Molecular cloning of human intestinal mucin cDNAs. Sequence analysis and evidence for genetic polymorphism. J Biol Chem. 1989;264:6480-6487. [PubMed] |
| 9. | Ho SB, Shekels LL, Toribara NW, Kim YS, Lyftogt C, Cherwitz DL, Niehans GA. Mucin gene expression in normal, preneoplastic, and neoplastic human gastric epithelium. Cancer Res. 1995;55:2681-2690. [PubMed] |
| 10. | Schmidt EE, Ichimura K, Reifenberger G, Collins VP. CDKN2 (p16/MTS1) gene deletion or CDK4 amplification occurs in the majority of glioblastomas. Cancer Res. 1994;54:6321-6324. [PubMed] |
| 11. | Zhou Y, Gao SS, Li YX, Fan ZM, Zhao X, Qi YJ, Wei JP, Zou JX, Liu G, Jiao LH. Tumor suppressor gene p16 and Rb expression in gastric cardia precancerous lesions from subjects at a high incidence area in northern China. World J Gastroenterol. 2002;8:423-425. [PubMed] [DOI] |
| 12. | Zhang QX, Ding Y, Le XP, Du P. Studies on microsatellite instability in p16 gene and expression of hMSH2 mRNA in human gastric cancer tissues. World J Gastroenterol. 2003;9:437-441. [PubMed] [DOI] |
| 13. | Muller W, Schneiders A, Hommel G, Gabbert HE. Expression of nm23 in gastric carcinoma: association with tumor progression and poor prognosis. Cancer. 1998;83:2481-2487. [PubMed] [DOI] |
| 14. | Lee KE, Lee HJ, Kim YH, Yu HJ, Yang HK, Kim WH, Lee KU, Choe KJ, Kim JP. Prognostic significance of p53, nm23, PCNA and c-erbB-2 in gastric cancer. Jpn J Clin Oncol. 2003;33:173-179. [PubMed] [DOI] |
| 15. | Silberg DG, Swain GP, Suh ER, Traber PG. Cdx1 and cdx2 expression during intestinal development. Gastroenterology. 2000;119:961-971. [PubMed] [DOI] |