修回日期: 2005-04-06
接受日期: 2005-04-09
在线出版日期: 2005-06-15
目的: 探讨胃癌内核转录因子κB(nuclear factor-κB, NF-κB)活化对血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的影响及对预后的影响.
方法: 选择胃癌根治术切除标本41例, 应用免疫组织化学方法测定NK-κB, VEGF及CD34的表达, 检测结果与胃癌临床病理学多参数进行经统计分析.
结果: NF-κB呈活化型型表达者占受检病例的68.3%, VEGF呈强阳性表达者占受检病例的70.73%.NF-κB活化型表达组与VEGF高表达组有较高一致性(κ = 0.393, P = 0.012).NF-κB与VEGF同时表达组微血管密度明显较NF-κB与VEGF同时阴性组高(P = 0.000), NF-κB与VEGF同时表达组生存期明显短于NF-κB与VEGF同时阴性组(P = 0.035).
结论: 胃癌细胞通过活化NF-κB信号通道促进VEGF高表达, 从而影响肿瘤内微血管密度及预后.
引文著录: 陈贵, 于颖彦, 谢岳林, 尹浩然, 朱正纲. NF-κB上调VEGF表达影响胃癌预后. 世界华人消化杂志 2005; 13(11): 1275-1277
Revised: April 6, 2005
Accepted: April 9, 2005
Published online: June 15, 2005
AIM: To investigate the up-regulation of vascular endothelial growth factor (VEGF) induced by the activation of nuclear factor-κB (NF-κB) and its effect on the prognosis of gastric carcinoma.
METHODS: Forty-one gastric carcinoma specimens were obtained by surgery and the expression of NF-κB, VEGF and CD34 were detected in paraffin-embedded tissue sections by immunohistochemical method.
RESULTS: NF-κB was activated and expressed in 68.3% (28/41) gastric carcinoma and VEGF was expressed in 70.7% (29/41). A significant correlation was found between NF-κB activation and VEGF expression(k = 0.393, P = 0.012). The microvessel Density in co-expression of NF-κB and VEGF group was significantly higher than that in non-expression group (P = 0.000). The co-expression of NF-κB and VEGF group showed markedly poorer prognosis than that did in non-expression group (P = 0.035).
CONCLUSION: The activation of NF-κB contributes to tumor angiogenesis in gastric carcinoma by up-regulation of VEGF, which results in a poorer prognosis.
- Citation: Chen G, Yu YY, Xie YL, Yin HR, Zhu ZG. Effect of VEGF expression up-regulated by nuclear factor-κB prognosis of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1275-1277
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1275.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1275
NF-κB是一种重要的核转录调控因子, 其广泛存在于各种细胞中, 通过调控众多下游基因的转录参与机体免疫应答、炎症反应、细胞凋亡及肿瘤形成过程[1].血管内皮生长因子(vascular endothelial growth factor, VEGF)是受NF-κB调控的促血管生长因子之一, VEGF通过促进内皮细胞增殖、增加血管通透性及改变细胞外基质以利于肿瘤内新生血管形成, 并能影响宿主免疫功能、利于肿瘤扩散和转移[2].NF-κB信号通道可以诱导大肠癌细胞VEGF表达增加从而促进肿瘤微血管形成, 同时NF-κB还具有促进大肠癌细胞增生、抑制细胞凋亡作用[3-4], 但缺乏与胃肠道肿瘤预后相关性报道.我们从蛋白表达水平结合临床随访结果探讨了胃癌组织中NF-KB活化对VEGF表达调控乃至对肿瘤微血管密度(microvessel density, MVD)及预后影响如下.
胃癌根治术切除标本41例, 年龄36-77(平均59.7)岁, 男:女为3.5∶1, 全部病例均获随访结果, 随访时间1-9 a.胃癌临床病理分期采用1997年国际抗癌联合会第5次修订的TNM分期法:I期10例, II期12例, III期15例, IV期4例.组织病理学采用Lauren病理分型:肠型22例(56.7%), 弥漫型10例(24.4%), 混合型9例(22.0%).
VEGF mAb(工作浓度1∶50)和兔抗人NF-κB p65多克隆抗体(工作浓度1∶200)购自美国Santa Cruz公司;CD34 mAb(工作浓度1∶50)和Envision试剂盒购自于丹麦Dako公司.
应用免疫组化Envision二步法进行染色, 切片常规脱蜡, 应用1 mmol/L EDTA pH8.0缓冲液抗原热修复20 min, 30 mL/LH2O2阻断内源性过氧化酶10 min, 第一抗体4℃孵育过夜.Envinsion试剂孵育30 min, DAB光镜控制下显色, 苏木素复染, 封片, 显微镜下进行结果判定.NF-κB以细胞核内出现棕黄色颗粒的细胞数超过10%定为活化型表达;VEGF以10%以上肿瘤细胞胞质出现棕褐色颗粒定为阳性表达.其中10-50%阳性定为弱阳性, 50%以上肿瘤细胞阳性定为强阳性.CD34阳性血管密度计算应用美国Image Pro Plus图像分析软件, 在胃癌浸润前缘选择3个微血管密度高区, 测定每平方毫米内的血管数目(个/mm2).
统计学处理 数据采用Fisher确切概率法及t检验进行分析, 应用Kaplan Meier法及Log rank检验进行生存率分析, P<0.05作为有显著差异.所有统计处理均由SPSS10.0软件完成.
在41例胃癌中28例(68.3%)NF-κB呈活化型表达(图1).VEGF在胃癌细胞有不同程度表达, 其中29/41例(70.7%)的癌细胞质内有VEGF强阳性表达(图2).NF-κB活化型表达组与VEGF高表达组有较高一致性, Kappa一致性检验提示二者有相关性(κ = 0.393, P = 0.012).NF-κB与VEGF同时表达组MVD明显较NF-κB与VEGF同时阴性组高(20.70/±8.04 vs 8.14/±4.9 mm2, P = 0.000).
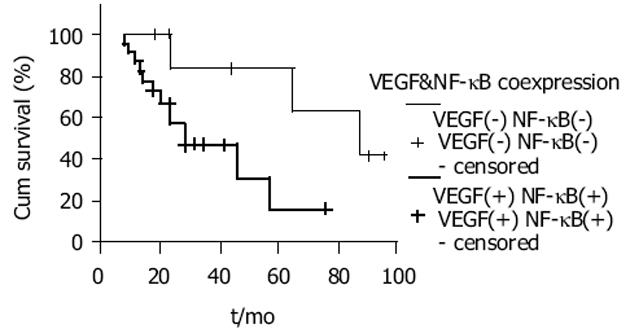
NF-κB活化型表达同时伴有VEGF表达组胃癌平均生存期明显短于NF-κB及VEGF阴性表达组(37.7±5.8% vs 75.9±10.9%, P = 0.035), 经生存期分析显示两组之间具有显著性差异(图3).
NF-κB平时以同源或异源性二聚体的非活性形式存在于几乎所有类型细胞的胞质中, 只在各种刺激因素作用下才被激活.NF-κB除与机体的免疫应答、炎症反应密切相关外, 还参与调控细胞增殖和凋亡相关基因, 在肿瘤的发生过程中起重要作用.我们曾报道胃癌细胞存在NF-κB的活化形式, 呈NF-κB活化表达的胃癌其临床生存期明显较NF-κB阴性组短, 其确切机制除癌周淋巴细胞NF-κB活化后机体抗肿瘤免疫增强参与其中外, 可能还涉及肿瘤细胞自身特性的改变[5-6].为此, 现就NF-κB活化对其下游基因产物VEGF的调控从而导致肿瘤微血管密度增加对胃癌预后的研究进行了研究.VEGF是实体瘤内新生血管形成的主要调节系统, 参与肿瘤的发生、发展及转移过程, 该基因的转录受NF-κB信号通道活化的调控.越来越多的实验显示, 抑制NF-κB信号通道活化可以明显抑制VEGF表达及微血管形成[7-9].肿瘤细胞合成的VEGF分布于肿瘤血管周围, VEGF与血管内皮细胞膜的KDR受体结合, 诱导血管生成[10].肿瘤的生长可分为无血管期和有血管期.在无血管期, 肿瘤主要依靠与周围组织的弥散来获取营养和排泄代谢产物.当肿瘤发展到1-2 mm直径大小时进入有血管期, 肿瘤内出现新生毛细血管并获得进一步的生长能力, 肿瘤迅速生长并可发生转移[11].本结果表明NF-κB呈活化型表达组胃癌VEGF表达呈显著增强, 且NF-κB与VEGF共表达组胃癌生存期明显短于NF-κB与VEGF阴性组, 统计学处理显示NF-κB活化型表达与VEGF表达之间存在相关性.NF-κB与VEGF均表达组肿瘤内微血管密度明显增加, 提示NF-κB活化型表达造成胃癌预后差的原因之一是通过上调VEGF表达促进微血管形成从而加速肿瘤生长与转移所致.然而, 上调VEGF表达只是NF-κB活化的表现之一.鉴于NF-κB作为细胞内重要转录因子参与多种与细胞增殖、凋亡相关基因的调控, 不能排除NF-κB呈活化型表达组预后差可能与胃癌细胞增殖能力及抗凋亡能力等其他生物学指标改变有关, 故胃癌中NF-κB活化与其他生物学指标等的关系均值得深入探讨.
编辑: 潘伯荣 审读:张海宁
| 1. | Wulczyn FG, Krappmann D, Scheidereit C. The NF-κB/Rel and IkB gene families: Mediators of immune response and inflammation. J Mol Med. 1996;74:749-769 [PMID:. |
| 2. | Huang S, Robinson JB, Deguzman A, Bucana CD, Fidler IJ. Blockade of Nuclear Factor-κB Signaling Inhibats Angiogenesis and Tumorigenicity of Human Ovarian Cancer Cells by Suppressing Expression of Vascular Endothelial Growth Factor and Interleukin 8. Cancer Res. 2000;60:5334-5339. |
| 7. | Xiong HQ, Abbruzzese JL, Lin E, Wang L, Zheng L, Xie K. NF-kappaB activity blockade impairs the angiogenic potential of human pancreatic cancer cells. Int J Cancer. 2004;108:181-188. [PubMed] [DOI] |
| 8. | Fujioka S, Sclabas GM, Schmidt C, Niu J, Frederick WA, Dong QG, Abbruzzese JL, Evans DB, Baker C, Chiao PJ. Inhibition of constitutive NF-kappa B activity by I kappa B alpha M suppresses tumorigenesis. Oncogene. 2003;22:1365-1370. [PubMed] [DOI] |
| 9. | Shibata A, Nagaya T, Imai T, Funahashi H, Nakao A, Seo H. Inhibition of NF-kappaB activity decreases the VEGF mRNA expression in MDA-MB-231 breast cancer cells. Breast Cancer Res Treat. 2002;73:237-243. [PubMed] [DOI] |