修回日期: 2005-04-01
接受日期: 2005-04-08
在线出版日期: 2005-06-15
目的: 建立福氏志贺杆菌2a 2457T的免疫蛋白质组学研究方法.
方法: 提取福氏志贺杆菌2a 2457T全菌蛋白进行不同pH梯度的双向电泳, 结合Western Blotting技术寻找发生免疫反应的蛋白质.
结果: 蛋白经胶内酶切后使用基质辅助激光解析/电离飞行时间(MALDI-TOF)质谱鉴定了19个免疫反应蛋白点, 对应于10种蛋白质.
结论: 该文成功建立了福氏志贺杆菌2a 2457T的免疫蛋白质组学研究方法, 为寻找保护性抗原的工作打下了基础.
引文著录: 应天翼, 廖翔, 冯尔玲, 王恒樑, 黄留玉, 黄翠芬. 福氏志贺杆菌2a 2457T免疫蛋白质组学方法的建立. 世界华人消化杂志 2005; 13(11): 1272-1274
Revised: April 1, 2005
Accepted: April 8, 2005
Published online: June 15, 2005
AIM: To evaluate the application of immunoproteomics methods in research on Shigella flexneri 2a 2457T
METHODS: The whole cell proteins of Shigella flexneri 2a 2457T were extracted to perform two-dimensional polyacrylamide electrophoresis of different pH gradient, and then Western blotting was used to screen immunogenic proteins.
RESULTS: After in-gel digestion, nineteen immunoreactive spots were identified by matrix-assisted laser desorption ionization-time of flight mass spectrometry (MALDI-TOF-MS), representing 10 protein entries.
CONCLUSION: The immunoproteomics methods can be successfully applied in identifying immunogenic proteins of Shigella flexneri 2a 2457T, which helps to search for the protective antigens in future.
- Citation: Ying TY, Liao X, Feng EL, Wang HL, Huang LY, Huang CF. Application of immunoproteomics methods in research on Shigella flexneri 2a 2457T. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1272-1274
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1272.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1272
痢疾是全世界范围内流行的肠道传染病, 在发达国家偶有爆发, 而在发展中国家却是造成腹泻的重要原因.我国流行的主要是福氏痢疾, 所以对其进行深入研究意义十分重大.以前对于痢疾杆菌抗原的寻找主要集中在多糖方面, 对蛋白质则由于研究手段的局限而报道很少.我们在对福氏志贺杆菌2457T建立了双向电泳图谱的基础上[1], 建立免疫蛋白质组学研究方法, 从而对其抗原进行较为全面的分析, 为痢疾疫苗的研究工作打下基础.
所用菌株为福氏志贺杆菌2 a 2457T.在LB培养基中37℃培养过夜, 按1∶100转接至新鲜培养基中, 37℃ 250 r/min培养至稳定期早期, A600为3.3时中止培养.细菌培养条件同上.实验用大耳白家兔, 耳缘静脉注射活菌免疫原, 间隔5 d, 免疫6次, 第1次5亿, 第2次7.5亿, 第3次10亿, 第4次15亿, 第5次20亿, 第6次20亿.末次免疫后8 d开始采血测定凝集效价, 至1∶5 120时收集血清.
参照文献[1], 使用2-D Quant Kit(Amersham Biosciences, USA)测定蛋白质浓度.取1 mg总蛋白样品上样至18 cm固相pH梯度干胶条.等电聚焦条件为重泡胀6 h, 30 V 6 h, 500 V 1 h, 1000 V 1 h, 8 000-50 000 V/h, 第2向SDS-PAGE胶浓度为125 g/L.将凝胶通过半干转印至硝酸纤维素膜, 丽春红染色10 min, 水洗脱色并迅速用针头在膜上刺孔来定位蛋白点, 扫描后进行Western Blotting, 实验方法参照文献[2].将考马斯亮蓝染色胶、丽春红染色以及Western Blotting显色的膜图形进行比对以确定免疫反应蛋白点.从考马斯亮蓝染色胶上切取相应蛋白点, 胶内酶切的方法参见文献[3].质谱检测在国家生物医学分析中心完成, 使用Reflex.III MALDI-TOF-MS(Bruker, German)质谱仪.数据库查询使用Mascot(http://www.matrixscience.com)在相应数据库中进行肽质量指纹图谱检索.同时在国家生物医学分析中心使用2457T株基因组本地运行Mascot检索.
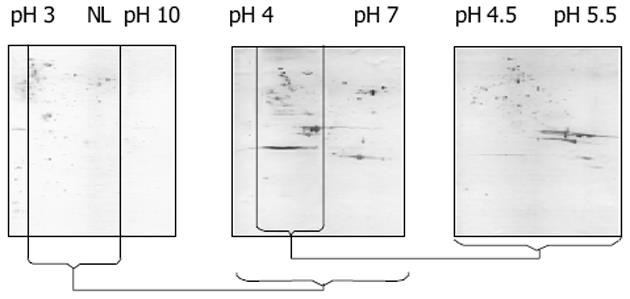
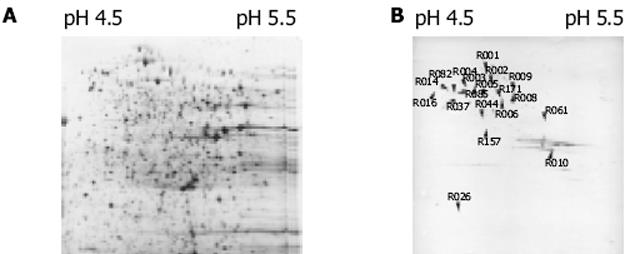
为不同pH梯度双向电泳后Western Blotting结果(图1).pH4.5-pH5.5双向电泳银染色图(图2A), 为同一样品所做Western Blotting结果(图2B).从考马斯亮蓝染色胶上取点经胶内酶切后使用MALDI-TOF质谱鉴定了19个免疫反应蛋白点, 对应于10种蛋白质.鉴定出的蛋白点编号标注在图中, 其他信息列于表1.在pH3-10图中由于蛋白点密集, 不便于统计有免疫反应的点数目.在pH4-7图中有120个, 在pH4.5-5.5图中有131个.
| No | 蛋白名称 | 基因名 | NCBI登录号 | 功能分类 |
| R001 | chaperone Hsp70; autoregulated | dnaK | gi|30061584 | Protein fate |
| R085 | heat shock protein | |||
| R002 | GroEL, chaperone Hsp60, | mopA | gi|30065518 | Protein fate |
| R003 | peptide-dependent ATPase, heat | |||
| R004 | shock protein | |||
| R008 | ||||
| R014 | ||||
| R016 | ||||
| R037 | ||||
| R005 | outer membrane channel TolC t | olC | gi|30064385 | cellular processes |
| R171 | ||||
| R006 | membrane-bound ATP synthase, | atpA | gi|30064961 | Energy metabolism |
| R157 | F1 sector, alpha-subunit | |||
| R044 | galactose-1-epimerase(mutarotase) | galM | gi|30062088 | Central intermediary |
| metabolism | ||||
| R082 | fructose-bisphosphate aldolase, class II | fba | gi|30064233 | Energy metabolism |
| R061 | phosphoglycerate kinase | pgk | gi|30064234 | Energy metabolism |
| R010 | galactose-binding transport | mglB | gi|30063593 | Transport and binding proteins |
| protein;receptor for galactose taxis | ||||
| R026 | PTS system, glucose-specific IIA component | crr | gi|30063811 | Transport and binding proteins |
| R009 | outer membrane fluffing protein | gi|30064307 | Cell envelope |
GroEL, DnaK和AtpA等高丰度且免疫原性强的蛋白都被鉴定出来, 这与一些实验室对其他病原微生物的免疫蛋白质组学研究结果吻合[4-6].GalM, Fba, Pgk, MglB以及Crr等参与能量代谢或转运系统的蛋白质, 则在该实验中首次被鉴定出抗原性.以上这些蛋白质看起来虽然不可能成为保护性抗原, 但是他们或许可能成为判定病菌感染的标志性蛋白.TolC以及outer membrane fluffing protein均属于定位在外膜上的蛋白.Outer membranefluffing protein的序列与大肠杆菌的抗原43(Antigen 43)蛋白很相似, 抗原43在生物膜(biofilm)的形成过程中扮演重要的角色, 但是其确切的功能目前尚不清楚[7-8].TolC是革兰阴性菌外膜上普遍存在的一种孔道蛋白, 而孔道家族的蛋白由于在药物抗性以及致病因子分泌方面中的重要地位而日益受到关注.最典型的模型就是大肠杆菌的溶血素分泌系统以及AcrAB/TolC药物排泄泵[9].目前我们在本次实验的基础上正进行深入的研究以确认他是否有可能成为理想的保护性抗原.
对于以往的SDS-PAGE而言, 理论上一块胶可分辨100条带, 而双向电泳可以分辨100×100个点, 优势不言而喻, 这时采用Western Blotting的方法可以大大提高抗原蛋白的检出率, 辅助以生物质谱技术则可以直接鉴定出蛋白质, 可以认为该方案是寻找抗原的良好技术平台.通过本次实验我们初步建立了免疫蛋白质组学研究的技术平台, 但是从中还是可以发现尚存在一些问题:首先, 通过对双向电泳胶的分析可以看出, 在窄pH梯度胶条上蛋白质的分辨效果明显好于宽梯度的, pH3-10上的点显色后由于挤在一起而模糊一片, 在pH4-7的胶条上有所改观, 而在pH4.5-5.5的胶条上则基本可以分离出单个的蛋白质点.所以为了提高蛋白质点的分辨率, 应该尽量采用多个不同窄梯度胶条叠加的方法.其次, 由于Western Blotting的灵敏度很高(与银染接近), 所以检测出来的蛋白点不一定能够在制备型的考马斯亮蓝染色胶上检测到, 而考马斯亮蓝染色是目前比较流行的质谱兼容的染色方法.由于蛋白质抗原抗体反应后的显色与染料对蛋白质染色的机理不同, 所以膜上检测到的蛋白点也不一定能在分析型的银染胶上对应出来.由于中间需要用比考马斯亮蓝染色灵敏度更低的丽春红染色来衔接定位, 则更难以准确地将胶上和膜上的蛋白质点一一对应起来.可能的解决办法有:(1)采用银染胶取蛋白点进行胶内酶切并生物质谱鉴定, 但是目前还不是很成熟, 不能得到广泛的应用;(2)采用在胶内直接Western Blotting的方法, 切下蛋白点后胶内酶切并质谱鉴定.该方法所需抗体量比较大、操作有一定难度, 应用受到一定限制, 但是对转膜时易丢失的小分子量蛋白有优势;(3)将显色后的膜剪下来, 溶解后提取蛋白进行质谱鉴定, 该方法目前趋于成熟, 技术改进层出不穷, 相信不久即可得到普遍应用[10-11].另外, 由于使用的是全菌蛋白, 所以其中一些高丰度蛋白遮蔽了为数众多的低丰度蛋白, 造成由于含量过低而难以检测到目的蛋白.解决办法是使用抗体亲和层析的办法去除高丰度蛋白, 或者采用特殊方法提取特定的蛋白质, 如专一性提取外膜蛋白来进行抗原的寻找工作.
编辑: 潘伯荣 审读:张海宁
| 1. | Liao X, Ying TY, Wang HL, Wang J, Shi ZX, Feng EL, Wei KH, Wang YL, Zhang XM, Huang LY. A two-dimensional proteome map of Shigella flexneri. Electrophoresis. 2003;24:2864-2882. [PubMed] [DOI] |
| 2. | Wu M, Stockley PG, Martin II WJ. An improved Western blotting technique effectively reduces background. Electrophoresis. 2002;23:2373-2376. [PubMed] [DOI] |
| 4. | Haas G, Karaali G, Ebermayer K, Metzger WG, Lamer S, Zimny-Arndt U, Diescher S, Goebel UB, Vogt K, Roznowski AB. Immunoproteomics of Helicobacter pylori infection and relation to gastric disease. Proteomics. 2002;2:313-324. [PubMed] |
| 5. | Bini L, Sanchez-Campillo M, Santucci A, Magi B, Marzocchi B, Comanducci M, Christiansen G, Birkelund S, Cevenini R, Vretou E. Mapping of Chlamydia trachomatis proteins by Immobiline-polyacrylamide two-dimensional electrophoresis: Spot identification by N-terminal sequencing and immunoblotting. Electrophoresis. 1996;17:185-190. [PubMed] [DOI] |
| 6. | Nilsson I, Utt M, Nilsson HO, Ljungh , Wadstrom T. Two-dimensional electrophoretic and immunoblot analysis of cell surface proteins of spiral-shaped and coccoid forms of Helicobacter pylori. Electrophoresis. 2000;21:2670-2677. [PubMed] [DOI] |
| 7. | Henderson IR, Meehan M, Owen P. Antigen 43, a phase-variable bipartite outer membrane protein, determines colony morphology and autoaggregation in Escherichia coli K-12. FEMS Microbiol Lett. 1997;149:115-120. [PubMed] |
| 8. | Danese PN, Pratt LA, Dove SL, Kolter R. The outer membrane protein, Antigen 43, mediates cell-to-cell interactions within Escherichia coli biofilms. Mol Microbiol. 2000;37:424-432. |
| 9. | Andersen C. Channel-tunnels: outer membrane components of type I secretion systems and multidrug efflux pumps of Gram-negative bacteria. Rev Physiol Biochem Pharmacol. 2003;147:122-165. [PubMed] [DOI] |
| 10. | Huang ZY, Fan HZ, Yang PY. An improved method for in-solution digestion of proteins after gel separation. Mol Cell Proteomics. 2004;3:S286. [PubMed] [DOI] |
| 11. | Dufresne-Martin G, Lemay JF, Lavigne P, Klarskov K. Peptide mass fingerprinting by matrix-assisted laser desorption ionization mass spectrometry of proteins detected by immunostaining on nitrocellulose. Proteomics. 2005;5:55-66. [PubMed] [DOI] |