修回日期: 2005-03-15
接受日期: 2005-03-22
在线出版日期: 2005-06-15
目的: 通过正、反义T-STAR (testis-signal transduction and activator of RNA)基因转染结肠癌HCT-116细胞, 观察对细胞端粒酶活性的影响.
方法: 用脂质体Lipofectamine法将正、反义T-STAR基因转染入HCT-116细胞, 用RT-PCR及Western blot方法检测该细胞T-STAR基因mRNA和蛋白表达变化, 并用PCR-ELISA法检测细胞端粒酶活性改变.
结果: 在T-STAR转染的结肠癌HCT-116细胞中, T-STAR mRNA和蛋白表达显著增加(分别为296%, 180%, P<0.01), 端粒酶活性明显升高;而在反义T-STAR转染的细胞中, T-STAR mRNA和蛋白表达显著下降(分别为59%, 83.8%, P<0.01), 端粒酶活性明显降低.转染空白载体和未转染细胞中T-STAR表达极端粒酶活性无显著性差异.
结论: 结肠癌HCT-116细胞T-STAR基因可能参与细胞端粒酶活性的正相调节.
引文著录: 张玲, 郭莲, 彭勇, 陈兵. T-STAR基因对结肠癌细胞系HCT-116端粒酶活性的影响. 世界华人消化杂志 2005; 13(11): 1267-1271
Revised: March 15, 2005
Accepted: March 22, 2005
Published online: June 15, 2005
AIM: To investigate the effects of testis-signal transduction and activator of RNA (T-STAR) on telomerase activity in human colon cancer cell line HCT-116.
METHODS: The T-STAR sense or antisense gene was transfected into HCT-116 cells with lipofectamine. The mRNA and protein expression of T-STAR were determined by reverse transcription polymerase chain reaction (RT-PCR) and western blot, and the activity of telomerase was measured by PCR-ELISA.
RESULTS: The expression of T-STAR mRNA and protein were significantly increased in T-STAR transfected cells (296% and 180% respectively, P<0.01), while markedly decreased in antisense T-STAR transfected ones (59% and 83.8% respectively, P<0.01). The activity of telomerase was significantly increased in T-STAR transfected cells, but decreased in antisense T-STAR transfected ones. The expression of T-STAR and the activity of telomerase manifested no significant difference between HCT-116 cells transfected with empty vector and non-transfected ones.
CONCLUSION: T-STAR gene may play an important role in the positive regulation of telomerase activtity in human colon cancer HCT-116 cells.
- Citation: Zhang L, Guo L, Peng Y, Chen B. Effects of T-STAR gene on activity of telomerase in colon cancer cell line HCT-116. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1267-1271
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1267.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1267
T-STAR蛋白(testes-signal transduction and activator of RNA, T-STAR)是一种新发现的STAR蛋白家族成员, 存在于哺乳动物细胞中, 为一种含有酪氨酸的RNA结合蛋白, 与酪氨酸激酶信号系统相关[1-3], 在癌基因对细胞转化实验中T-STAR可能与细胞的端粒酶发生作用[4].大部分进展期恶性肿瘤组织和细胞株的端粒酶活性都维持有较高水平, 而在绝大多数正常组织和细胞中的活性极低或无端粒酶活性, 因此端粒酶的激活与肿瘤的发生发展密切相关[5-8].我们将正、反义T-STAR基因转染入人结肠癌HCT-116细胞中, 检测T-STAR基因表达增加或抑制后细胞的端粒酶活性改变, 以观察T-STAR基因是否可能参与细胞端粒酶活性的调节.
真核表达质粒载体pcDNA3.1购自Invitrogen生物公司;人T-STAR基因全长cDNA由英国Leicester大学Chew教授惠赠;T-STAR全长cDNA被正向插入pcDNA3.1的EcoRI位点, 或其ApaI酶(68-335nts)切片段被反向插入pcDNA3.1载体, 分别构建得到人T-STAR全长基因的正义或反义真核表达重组质粒pcDNA-STAR和pcDNA-asSTAR.人结肠癌细胞株HCT-116由本院普通外科实验室提供.转染试剂Lipofectamine-2000 Reagent购自Invitrogen公司;RPMI1640培养基;小牛血清购自Hyclone公司;T-STAR mAb购自美国Santa Crus Biotechnology公司;兔抗羊IgG-HRP购自北京中山生物技术公司;RNA PCR试剂盒购自大连宝生物公司;端粒酶PCR ELISA试剂盒购自Roche公司.
人结肠癌细胞株HCT-116培养, 用RPMI1640培养基(含100 mL/L小牛血清、青霉素100 mg/L及链霉素100 mg/L), 在37℃, 饱和湿度, 50 mL/L CO2环境中培养.用Lipofectamine介导转染, 按试剂说明进行操作.转染前1 d将细胞以1×108/L培养液的量转入6孔板中, 当细胞融合生长至50-60%时, 分别将空载体pcDNA3.1(对照组)、反义pcDNA-asSTAR及正义pcDNA-STAR(实验组)转染细胞, 转染8 h后换新鲜培养液, 继续培养24 h后改用含500 mg/L G418的培养基进行阳性克隆筛选, 10 d时选取单克隆细胞扩大培养, 改用含200 mg/L G418的培养基维持培养2 wk.筛选到的阳性克隆分别命名为HCT-pcDNA, HCT-asSTAR和HCT-STAR.阴性对照为无质粒DNA的转染细胞HCT-116.各转染细胞培养48 h后, 收集1×105细胞, 提取总RNA, 逆转录为cDNA, 进行RT-PCR检测.T-STAR特异性引物序列为: P1-5'CAGGATGGGACATGCTTTG3', P2-5'TCTGTAGACGCCCTTTGCT3';内参照β-actin引物序列为: P1-5'GTGGGCCGCTCTAGGCACCAA3', P2-5'CTCTTTGATGTCACGCACGATTTC3'.PCR的扩增条件为:95℃ 5 min-95℃ 45 s, 48℃ 30 s, 72℃ 1 min(35个循环)-72℃ 10 min-4℃ 20 min或更长.将PCR产物进行10 g/L琼脂糖凝胶电泳, 观察T-STAR mRNA的表达.用Quantity one分析软件对电泳结果进行分析, 计算每组内目的片段与内参照条带的吸光度值之比, 作为每组T-STAR mRNA的相对定量值(mean±SD).实验重复3次.细胞总蛋白的提取, 在细胞融合生长约90%时, 用10mM浓度的PBS将细胞轻洗2次, 弃净PBS;加入1×SDS上样缓冲液200 μL使细胞充分裂解, 用细胞刮将裂解液刮于一干净的1.5 mL Ep管中;加热至100℃, 10 min;超声破碎细胞基因组DNA;常温1 000 r/min离心约10 min;将上清移至新的1.5 mL Ep管中, 以10 mL/L提取液的量加入蛋白酶抑制剂PMSF.用BioRad核酸蛋白仪测定提取液的蛋白浓度, 用细胞裂解液将各组总蛋白液稀释成相同浓度, -20℃保存备用.Western blot蛋白质印迹, 分别取各组细胞总蛋白40 μg与等体积1×上样缓冲液(100 mmol/L Tris-HCl pH6.8, 200 mmoL/L DTT, 40 g/L SDS, 20 g/L溴酚蓝, 200 mL/L甘油)混匀, 100℃, 5 min变性, 冷却后上样于100 g/L SDS-PAGE电泳胶进行电泳分离, 然后电转移至硝酸纤维素膜, 含10 g/L脱脂奶粉的PBST室温封闭2 h, 加一抗(1∶100)室温孵育过夜, 用PBST洗去一抗后加入相应二抗(1∶2 000), 室温孵育2 h, DAB显色后于凝胶成像系统上成像记录, 然后用Quntity one图像分析软件测定所采集图像目的条带的负相吸光度.实验重复3次, 蛋白表达水平定量用目的条带的负相吸光度值(mean±SD)表示.PCR ELISA法检测端粒酶活性, 按Roche公司Telo TAGGG Telomerase PCR ELISA试剂盒操作说明进行[10].
统计学处理 数据用均数±标准差(mean±SD)的形式表示, 用SPSS10.0统计学分析软件对各组数据进行t检验分析, 比较各组间的差异.
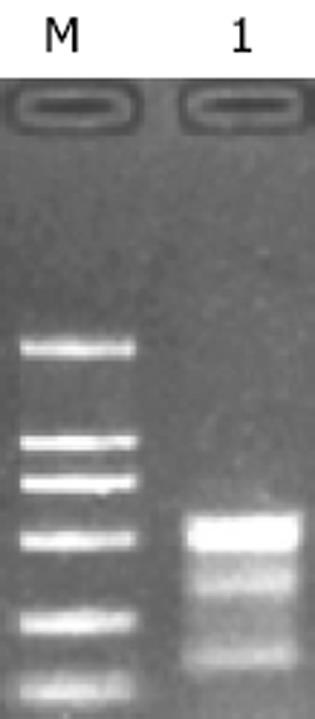
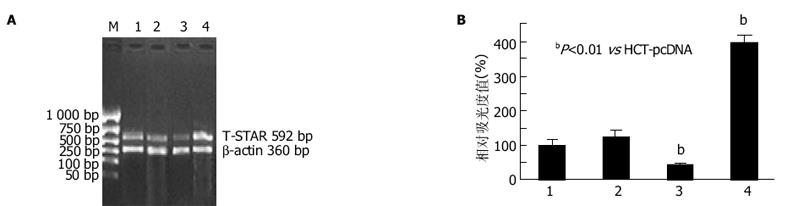
各组细胞总RNA的电泳, 在5 s, 18 s和28 s处出现三条清晰条带, 其中28 s的亮度约为18 s的2倍, 说明所抽提总RNA无明显降解、较完整, 可用于下一步实验(图1).各组细胞的T-STAR mRNA经逆转录成cDNA后, 与β-actin同时行琼脂糖凝胶电泳(图2A), 对各T-STAR cDNA目的条带进行半定量分析(图2B).独立样本t检验分析表明, 分别与HCT-pcDNA细胞组平均水平相比, T-STAR mRNA表达水平在HCT-STAR中增加了296%(P<0.01), 在HCT-asSTAR中明显下降至59%(P<0.01), 而HCT-pcDNA与HCT-116组相比无明显变化(P>0.05).
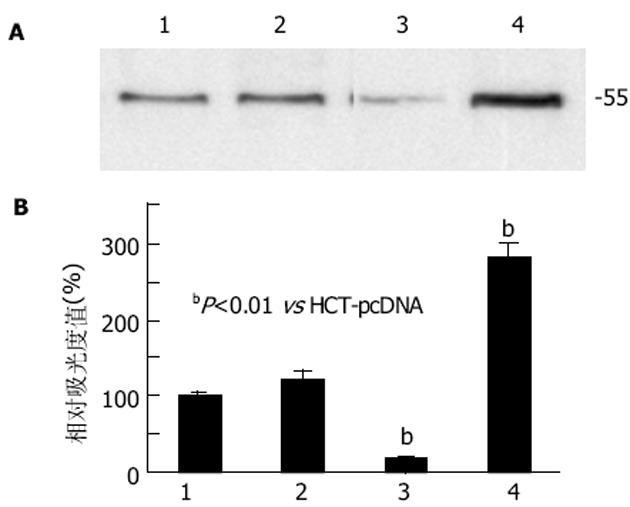
T-STAR蛋白在转染了不同载体的人结肠癌HCT-116系列细胞株中均有表达(图3A), 不同转染细胞总蛋白经电泳、电转移、免疫印迹检测后, 均在Mr 55处出现一条清晰的特异性条带:HCT和HCT-pcDNA无明显变化, HCT-asSTAR减弱, 而HCT-STAR增强.T-STAR蛋白在HCT-STAR组中表达较HCT-pcDNA细胞组增加了180.8%, 在HCT-asSTAR中表达量下降了83.80%(图3B).独立样本t检验分析表明, 对照组HCT和HCT-pcDNA间无显著性差异(P>0.05);T-STAR蛋白在HCT-STAR中表达增加有显著性意义(P<0.01);在HCT-asSTAR中表达下降有显著性差异(P<0.01).
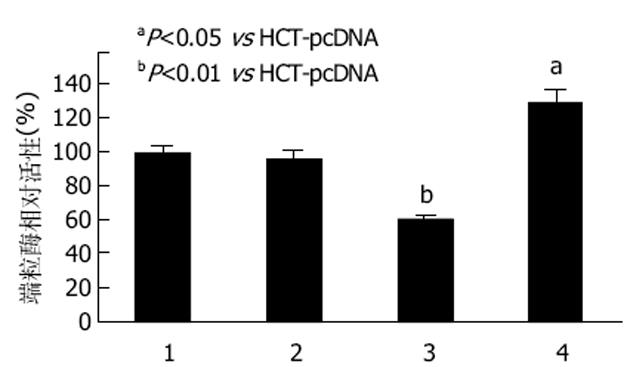
端粒酶活性在对照组HCT与HCT-pcDNA组间无明显差异;与空载体转染组HCT-pcDNA相比, 细胞内源性T-STAR表达受抑制的HCT-asSTAR组细胞中, 端粒酶活性却明显降低(P<0.01);而T-STAR表达增高的HCT-STAR组, 其细胞端粒酶活性明显升高(P<0.05)(图4).
T-STAR是STAR蛋白家族新成员, 是一种酪氨酸蛋白和RNA结合蛋白[9].位于染色体8q24.3, 长度范围在1.2-1.9 kb左右, 其蛋白Mr 55[10].他广泛表达于视网膜, 胎肝, 睾丸, 前列腺, 心脏, 肺, 胰腺, 胎盘, 脑和骨胳肌等组织中, 参与了一系列重要的生理、病理过程[11].周平et al[12]发现T-STAR还能与hTERT发生相互作用, 从而有可能通过端粒酶参与细胞的生长、增殖调控等过程, T-STAR的表达与肿瘤组织的端粒酶活性和hTERT表达呈正相关.本结果显示, T-STAR mRNA及蛋白水平在HCT-STAR中表达最高, 在HCT-asSTAR中最低, 这说明我们已经获得了T-STAR特异性上、下调细胞株;而端粒酶活性在HCT-STAR中明显增高, 在HCT-asSTAR中明显降低, 不同HCT细胞组的端粒酶活性与T-STAR表达水平呈同向变化趋势.这些结果与我们先前在不同肿瘤细胞中观察到的结果基本一致[13], 进一步证实T-STAR与hTERT以及端粒酶活性之间存在正相的相关关系, 即T-STAR的表达增加可能导致肿瘤细胞内hTERT和端粒酶活性的增加, 反之亦然.
端粒酶与细胞永生化和肿瘤的发生关系密切[14], 我们对不同组织的较大样本研究进一步证实T-STAR主要表达于腺瘤组织中[13].肿瘤细胞具有程度不等的永生化特性, 而T-STAR则参与了细胞的永生化过程[4,15-16].Kool et al[4]发现T-STAR在人成纤维细胞(VH10/SV)经SV-40T转化成永生化的过程中表达下调, 而在永生化前则无表达下调, 由此认为T-STAR的表达下调在由癌基因介导的永生化过程中普遍存在, 是细胞跨越增殖危象达到永生化状态的必备条件;这种现象也存在于不同癌基因转化的多种永生化细胞系中[17-18].更多的研究也证实T-STAR的表达下调仅在跨越了增殖危象的永生化过程中才出现, 若没有出现T-STAR的表达下调, 则不能出现危象, 细胞就不能发生永生化过程.也即, T-STAR的丢失是细胞逃逸危机, 达到永生化的先决条件之一, 且很可能是细胞增殖危象通路或永生化通路的重要成分之一[19-20].然而对于已经完成转化过程的、有较高端粒酶活性的永生化细胞中, T-STAR表达变化的实验数据却相对较少.近来研究发现, 精子细胞作为一种永生化细胞, 在精子成熟后不仅一直保持较高端粒酶活性, 而且持续高表达T-STAR蛋白[15].这与我们的研究结果相符.即在永生化细胞中, T-STAR与端粒酶活性呈正相关, 且很可能是端粒酶活性调控网络成员之一.其中的具体作用机制目前还不很清楚, 但我们从T-STAR的已有功能进行分析, 推测T-STAR可能主要从对hTERT蛋白的磷酸化和hTERT的pre-mRNA选择性剪接两方面起作用.
hTERT是端粒酶活性的核心, 其可逆性磷酸化过程可调节端粒酶活性[21-22], 而PKC激酶、Akt蛋白激酶和酪氨酸激酶均通过该过程参与了端粒酶活性调控[23-25].研究显示, 酪氨酸激酶c-Ab1能在体内、外不同条件下, 通过自身SH3结构域与hTERT结合, 并使后者磷酸化抑制端粒酶活性[25-27].T-STAR的同源物Sam68蛋白是多种RNA结合蛋白的适配器蛋白, 可通过蛋白相互作用在体内、外均对Abl SH3起促进作用[28-29], 而T-STAR作为酪氨酸激酶信号传导通路重要成分, 可通过与其同族物Sam68蛋白结合成异源多聚体[4,9,16]而抑制Sam68蛋白与靶蛋白的作用.由此我们推测T-STAR很可能是通过可逆性磷酸化抑制Sam68蛋白, 使后者不能与Abl SH3结合, 从而导致Abl SH3功能受抑而增加端粒酶活性.T-STAR对端粒酶活性产生影响的另一重要机制可能在于参与了hTERT基因的选择性剪接.由于hTERT的剪接方式不同, 体内存在不同的hTERT剪接产物[30-32], 但其中只有hTERT的全长转录产物与端粒酶的活性相关[13].因此hTERT的选择性剪接可能是hTERT表达和端粒酶活性的调控方式之一.T-STAR的3'-UTR为靶mRNA结合位点[33], 作为STAR家族重要一员, T-STAR既可直接参与靶pre-mRNA的加工和特异性剪接位点的选择性调节[34], 又可与其他与选择性剪接有关的蛋白(如hnRNP G-T, 一种睾丸特异相关蛋白, 为pre-mRNA剪接激活物, 与适配器蛋白Tra2β的依赖性剪接有关)发生相互作用[34-35].因此我们推测T-STAR可能通过对hTERT的per-mRNA进行剪接方式的调控, 特异性增加了hTERT的全长剪接产物而上调了端粒酶活性.其中的具体机制还不十分清楚, 有待于进一步深入研究.
编辑: 潘伯荣 审读:张海宁
| 1. | Haegebarth A, Heap D, Bie W, Derry JJ, Richard S, Tyner AL. The nuclear tyrosine kinase BRK/Sik phosphorylates and inhibits the RNA-binding activities of the Sam68-like mammalian proteins SLM-1 and SLM-2. J Biol Chem. 2004;279:54398-54404. [PubMed] [DOI] |
| 2. | Elliott DJ. The role of potential splicing factors including RBMY, RBMX, hnRNPG-T and STAR proteins in sper matogenesis. Int J Androl. 2004;27:328-334. [PubMed] [DOI] |
| 3. | Wang L, Xu J, Zeng L, Ye X, Wu Q, Dai J, Ji C, Gu S, Zhao C, Xie Y. Cloning and characterization of a novel human STAR domain containing cDNA KHDRBS2. Mol Biol Rep. 2002;29:369-375. [PubMed] [DOI] |
| 4. | Kool J, van Zaane W, van der Eb AJ, Terleth C. Down-regulation of T-STAR, a growth inhibitory protein, after SV40-mediated immortalization. Cell Growth Differ. 2001;12:535-541. [PubMed] |
| 5. | Gudjonsson T, Villadsen R, Ronnov-Jessen L, Petersen OW. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 2004;61:2523-2534. [PubMed] [DOI] |
| 7. | Bocchetta M, Carbone M. Epidemiology and molecular pathology at crossroads to establish causation: molecular mechanisms of malignant transformation. Oncogene. 2004;23:6484-6491. [DOI] |
| 8. | Chang JY. Telomerase: a potential molecular marker and therapeutic target for cancer. J Surg Oncol. 2004;87:1-3. [PubMed] [DOI] |
| 9. | Venables JP, Vernet C, Chew SL, Elliott DJ, Cowmeadow RB, Wu J, Cooke HJ, Artzt K, Eperon IC. T-STAR/ETOILE: a novel relative of SAM68 that interacts with an RNA-binding protein implicated in spermatogenesis. Hum Mol Genet. 1999;8:959-969. [PubMed] [DOI] |
| 10. | Chen K, Song Y, Zhang YY. STAR family proteins and QKI:structure and function. Shengli Kexue Jinzhan. 2003;34:347-349. [PubMed] |
| 11. | Di Fruscio M, Chen T, Richard S. Characterization of Sam68-like mammalian proteins SLM-1 and SLM-2: SLM-1 is a Src substrate during mitosis. Proc Natl Acad Sci. 1999;96:27102715. [PubMed] [DOI] |
| 12. | 周 平, 陈 兵. 端粒相关蛋白编码基因的克隆及功能分析. 第三军医大学博士学位论文 P99. |
| 13. | 郭 莲, 彭 勇, 陈 兵. T-STAR在不同肿瘤组织中的表达及临床意义(待发表). |
| 14. | Kundra V, Krane JF, Nikolaidis P, Green DS, Zou KH, Tuncali K, Vansonnenberg E, Silverman SG. Telomerase activity predicts malignancy in percutaneous image-guided needle biopsy specimens of the abdomen and pelvis. Radiology. 2005;234:941-947. [PubMed] [DOI] |
| 15. | Elliott DJ. The role of potential splicing factors including RBMY, RBMX, hnRNPG-T and STAR proteins in spermatogenesis. Int J Androl. 2004;27:328-334. [PubMed] [DOI] |
| 16. | Venables JP, Dalgliesh C, Paronetto MP, Skitt L, Thornton JK, Saunders PT, Sette C, Jones KT, Elliott DJ. SIAH1 targets the alternative splicing factor T-STAR for degradation by the proteasome. Hum Mol Genet. 2004;13:1525-1534. [PubMed] [DOI] |
| 17. | Gudjonsson T, Villadsen R, Ronnov-Jessen L, Petersen OW. Immortalization protocols used in cell culture models of human breast morphogenesis. Cell Mol Life Sci. 2004;61:2523-2534. [PubMed] [DOI] |
| 18. | Yaswen P, Stampfer MR. Molecular changes accompanying senescence and immortalization of cultured human mammary epithelial cells. Int J Biochem Cell Biol. 2002;34:1382-1394. [PubMed] [DOI] |
| 19. | Reddel RR. The role of senescence and immortalization in carcinogenesis. Carcinogenesis. 2000;21:477-484. [PubMed] [DOI] |
| 20. | Reddel RR. Genes involved in the control of cellular proliferative potential. Ann N Y Acad Sci. 1998;854:8-19. [PubMed] [DOI] |
| 21. | Oguchi K, Tamura K, Takahashi H. Characterization of Oryza sativa telomerase reverse transcriptase and possible role of its phosphorylation in the control of telomerase activity. Gene. 2004;342:57-66. [PubMed] [DOI] |
| 22. | Hao LY, Strong MA, Greider CW. Phosphorylation of H2AX at short telomeres in T cells and fibroblasts. J Biol Chem. 2004;279:45148-154. [PubMed] [DOI] |
| 23. | Kimura A, Ohmichi M, Kawagoe J, Kyo S, Mabuchi S, Takahashi T, Ohshima C, Arimoto-Ishida E, Nishio Y, Inoue M. Induction of hTERT expression and phosphorylation by estrogen via Akt cascade in human ovarian cancer cell lines. Oncogene. 2004;23:4505-4515. [PubMed] [DOI] |
| 24. | Endoh T, Tsuji N, Asanuma K, Yagihashi A, Watanabe N. Survivin enhances telomerase activity via up-regulation of specificity protein 1- and c-Myc-mediated human telomerase reverse transcriptase gene transcription. Exp Cell Res. 2005;305:300-311. [PubMed] [DOI] |
| 25. | Mori S, Cao Y, Yamadab T, Sogawa K, Kondo K, Hino N, Miyazaki T, Kawaguchi Y, Oka S, Kawasaki K. Enhanced expression of PP1gamma1, a catalytic subunit isoform of protein phosphatase type1 and expression of telomerase activity in Ewing's sarcoma cells. Res Commun Mol Pathol Pharmacol. 2003;113:269-274. [PubMed] |
| 26. | Bakalova R, Ohba H, Zhelev Z, Kubo T, Fujii M, Ishikawa M, Shinohara Y, Baba Y. Antisense inhibition of Bcr-Abl/c-Abl synthesis promotes telomerase activity and upregulates tankyrase in human leukemia cells. FEBS Lett. 2004;564:73-84. [PubMed] [DOI] |
| 27. | Haendeler J, Hoffmann J, Brandes RP, Zeiher AM, Dimmeler S. Hydrogen peroxide triggers nuclear export of telomerase reverse transcriptase via Src kinase family-dependent phosphorylation of tyrosine 707. Mol Cell Biol. 2003;23:4598-610. [PubMed] [DOI] |
| 28. | Najib S, Martin-Romero C, Gonzalez-Yanes C, Sanchez-Margalet V. Role of Sam68 as an adaptor protein in signal transduction. Cell Mol Life Sci. 2005;62:36-43. [PubMed] [DOI] |
| 29. | Paronetto MP, Venables JP, Elliott DJ, Geremia R, Rossi P, Sette C. Tr-kit promotes the formation of a multimolecular complex composed by Fyn, PLCgamma1 and Sam68. Oncogene. 2003;22:8707-8715. [PubMed] |
| 30. | Zaffaroni N, Villa R, Pastorino U, Cirincione R, Incarbone M, Alloisio M, Curto M, Pilotti S, Daidone MG. Lack of telomerase activity in lung carcinoids is dependent on human telomerase reverse transcriptase transcription and alternative splicing and is associated with long telomeres. Clin Cancer Res. 2005;11:2832-2839. [PubMed] [DOI] |
| 31. | Barclay JY, Morris A, Nwokolo CU. Telomerase, hTERT and splice variants in Barrett's oesophagus and oesophageal adenocarcinoma. Eur J Gastroenterol Hepatol. 2005;17:221-227. [PubMed] [DOI] |
| 32. | Liu WJ, Zhang YW, Zhang ZX, Ding J. Alternative splicing of human telomerase reverse transcriptase may not be involved in telomerase regulation during all-trans-retinoic acid-induced HL-60 cell differentiation. J Pharmacol Sci. 2004;96:106-114. [PubMed] [DOI] |
| 33. | Itoh M, Haga I, Li QH, Fujisawa J. Identification of cellular mRNA targets for RNA-binding protein Sam68. Nucleic Acids Res. 2002;30:5452-5464. [PubMed] [DOI] |
| 34. | Stoss O, Olbrich M, Hartmann AM, Konig H, Memmott J, Andreadis A, Stamm S. The STAR/GSG family protein rSLM-2 regulates the selection of alternative splice sites. J Biol Chem. 2001;276:8665-8673. [PubMed] [DOI] |
| 35. | Venables JP, Elliott DJ, Makarova OV, Makarov EM, Cooke HJ, Eperon IC. RBMY, a probable human spermatogenesis factor, and other hnRNP G proteins interact with Tra2beta and affect splicing. Hum Mol Genet. 2000;22:685-694. [PubMed] [DOI] |