修回日期: 2005-02-15
接受日期: 2005-02-26
在线出版日期: 2005-05-15
目的: 研究过氧化氢(H2O2)对人脾细胞影响的时效和量效关系, 以获得稳定的人脾细胞凋亡模型.
方法: 采用研磨法获得悬浮的人脾细胞, 将细胞分组后给予相应的生理盐水或不同浓度的H2O2处理.运用四唑盐(MTT)比色法检测线粒体功能, 将细胞与Annexin Ⅴ-FITC/PI混合孵育后使用流式细胞仪检测早期凋亡细胞.
结果: 人脾细胞线粒体功能及凋亡率与H2O2呈剂量-效应关系, 随着H2O2浓度的增高, 线粒体功能逐渐降低, 而凋亡率则随H2O2浓度的增高而增加.同时它们与H2O2处理时间也存在时间-效应的关系.各处理组间细胞总凋亡率分别为55.01±9.11% (100 μmol/L), 44.07±9.00%(50 μmol/L), 30.20±6.75%(25 μmol/L)和9.97±1.68%(对照组)存在显著差异(P<0.05), 以H2O2 100 μmol/L处理的细胞组于6 h达到凋亡高峰(69.28±3.01)%.
结论: H2O2可以诱导体外培养的人脾细胞凋亡, 建立人脾细胞凋亡模型.
引文著录: 韩钧凌, 蔡德鸿, 张桦, 孙佳, 陈宏, 刘宏. 过氧化氢诱导体外培养的人脾细胞凋亡. 世界华人消化杂志 2005; 13(10): 1194-1197
Revised: February 15, 2005
Accepted: February 26, 2005
Published online: May 15, 2005
AIM: To investigate the dose- and time-effect of hydrogen peroxide (H2O2) on human spleen cells, and to establish a stable apoptotic model of human spleen cells.
METHODS: The human spleen cells, obtained by the method of grinding, were divided into four groups and treated with saline solution or various concentrations of H2O2 respectively. The function of mitochondrions was assessed by the 3-(4,5- dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide (MTT) assay and the early apoptotic cells were detected by flow cytometry with a combination of Annexin V-FITC/PI.
RESULTS: H2O2 affected the mitochondrial function (negatively) and apoptosis (positively) of the human spleen cells in a dose- and time-dependent manner The apoptotic rates were significantly different between different groups (Total: 55.01±9.11%, 44.07±9.00%, 30.20±6.75% and 9.97±1.68% for 100, 50, 25 μmol/L and control group respectively, P<0.05). The apoptotic rate of cells reached the highest value (69.28±3.01)% at the concentration of 100 mmol/L 6 hours after treatment.
CONCLUSION: H2O2 can induce the apoptosis of human spleen cells in vitro, which can be used to establish apoptotic model.
- Citation: Han JL, Cai DH, Zhang H, Sun J, Chen H, Liu H. Hydrogen peroxide induces apoptosis of human spleen cells in vitro. Shijie Huaren Xiaohua Zazhi 2005; 13(10): 1194-1197
- URL: https://www.wjgnet.com/1009-3079/full/v13/i10/1194.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i10.1194
细胞凋亡是细胞循自身程序结束其生命的主动死亡的过程.凋亡细胞具有免疫调节特性[1], 因而近年来凋亡细胞也成为移植耐受研究者们关注的热点.诱导细胞凋亡的方法有多种, 包括抗肿瘤药物、射线、热损伤、激素等方法.近年来的研究表明, 高度的氧化应激导致细胞坏死, 而适度的氧化应激则诱导细胞凋亡[2-3].我们应用过氧化氢诱导体外培养的人脾细胞凋亡, 旨在为临床移植耐受研究建立一种稳定的人脾细胞凋亡模型.
人脾脏3个, 重60-72 g, 由中山三院肝移植中心提供;AnnexinV(磷脂酞丝氨酸结合蛋白V)/PI(碘化丙锭)试剂盒(Bender Medsystems公司)、小牛血清, RPMI 1640(Hyclone)、Hepes(Promega)、尼克酰胺(Alexis)均购自购自北京天象人生物公司;台盼兰(Sigma)购自展晨生物公司;MTT为华美生物工程公司进口分装试剂;300 mL/L过氧化氢(分析纯)购自广州市新成精细化工厂;红细胞裂解液Tris-NH4Cl由本实验室自配;SW-CJ-10型超净工作台(苏州净化设备有限公司);BD FACScalibur型流式细胞仪(BD Biosciences);Nikon eclipse TS100型倒置显微镜, (Nikon);Bio-Rad Model 680型酶标仪(Bio-Rad);UV-754C型紫外分光光度仪(上海电子技术光学研究所);3111型水套式CO2细胞培养箱(Thermo Forma公司).
超净工作台中, 将脾脏置于无菌托盘中, 以血管钳撕开外层筋膜, 剪取约5 g左右脾脏组织, 置于盛有4℃ Hanks的10 mL烧杯中, 眼科剪剪碎, 玻璃匀浆器研磨后, 200目不锈钢筛网过滤.收集滤液, 4℃, 1 000 r/min离心5 min, 弃上清, 观察沉淀物压积, 以10∶1体积比加入红细胞裂解液Tris-NH4Cl, 混匀, 静置5 min.另取一50 mL离心管, 管底加入小牛血清5 mL, 将裂解红细胞后的细胞悬液移入此管, 4℃, 1 000 r/min离心5 min, 弃上清, 以RPMI1640完全培养基(含Hepes 25 mmol/L, 尼克酰胺1.221 g/L, 200 mL/L小牛血清及终浓度均为100 kU/L的青、链霉素双抗液)重悬细胞, 37℃, 50 mL/L CO2恒温培养箱培养.取细胞悬液100 μL, 加5 g/L台盼兰溶液100 μL混匀, 取一滴至血细胞计数板, 3 min内计数100个细胞, 蓝染者为死亡细胞, 计算细胞活率:活细胞率 = 活细胞数/(活细胞数+死细胞数)×100%, 人脾组织处理后可获得细胞数为(3.83±0.81)×107/g, 台盼兰染色细胞活率为82.33%±2.52%.将H2O2用1 cm比色杯在240 nm比色, 得吸光度A值, 因为H2O2消光系数为43.6, 故H2O2浓度(mol/L) = A/43.6[4].于细胞培养板中分4组, A组为对照组;B, C, D组为试验组.各组具体处理如下:A组:加生理盐水;B组:加入H2O2 25 μmol/L;C组:加入H2O2 50 μmol/L;D组:加入H2O2 100 μmol/L, 各组细胞处理后置37℃, 50 mL/L CO2恒温培养箱培养.上述各细胞组处理后3, 6, 9 h分别进行MTT比色试验, 即每孔细胞悬液200 μL中加入MTT液(5 g/L)20 μL孵育4 h, 1 000 r/min离心5 min, 小心吸除培养液, 加二甲基亚砜150 μL振荡10 min, 酶标仪于570 nm波长检测脾细胞A值.上述各细胞组处理后3, 6, 9 h分别进行流式细胞仪检测细胞凋亡, 即每孔取细胞悬液300 μL, 4℃预冷PBS液冲洗细胞2次, Bending Buffer液250 μL重悬细胞, 取细胞悬液100 μL, 以200目不锈钢筛网滤过加于5 mL流式管中, 加入AnnexinⅤ-FITC 5 μL和20 mg/L的碘化丙锭(PI)液10 μL, 混匀, 室温下避光孵育15 min, 再加入PBS液400 μL, 流式细胞仪检测分析.
统计学处理 采用SPSS10.0进行统计分析, 数据以mean±SD表示, 采用方差分析(ANOVA)方法, 组间比较用LSD-t检验的方法, P<0.05具有统计学意义.
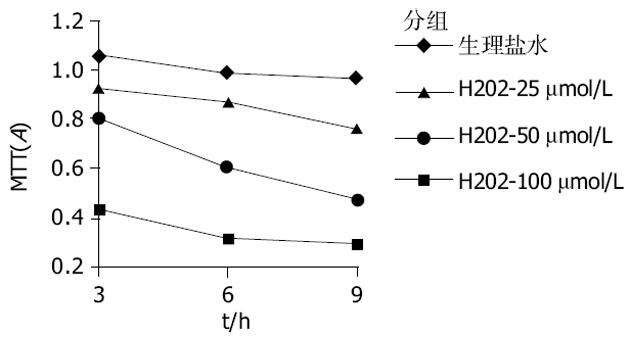
MTT测定是基于线粒体内含有琥珀酸脱氢酶, 后者可将MTT从黄色转化为蓝色, 他广泛用作细胞呼吸和活力的指标, 反映线粒体的整体功能.用H2O2处理后从25 μmol/L到100 μmol/L其MTTA值呈下降趋势并具有明显的剂量及时间依赖关系;用低浓度25 μmol/L H2O2时, 线粒体功能较正常稍降低, 但与对照组相比差别亦具有统计学意义;用中浓度及较高浓度(50 μmol/L, 100 μmol/L)时可见线粒体功能在6 h处显著下降(100 μmol/L组在3 h即明显下降)(P<0.05, 图1).
以生理盐水处理的正常细胞组A组也存在少量的细胞凋亡(9.97±1.68)%.用过氧化氢处理的人脾细胞凋亡率呈明显浓度与时间依赖性(表1), 各处理组间细胞凋亡率存在显著差异(P<0.05), 6 h及9 h各组细胞总凋亡率均与3 h存在显著差异(P<0.05), 而6 h与9 h之间无显著差异(P>0.05).以H2O2 50 μmol/L处理的细胞组于3 h后开始有明显细胞凋亡发生, 而后随时间推移凋亡率增加.以H2O2 100 μmol/L处理的细胞组于3 h后即有显著凋亡发生, 至6 h达到凋亡高峰, 但于9 h凋亡率又有所下降, 此时细胞坏死率增加.
氧化应激是指能导致化学或代谢来源的活性氧产生的一种细胞内或外的状态, 过量的活性氧(ROS)如O2-, H2O2, OH-, 脂质过氧化物等可引起不同程度的细胞毒性, 并导致瞬时或不可逆的损伤.引起凋亡可能与活性氧中间产物有关[5].H2O2也是体内一种非常重要的细胞信号分子[6].如H2O2能下调p53, c-Jun和Fos等转录因子的功能, 激活NF-kappa B和JNK信号转导通路[7].H2O2在体内具有重要的生理功能.体内吞噬细胞和中性粒细胞吞噬和杀灭微生物时氧爆发产生大量活性氧, 此时附近T细胞周围H2O2的浓度可达到10-100 μmol/L[8].然而直接用H2O2处理细胞可以引起细胞凋亡或坏死, 低浓度引起凋亡, 高浓度导致细胞坏死, 凋亡发生与caspase活性有关[9-10].有研究表明可以引起溶酶体膜不稳定, 溶酶体释放一些水解酶激活胞质中的caspase前体或损伤线粒体膜使之释放细胞色素C, 进而诱发凋亡[11-12].我们的研究结果表明活性氧(H2O2)可导致人脾细胞线粒体功能损伤, 其损伤的程度具有过氧化氢浓度及其作用时间依赖性.线粒体在细胞凋亡过程中非常重要:细胞自发的受Bcl-2抑制的核固缩和DNA裂解依赖线粒体的存在;caspase的活化依赖细胞色素C自线粒体释放.研究显示各种因素诱导的细胞凋亡均出现线粒体功能紊乱, 尤其是线粒体跨膜电位(Δψm)的破坏.业已清楚, 造成Δψm下降的主要原因是线粒体膜通透性转运孔(MPT)的开放.MPT位于线粒体内、外膜之间, 由一组蛋白复合体构成.许多因素可影响MPT的开关.MPT的开放及Δψm的破坏与细胞的氧化还原状态, 如巯基氧化、细胞GSH缺少和ROS的堆积密切相关.Macho et al[13]在研究胸腺细胞凋亡机制中发现, 早期凋亡细胞胞内GSH下降和ROS含量轻度升高.后者进一步引起NADH和NADPH下降, 产生大量超氧阴离子自由基.因此, 在凋亡过程中, ROS既是促发和加速MPT开放重要效应分子, 又是MPT开放的产物.这种正反馈机制使MPT开放具有自我放大效应和"全"或"无"的特点, 使线粒体Δψm的下降进入不可逆过程, 引起线粒体的膨胀以及外膜的破裂, 细胞色素c及其他的一些因子会通过线粒体通透改变孔道本身或破裂的外膜直接泄漏出来, 细胞发生凋亡.
细胞凋亡的早期改变之一是细胞膜磷脂酰丝氨酸(PS)从细胞膜内转向细胞膜外.annexin Ⅴ是一种钙依赖磷脂结合蛋白, 具有易于与磷脂类如PS结合的特性, 对转向到细胞膜外的PS有高度的亲和性[14].由于PS外转到细胞膜外是细胞凋亡过程中的早期改变, 所以用FITC标记annexin Ⅴ染色能够较检测细胞核改变如DNA碎片更早地辩别凋亡细胞.但是由于在坏死细胞膜上也存在外转的PS, 也可被annexin Ⅴ染色.单独应用annexin Ⅴ染色仍然不能将凋亡与坏死分辩开来.所以用FITC标记annexin Ⅴ, 结合使用PI对凋亡细胞进行双染色, 即可区别凋亡细胞(Annexin Ⅴ-FITC/PI-)与坏死细胞(Annexin Ⅴ-FITC/PI+).本实验结果显示, 未经H2O2处理的实验细胞亦存在凋亡(凋亡细胞占4.18%), 但H2O2处理后可引起人脾细胞凋亡明显增加, 呈剂量及时间依赖性, 以H2O2 100 μmol/L处理后6 h达到凋亡高峰, 但至9 h时凋亡率又下降, 研究发现, 此时细胞坏死率增加(46.62±10.04)%, 显示较高浓度H2O2对细胞的毒性作用.
凋亡细胞具有诱导免疫耐受的应用前景.凋亡细胞可以抑制DC的成熟[15], 而且这种抑制作用独立于DC吞噬凋亡细胞后所分泌的抑制性淋巴因子如TGF-β1, IL-10, 由于不成熟DC细胞的表面分子表达低下, 如MHC I, MHC II, CD86及其他黏附分子, 因而不成熟DC在向T细胞提呈抗原时不能提供充分的共刺激信号, 从而诱导免疫耐受.新近的一些移植研究表明, 静脉输注凋亡细胞可促使骨髓移植成功[16];使肝脏移植物获得长期存活[17].这些实验现象给以凋亡细胞诱导移植免疫耐受提供了有力的实证, 但其机制至今仍不明了.我们探索出过氧化氢诱导人脾细胞凋亡所需的适宜的浓度和时间, 建立了人脾细胞凋亡模型, 同时表明过氧化氢诱导人脾细胞凋亡与细胞线粒体功能损伤有个.这些研究为进一步的临床移植耐受研究打下坚实的基础.
特别感谢中山医科大学第三附属医院中心实验室的韩晓燕老师和张富程老师对本实验无私的、热情的帮助.
编辑: 潘伯荣 审读:张海宁
| 1. | Voll RE, Herrmann M, Roth EA, Stach C, Kalden JR, Girkontaite I. Immunosuppressive effects of apoptotic cells. Nature. 1997;390:350-351. [PubMed] [DOI] |
| 2. | Lennon SV, Martin SJ, Cotter TG. Dose-dependent induction of apoptosis in human tumour cell lines by widely diverging stimuli. Cell Prolif. 1991;24:203-214. [PubMed] [DOI] |
| 3. | Dypbukt JM, Ankarcrona M, Burkitt M, Sjoholm A, Strom K, Orrenius S, Nicotera P. Different prooxidant levels stimulate growth, trigger apoptosis, or produce necrosis of insulin-secreting RINm5F cells. The role of intracellular polyamines. J Biol Chem. 1994;269:30553-30560. [PubMed] |
| 4. | 庞 占军, 周 玫, 陈 瑗著. 自由基医学研究方法. 北京: 人民卫生出版社 2000; 22. |
| 5. | 赵 卫红, 寿 好长, 闫 福岭. 细胞凋亡. 郑州: 河南医科大学出版社 1997; 40-45. |
| 6. | Reth M. Hydrogen peroxide as second messenger in lymphocyte activation. Nat Immunol. 2002;3:1129-1134. [PubMed] [DOI] |
| 7. | Chen YR, Shrivastava A, Tan TH. Down-regulation of the c-Jun N-terminal kinase(JNK)phosphatase M3/6 and activation of JNK by hydrogen peroxide and pyrrolidine dithiocarbamate. Oncogene. 2001;20:367-374. [PubMed] [DOI] |
| 8. | Nathan CF, Root RK. Hydrogen peroxide release from mouse peritoneal macrophages: dependence on sequential activation and triggering. J Exp Med. 1977;146:1648-1662. [PubMed] [DOI] |
| 9. | Hampton MB, Orrenius S. Dual regulation of caspase activity by hydrogen peroxide: implications for apoptosis. FEBS Lett. 1997;414:552-556. [PubMed] [DOI] |
| 10. | Kim DK, Cho ES, Um HD. Caspase-dependent and -independent events in apoptosis induced by hydrogen peroxide. Exp Cell Res. 2000;257:82-88. [PubMed] [DOI] |
| 11. | Antunes F, Cadenas E, Brunk UT. Apoptosis induced by exposure to a low steady-state concentration of H2O2 is a consequence of lysosomal rupture. Biochem J. 2001;356:549-555. [PubMed] [DOI] |
| 12. | Ogawa Y, Kobayashi T, Nishioka A, Kariya S, Ohnishi T, Hamasato S, Seguchi H, Yoshida S. Reactive oxygen species-producing site in hydrogen peroxide-induced apoptosis of human peripheral T cells: involvement of lysosomal membrane destabilization. Int J Mol Med. 2004;13:383-388. [PubMed] [DOI] |
| 13. | Macho A, Hirsch T, Marzo I, Marchetti P, Dallaporta B, Susin SA, Zamzami N, Kroemer G. Glutathione depletion is an early and calcium elevation is a late event of thymocyte apoptosis. J Immunol. 1997;158:4612-4619. [PubMed] |
| 14. | Herault O, Colombat P, Domenech J, Degenne M, Bremond JL, Sensebe L, Bernard MC, Binet C. A rapid single-laser flow cytometric method for discrimination of early apoptotic cells in a heterogenous cell population. Br J Haematol. 1999;104:530-537. [PubMed] [DOI] |
| 15. | Stuart LM, Lucas M, Simpson C, Lamb J, Savill J, Lacy-Hulbert A. Inhibitory effects of apoptotic cell ingestion upon endotoxin-driven myeloid dendritic cell maturation. J Immunol. 2002;168:1627-1635. [PubMed] [DOI] |