修回日期: 2005-01-05
接受日期: 2005-01-14
在线出版日期: 2005-05-15
目的: 探讨硒蛋氨酸对耐顺铂食管癌细胞P-170抑制作用.
方法: 采用顺铂高浓度间歇诱导食管癌细胞系EC9706, 建立耐药食管癌细胞模型;用MTT法检测硒蛋氨酸对该耐药食管癌细胞模型对顺铂敏感性的影响;用免疫组化检测该耐药食管癌细胞模型P-170表达, 并进行半定量分析.
结果: 硒蛋氨酸可增强该耐药食管癌细胞对顺铂敏感性, 且呈现一定的浓度、时间依赖性, 与单用同样浓度的顺铂和硒蛋氨酸组比较有显著差异(P<0.01).当顺铂加硒蛋氨酸浓度为40 mg/L+20 mmol/L处理耐顺铂食管癌细胞72 h后, 对癌细胞增殖的抑制作用最明显.该耐药食管癌细胞P-170强阳性表达, 经硒蛋氨酸处理后仅弱阳性或无表达, 统计学分析显示有显著差异(56.2% vs 25.7%, P<0.01).
结论: 硒蛋氨酸可抑制多药耐药(MDR)基因编码的糖蛋白(P-170)的表达, 在一定程度上逆转了肿瘤细胞耐药性.
引文著录: 吴清明, 陈滋华, 童强, 李胜保, 王小虎. 硒蛋氨酸对耐顺铂食管癌细胞P-170的影响. 世界华人消化杂志 2005; 13(10): 1179-1182
Revised: January 5, 2005
Accepted: January 14, 2005
Published online: May 15, 2005
AIM: To investigate the inhibitory effect of Seleno Methionine (SM) on the P-glycoprotein in cisplatin(DDP)-resistant esophageal carcinoma cells.
METHODS: High concentration of DDP was used intermittantly to induce drug-resistant esophageal carcinoma cells EC9706. The effect of SM on the sensibility of cells to DDP was detected by MTT. Immunohistochemical technique was used to detect the expression of P-glycoprotein and then semi-quantative analysis was performed.
RESULTS: SM could improve the sensibility of EC9706 cells to DDP in a time- and concentration- dependent manner, which had significant difference with DDP or SM alone at the same concentration (P<0.01). The most marked effect appeared 72 h after DDP (40 mg/L) and SM (20 mmol/L) were administered. The expression of P-glycoprotein in the drug-resistant cells was highly positive, but it was lowly positive or negative after SM was used. There was significant difference between them (56.2% vs 25.7%, P<0.01).
CONCLUSION: SM can inhibit the expression of P-glycoprotein encoded by multidrug-resistant gene in esophageal carcinoma, and can overcome drug-resistance of tumor cells to some extent.
- Citation: Wu QM, Chen ZH, Tong Q, Li SB, Wang XH. Effect of Seleno Methionine on P-glycoprotein in cisplatin-resistant esophageal carcinoma cells. Shijie Huaren Xiaohua Zazhi 2005; 13(10): 1179-1182
- URL: https://www.wjgnet.com/1009-3079/full/v13/i10/1179.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i10.1179
化疗仍然是目前治疗肿瘤最主要的方法之一.长期以来肿瘤细胞多药耐药(multidrug resistance, MDR)一直困扰着临床医生, 他是影响化疗疗效的重要因素之一.我们探讨硒蛋氨酸对耐顺铂食管癌细胞多药耐药基因编码的糖蛋白(P-glycoprotein, P-gp, P-170)抑制作用, 为提高食管癌化疗疗效提供新的方法.
RPMI1640培养基, 小牛血清, 胰蛋白酶、蛋氨酸为Gibco公司产品;MTT, DMSO, 硒蛋氨酸(selenomethionine)为Sigma公司产品.恒温CO2培养箱(SanyD日本), 倒置显微镜(OlympusIX-70)、酶联免疫检测仪(Σ960美国), 流式细胞仪(Epics XL, Beckman coulter公司).人食管癌细胞系EC9706由中国医学科学院王明荣教授惠赠.
食管癌细胞EC9706常规培养于含100 mL/L小牛血清、100 kU/L青霉素及100 kU/L链霉素的RPMI-1640培养基中, 置于37℃ 50 mL/L CO2培养箱内培养[1-2].取对数生长期的食管癌细胞EC9706按每孔1×107/L接种于96孔培养板中, 24 h后换液, 加入不同浓度顺铂10、20、30、40、50 mg/L.设不接种细胞的空白对照组和只加入等体积溶剂DMSO的阴性对照组.每组浓度每个时间点设8个复孔, 继续培养, 于24, 48, 72, 96 h每孔加入MTT溶液(5 g/L)10 μL, 37℃孵育4 h后弃去上清液, 每孔加入DMSO100 μL, 轻轻振荡10 min, 使结晶物充分溶解, 在490 nm波长酶联免疫检测仪上测定各孔吸光度值(A), 求其平均值, 对照组细胞存活率记为100%, 实验组按下列公式计算细胞存活率=实验组A/对照组A×100%.根据MTT法测出的最佳顺铂药物浓度处理食管癌细胞EC9706.将细胞持续培养于含该浓度顺铂的培养液中72 h, 更换无顺铂培养液, 筛选克隆出耐药成活细胞, 继续培养, 待细胞增值恢复至原有水平时, 加入含该浓度顺铂的培养液继续培养.到细胞能完全生长在含该浓度顺铂的培养液中即获得耐顺铂食管癌细胞系EC9706的细胞株.
1.2.1 硒蛋氨酸+顺铂对耐顺铂食管癌细胞系EC9706生长的影响: 取对数生长期的耐顺铂食管癌细胞EC9706按每孔1×107/L接种于96孔培养板中, 24 h后换液, 加入顺铂10 mg/L+硒蛋氨酸5 mmol/L、顺铂10 mg/L+硒蛋氨酸10 mmol/L、顺铂30 mg/L+硒蛋氨酸15 mmol/L、顺铂40 mg/L+硒蛋氨酸20 mmol/L、50 mg/L+硒蛋氨酸25 mmol/L和单用同样浓度的顺铂或硒蛋氨酸.设不接种细胞的空白对照组和只加入等体积溶剂DMSO的阴性对照组.每组浓度每个时间点设8个复孔, 采用MTT法测出顺铂+硒蛋氨酸对耐顺铂食管癌细胞株EC9706最佳的药物浓度.
1.2.2 硒蛋氨酸+顺铂对耐顺铂食管癌细胞系EC9706耐药基因编码的P-170蛋白表达的影响: 根据MTT法测出的最佳顺铂+硒蛋氨酸对耐顺铂食管癌细胞株EC9706药物浓度处理该细胞.将细胞悬液接种于铺有盖玻片的6孔培养板中, 按每孔1×107/L接种.孵育24 h后, 加入顺铂+硒蛋氨酸继续培养, 按免疫细胞化学法常规检测耐顺铂食管癌细胞系EC9706 P-170表达, 以食管平滑肌的棕黄色着色为阳性对照, PBS代替一抗作阴性对照.在40×光镜下, 随机选取6个视野进行阳性细胞计数并计算阳性细胞率, 利用统计学软件(Statgraphics Version 3.0)进行二组间统计学分析.
统计学处理 计数资料以mean±SD表示, 采用SPSS10.0统计分析软件进行t检验.免疫组化阳性细胞计数利用统计学软件(Statgraphics Version 3.0)进行χ2检验.
各组浓度顺铂对食管癌细胞EC9706的增殖均有抑制作用, 与空白对照组比较有非常显著差异(P<0.01), 且呈现一定的浓度、时间依赖性(表1).当顺铂浓度为40 mg/L处理食管癌细胞72 h, 与进一步增加浓度和时间相比较没有显著差异(P>0.05), 故选择该浓度为诱导耐药细胞模型的最佳浓度.以40 mg/L顺铂作用EC9706, 筛选克隆出耐药成活细胞, 到细胞能完全生长在含该浓度顺铂的培养液中即获得耐顺铂食管癌细胞系EC9706的细胞株.传代约20代, 历时3 mo.
| 组项 | 剂量(mg/L) | 24 h | 48 h | 72 h | 96 h |
| 空白对照组 | 0.743±0.120 | 0.812±0.102 | 0.892±0.134 | 0.962±0.125 | |
| 顺铂组 | 10 | 0.726±0.138a | 0.641±0.114a | 0.624±0.118b | 0.594±0.128b |
| 20 | 0.689±0.125a | 0.614±0.138b | 0.574±0.142b | 0.542±0.135b | |
| 30 | 0.589±0.143b | 0.512±0.112b | 0.432±0.111b | 0.382±0.147b | |
| 40 | 0.504±0.164b | 0.413±0.136b | 0.308±0.124b | 0.300±0.158b | |
| 50 | 0.498±0.104b | 0.398±0.132b | 0.298±0.174b | 0.294±0.127b |
各组浓度顺铂+硒蛋氨酸对耐顺铂食管癌细胞EC9706的增殖均有抑制作用, 与空白对照组比较有显著性差异(P<0.01), 且呈现一定的浓度、时间依赖性(表2).而单用同样浓度的顺铂或硒蛋氨酸对耐顺铂食管癌细胞EC9706的生长与空白对照组比较没有差异(P>0.05)表3.当顺铂加硒蛋氨酸浓度为40 mg/L+20 mmol/L处理耐顺铂食管癌细胞72 h后, 对癌细胞增殖的抑制作用最明显.
| 分组 | 剂量(mg/L+ mmol/L) | 24 h | 48 h | 72 h | 96 h |
| 空白对照组 | 0.664±0.112 | 0.732±0.145 | 0.804±0.148 | 0.841±0.168 | |
| 硒蛋氨酸 | 10+5 | 0.652±0.164 | 0.603±0.115a | 0.608±0.114b | 0.574±0.138b |
| 加顺铂组 | 20+10 | 0.620±0.158 | 0.574±0.142b | 0.513±0.123b | 0.468±0.113b |
| 30+15 | 0.546±0.110b | 0.503±0.139b | 0.454±0.146b | 0.401±0.138b | |
| 40+20 | 0.534±0.148b | 0.482±0.124b | 0.312±0.126b | 0.310±0.1145b | |
| 50+25 | 0.521±0.114b | 0.470±0.132b | 0.314±0.125b | 0.300±0.158b |
| 分组 | 剂量(mg/L+ mmol/L) | 24 h | 48 h | 72 h | 96 h |
| 空白对照组 | 0.664±0.112 | 0.732±0.145 | 0.804±0.148 | 0.841±0.168 | |
| 顺铂组 | 10 | 0.624±0.118 | 0.742±0.158 | 0.816±0.112 | 0.821±0.154 |
| 20 | 0.638±0.141 | 0.728±0.115 | 0.824±0.127 | 0.835±0.123 | |
| 30 | 0.654±0.143 | 0.719±0.164 | 0.794±0.138 | 0.828±0.117 | |
| 40 | 0.645±0.172 | 0.726±0.111 | 0.815±0.117 | 0.834±0.114 | |
| 50 | 0.649±0.102 | 0.714±0.153 | 0.820±0.100 | 0.829±0.138 | |
| 硒蛋氨酸 | 5 | 0.658±0.121 | 0.750±0.134 | 0.824±0.153 | 0.831±0.114 |
| 10 | 0.647±0.135 | 0.748±0.137 | 0.828±0.113 | 0.827±0.144 | |
| 15 | 0.634±0.115 | 0.739±0.124 | 0.830±0.154 | 0.835±0.120 | |
| 20 | 0.628±0.119 | 0.740±0.141 | 0.826±0.111 | 0.840±0.161 | |
| 25 | 0.643±0.156 | 0.728±0.174 | 0.831±0.112 | 0.843±0.172 |
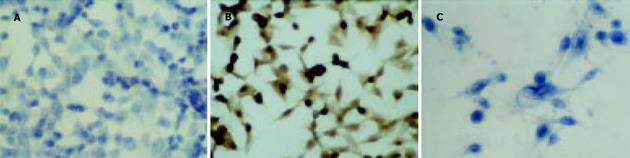
顺铂40 mg/L+硒蛋氨酸20 mmol/L处理耐顺铂食管癌细胞EC9706细胞株72 h后通过倒置显微镜观察, 食管癌细胞形态发生明显变化, 细胞变圆, 细胞数明显减少, 细胞大部分脱落死亡.通过SP免疫组化观察, 耐顺铂食管癌细胞EC9706组P-170染色呈阳性, 绝大多数为胞质着色, 少数核膜亦着色;顺铂+硒蛋氨酸处理耐顺铂食管癌细胞和食管癌细胞系EC9706糖蛋白P-170无表达或弱表达(图1).进一步在40×光镜下, 随机选取6个视野进行阳性细胞计数并计算阳性细胞率, 两组间比较有非常显著性差异(P<0.01, 表4).
肿瘤细胞耐药类型可分为原发耐药和获得性耐药两类, 前者是肿瘤细胞在治疗的初始阶段就对多种抗肿瘤药物无明显反应, 后者是在化疗初期效果很好, 但是经过几个疗程后, 肿瘤细胞对抗肿瘤药物产生耐药性.研究发现, 肿瘤产生耐药性与多种因素有关, 如多药耐药(MDR)基因的过度表达、拓扑异构酶Ⅱ含量减少或性质发生改变、谷胱甘肽(GSH)依赖性解毒酶系统活性增加、多药耐药相关蛋白(MRP)表达增高等, 其中最重要的是MDR基因的过度表达及其编码产物P-糖蛋白(P-glycoprotien, P-gp, P-170)增多.硒(Se)是人和动物必需的微量元素之一.硒具有广泛的生物学作用, 主要是通过参与到蛋白质中发挥作用.有研究证实, 在耐药细胞系中加入微量元素硒, 可改变耐药细胞的生物学特性, 有助于抗癌效应的发挥.认为硒可能作为一种耐药修饰剂(resistance modifying agent, RMAS), 竞争性结合P-糖蛋白(P-170), 抑制细胞内毒性药物外排, 或通过调节细胞内药物与其作用靶部位结合, 增强抗癌药物的抗癌效应, 从而在一定程度上克服了耐药[3-8].本研究证实, 通过顺铂诱导产生的食管癌耐药细胞株, 在加入硒蛋氨酸后, 顺铂对食管癌耐药细胞株仍能抑制癌细胞的生长, 诱导癌细胞凋亡.而单用相同浓度的硒蛋氨酸和顺铂对食管癌耐药细胞株的生长没有抑制作用;用SP免疫组化观察食管癌耐药细胞株P-糖蛋白(P-170)表达, 加硒蛋氨酸处理前绝大多数细胞胞质被染成棕黄色, 少数核膜被染成棕黄色, P-糖蛋白(P-170)表达而成阳性;硒蛋氨酸处理后食管癌耐药细胞株P-糖蛋白(P-170)无表达或弱表达.在40×光镜下, 随机选取6个视野进行阳性细胞计数并计算阳性细胞率, 两组间比较有非常显著性差异(P<0.01).据此推测, 硒蛋氨酸可能通过抑制或者逆转多药耐药(MDR)基因的过度表达, 从而减少多药耐药(MDR)基因编码的P-糖蛋白(P-170)表达, 在一定程度上克服了肿瘤细胞耐药.
编辑: 潘伯荣 审读:张海宁
| 3. | Meuillet E, Stratton S, Prasad Cherukuri D, Goulet AC, Kagey J, Porterfield B, Nelson MA. Chemoprevention of prostate cancer with selenium: an update on current clinical trials and preclinical findings. Cell Biochem. 2004;91:443-458. [PubMed] [DOI] |
| 4. | Sieja K. Seleium (Se) deficiency in women with ovarian cancerun-dergoing chemotherapy and the influence of supplementation with this micro-element on biochemical parameters. Pharmazie. 1998;53:473-476. [PubMed] |
| 5. | Sinha R, El-Bayoumy K. Apoptosis is a critical cellular event in cancer chemoprevention and chemotherapy by selenium compounds. Curr Cancer Drug Targets. 2004;4:13-28. [PubMed] [DOI] |
| 6. | El-Bayoumy K, Sinha R. Mechanisms of mammary cancer chemoprevention by organoselenium compounds. Mutat Res. 2004;551:181-197. [PubMed] [DOI] |
| 7. | Sieja K, Talerczyk M. Selenium as an element in the treatment of ovarian cancer in women receiving chemotherapy. Gynecol Oncol. 2004;93:320-327. [PubMed] [DOI] |
| 8. | Vadgama JV, Wu Y, Shen D, Hsia S, Block J. Effect of selenium in combination with Adriamycin or Taxol on several different cancer cells. Anticancer Res. 2000;20:1391-1414. |