修回日期: 2004-10-02
接受日期: 2004-10-11
在线出版日期: 2005-01-01
目的: 研究食管鳞癌组织中VEGF-C mRNA和蛋白的表达及其与食管癌临床病理特征的关系, 探讨VEGF-C在食管癌淋巴转移中的作用.
方法: 采用逆转录聚合酶链反应(RT-PCR)法检测75例手术切除的食管鳞癌组织VEGF-C mRNA的表达, 免疫组织化学法检测VEGF-C蛋白的表达, 分析其与食管癌临床病理参数的关系.
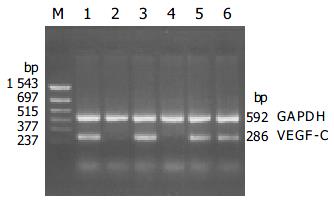
结果: 食管鳞癌组织VEGF-C mRNA的表达阳性率显著高于癌旁组织(44.80% vs 10.67%, P<0.05); VEGF-C蛋白位于肿瘤细胞胞质, 呈棕黄色颗粒; VEGF-C mRNA表达与食管癌患者的年龄、肿瘤大小、分化程度无关, 与肿瘤浸润深度和淋巴结转移显著相关.
结论: 食管癌组织VEGF-C的表达与肿瘤浸润和淋巴结转移有关, VEGF-C是促进食管癌淋巴转移的重要因素之一.
引文著录: 胡绍毅, 马惠文, 边志衡, 何建明, 梁后杰. 食管鳞癌VEGF-C的表达及其临床意义. 世界华人消化杂志 2005; 13(1): 94-96
Revised: October 2, 2004
Accepted: October 11, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 94-96
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/94.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.94
肿瘤的侵袭和转移是癌症患者致死的重要原因之一, 血道和淋巴道转移是癌细胞形成远处转移的主要途径[1-2]. 实验发现, 当实体肿瘤生长到1-2 mm3体积时, 一般需要新生血管的生成, 为肿瘤细胞提供营养, 从而促进肿瘤细胞的进一步生长, 并为肿瘤细胞的转移提供血行通道. 临床病理观察发现, 许多恶性肿瘤瘤周或瘤旁淋巴管内均可见肿瘤细胞的存在, 淋巴结转移是恶性肿瘤转移的早期事件. 对于大多数恶性肿瘤而言, 淋巴道转移可能是其更为主要的转移途径. 既往的研究大多集中在肿瘤血管生成的研究方面, 而对肿瘤淋巴管生成的研究较少[3-5]. 肿瘤细胞淋巴道转移的分子机制尚不明确.
近年研究发现肿瘤淋巴管生成与肿瘤转移密切相关, 而血管内皮生长因子C(vascular endothelial growth factor C, VEGF-C)可诱导肿瘤淋巴管生成, 从而促进肿瘤细胞的淋巴转移[1,6].食管癌是较为常见的消化道恶性肿瘤之一, 淋巴道转移是其常见的转移途径[7-10]. VEGF-C是否参与了食管癌淋巴道转移尚不明确. 通过对食管癌VEGF-C表达及其与临床病理参数关系的研究, 探讨VEGF-C在食管癌淋巴结转移中的作用及其临床意义.
所有患者系2002-10/2003-10在第三军医大学西南医院和新桥医院收治的食管鳞癌患者, 均经手术治疗, 病理确诊, 术前未接受化疗和放疗. 共75例, 其中男性69例, 女性6例, 患者年龄43-75岁, 平均年龄57.5岁. 取癌组织和手术切缘组织, 放入经二乙基焦碳酸酯(DEPC)处理过的Ep管内, 置-70 ℃低温冰箱保存备用. 主要试剂及仪器设备: RT-PCR试剂盒(美国Promcg公司); Tripure mRNA提取试剂(美国Roche公司); VEGF-C和引物(上海申友公司); 兔抗人VEGF-C(北京中山生物技术公司); SP免疫组化试剂盒(北京中山生物技术公司); DAB显色试剂盒(北京中山生物技术公司); PCR扩增仪(9600型, 美国PE公司); 紫外分光光度计(DU-6400型, 美国BioRad公司); 凝胶成像系统(美国BioRad公司).
1.2.1 引物合成: RT-PCR扩增引物根据GencBank资料设计, 引物由上海申友公司合成, 其引物序列为: VEGF-C: 上游引物序列为5'-TTCTTCTCTGTGGCGTGTTC-3'; 下游引物序列为5'-GAGTTGAGGTTGGCCTGTTC-3'; VEGFR-3; 以GAPDH为内参照, 其上游引物序列为: 5'-CAACCCATGGCAAATTCCATGGCA-3'; 下游引物序列为5'-TCTAGACGGCAGGTCAGGTCCAC-3'.
1.2.2 组织总RNA的提取及定量: 按Roche公司RNA提取试剂盒(TripureTMIsolation Reagent)说明书进行操作. 将提取的总RNA用DEPC处理过的去离子水检测RNA颗粒, 紫外线分光光度计进行核酸定量.
1.2.3 RT-PCR检测: 采用一步法试剂盒(美国Promega公司), RT-PCR操作步骤参照试剂盒说明书进行.
1.2.4 食管癌组织VEGF-C免疫组化染色: 采用链霉素-生物素免疫组织化学染色(SP)法. 标本经40 g/L甲醛固定、石蜡包埋制成4 μm厚切片; 二甲苯脱蜡; 梯度酒精水化; 微波抗原修复; 3 mL/L过氧化氢去除内源性过氧化物, 依次滴入封闭液和一抗(免抗人VEGF-C或Podoplanin)4 ℃过夜; 加入生物素化二抗工作液和辣根过氧化物酶标记的链霉亲和素工作液; DAB反应显色; 苏木素复染, 中性树胶封片. 以PBS代替一抗作为阴性对照.
统计学处理 计量资料以mean±SD表示. 采用SPSS10.0软件进行统计学处理. 组间差异采用单因素方差分析, 均数比较采用独立样本t检验. 相关分析采用Pearson相关分析.
75例食管癌组织VEGF-C mRNA阳性的33例, 总阳性率为44.8%, 癌旁组织有8例表达阳性或弱阳性, 阳性率为10.67%, 二者阳性率差异显著(χ2 = 20.98, P = 0.000), 经病理证实有淋巴结转移的病例其转移的淋巴结中也可检测到VEGF-C mRNA(图1).
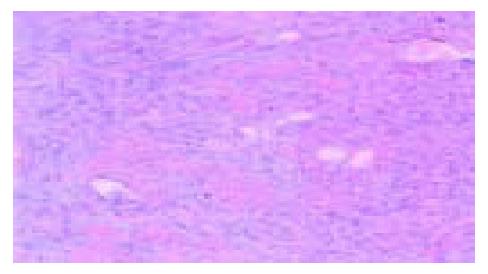
75例食管鳞癌组织VEGF-C蛋白表达阳性率为42.7%(32/75), VEGF-C免疫阳性物质位于肿瘤细胞胞质内, 呈棕黄色颗粒(图2).
根据患者的年龄、浸润深度、肿瘤大小、组织学分级及有无淋巴结转移进行分组比较VEGF-C mRNA表达的差异(表1). 经χ2检验, 患者年龄、肿瘤大小、组织学分级与VEGF-C mRNA表达无显著相关, 而与浸润深度及淋巴结转移密切相关(P<0.05).
| 临床病理参数 | 分类 | n | VEGF-C mRNA表达 | P值 | ||
| 阳性(例) | 阳性率(%) | |||||
| 年龄(岁) | <65 | 46 | 20 | 43.48 | χ2 = 0.01 | |
| ≥65 | 29 | 13 | 44.83 | >0.05 | P = 0.91 | |
| 肿瘤大小 | <5 cm | 60 | 25 | 41.67 | χ2 = 0.66 | |
| >5 cm | 15 | 8 | 53.33 | >0.05 | P = 0.42 | |
| 分化程度 | 低分化 | 24 | 11 | 45.83 | ||
| 中分化 | 36 | 16 | 44.44 | >0.05 | χ2 = 0.02 | |
| 高分化 | 13 | 6 | 46.15 | >0.05 | P = 0.99 | |
| 浸润深度 | T1 | 14 | 2 | 14.29 | χ2 = 6.69 | |
| T2、T3 | 59 | 31 | 52.54 | <0.05 | P = 0.01 | |
| 淋巴结转移 | 无 | 43 | 7 | 16.28 | χ2 = 31.43 | |
| 有 | 32 | 26 | 81.25 | <0.05 | P = 0.000 | |
临床病理研究显示淋巴道转移是大多数实体瘤转移播散的早期事件, 是肿瘤细胞转移的重要途径之一[11]. 既往的研究多集中于肿瘤的血管生成及抗血管生成治疗方面, 但抗血管生成治疗并未获得抗肿瘤转移的预期效果, 其原因可能就在于淋巴管系统与血管系统形成一个互为交通的网络结构, 肿瘤细胞可在两个管道系统之间自由进出, 单纯阻断某一条转移途径并不能很好控制肿瘤细胞的转移. 对于血管系统而言, 毛细淋巴管的腔径比毛细血管大, 而且管壁较薄, 流速缓慢, 剪切力低, 淋巴也与组织间液的组成基本相同, 因而有利于肿瘤细胞的播散、存活及转移. 因此, 关于肿瘤淋巴管生成的研究, 对阐明肿瘤淋巴道转移的机制及进一步阻断淋巴转移具有重要意义.
近年来, 随着一些淋巴管生成诱导因子和淋巴内皮细胞特异性标志物的发现, 对肿瘤淋巴管生成的研究逐渐增多[12-16]. VEGF-C是VEGF家族的成员之一, 是目前已知的最为重要的淋巴管生成诱导因子, 其受体是位于内皮细胞膜上的VEGFR-2(KDR)和VEGFR-3(Flt4). VEGFR-3二聚体胞外区第二个Ig结构域是其特异性配体VEGF-C的结合部位, 当逆向排列的VEGF-C同源二聚体与VEGFR-3结合后, 可迅速使VEGFR-3活化(磷酸化), 并引起下游分子Shc、Grb2磷酸化, 通过丝裂原激活蛋白激酶(Mitogen activated protein kinase, MAPK)信号途径促使淋巴内皮细胞增生迁移, 从而形成新生的毛细淋巴管. 近来研究发现, VEGF-C在许多恶性肿瘤如乳腺癌、甲状腺癌、头颈部癌、胃癌、结肠癌等都有表达[17-20]. 我们采用RT-PCR方法检测到食管癌组织中VEGF-C mRNA表达阳性率为44.8%, 显著高于癌旁组织, 免疫组化染色显示癌组织胞质中可见清晰的棕褐/棕黄色颗粒, 证实VEGF-C蛋白呈阳性表达, 说明食管鳞癌细胞也可合成VEGF-C.
VEGF-C的表达与恶性肿瘤的预后有关. 在对黏膜下侵袭性胃癌的研究中发现, 肿瘤组织VEGF-C表达与肿瘤浸润深度、淋巴管受侵及淋巴结转移有关[21]. 对恶性黑色素瘤的研究也发现肿瘤组织VEGF-C的表达与淋巴结转移及生存期均有显著的相关性[22]. 我们的资料表明, 食管鳞癌组织VEGF-C的表达与年龄、肿瘤大小、组织学分级无关, 而与浸润深度和淋巴结转移显著相关, 表明VEGF-C的高表达在肿瘤的扩散和转移中可能起着重要作用.
VEGF-C促进肿瘤淋巴道转移的机制尚未完全清楚. 动物实验已证实VEGF-C可诱导皮肤淋巴管生成[23]. 将VEGF-C cDNA导入MDN-MB-435乳腺癌细胞原位移植于裸小鼠, 同样观察到VEGF-C可促进肿瘤淋巴管生成和局部淋巴结转移[24,25]. 因此, VEGF-C高表达诱导淋巴管生成可能是其促进肿瘤细胞淋巴道转移的重要机制之一. VEGF-C是否可直接作用于肿瘤细胞, 从而促进其与淋巴内皮细胞的相互作用、迁徙和淋巴道转移, 尚待进一步证实.
总之, 我们的研究从转录和蛋白水平都证实食管鳞癌组织可表达VEGF-C, 且VEGF-C的表达与浸润及淋巴结转移有密切关系. 对食管癌淋巴管生成的分子机制的进一步研究, 不仅可为恶性肿瘤的临床预后提供可靠的预测指标, 也有可能为阻断肿瘤转移提供新的靶点.
编辑: 张海宁
| 1. | Kirsch M, Schackert G, Black PM. Metastasis and angiogenesis. Cancer Treat Res. 2004;117:285-304. [PubMed] |
| 2. | Gotzmann J, Mikula M, Eger A, Schulte-Hermann R, Foisner R, Beug H, Mikulits W. Molecular aspects of epithelial cell plasticity: implications for local tumor invasion and metastasis. Mutat Res. 2004;566:9-20. [PubMed] |
| 3. | Wary KK. Molecular targets for anti-angiogenic therapy. Curr Opin Mol Ther. 2004;6:54-70. [PubMed] |
| 4. | Lohela M, Saaristo A, Veikkola T, Alitalo K. Lymphangiogenic growth factors, receptors and therapies. Thromb Haemost. 2003;90:167-184. [PubMed] |
| 5. | Huang Z, Bao SD. Roles of main pro- and anti-angiogenic factors in tumor angiogenesis. World J Gastroenterol. 2004;10:463-470. [PubMed] |
| 6. | Jussila L, Alitalo K. Vascular growth factors and lymphangiogenesis. Physiol Rev. 2002;82:673-700. [PubMed] [DOI] |
| 7. | Sakamoto F, Natsugoe S, Yoshinaka H, Shimada M, Owaki T, Nakano S, Baba M, Aikou T. Endosonographic detection of mediastinal lymph node metastasis in superficial carcinoma of the esophagus: assessment by type classification and histogram. J Gastroenterol. 2004;39:7-13. [PubMed] |
| 8. | Ueno H, Hirai T, Nishimoto N, Hihara J, Inoue H, Yoshida K, Yamashita Y, Toge T, Tsubota N. Prediction of lymph node metastasis by p53, p21(Waf1), and PCNA expression in esophageal cancer patients. J Exp Clin Cancer Res. 2003;22:239-245. [PubMed] |
| 9. | Makino H, Tajiri T, Onda M, Sasajima K, Miyashita M, Nomura T, Maruyama H, Nagasawa S, Tsuchiya Y, Hagiwara N. Detection of lymph node micrometastasis in esophageal carcinoma. Hepatogastroenterology. 2003;50:1407-1410. [PubMed] |
| 10. | Kato H, Miyazaki T, Nakajima M, Takita J, Sohda M, Fukai Y, Masuda N, Fukuchi M, Manda R, Ojima H. Sentinel lymph nodes with technetium-99m colloidal rhenium sulfide in patients with esophageal carcinoma. Cancer. 2003;98:932-939. [PubMed] |
| 11. | He Y, Karpanen T, Alitalo K. Role of lymphangiogenic factors in tumor metastasis. Biochim Biophys Acta. 2004;1654:3-12. [PubMed] |
| 12. | Clarijs R, Schalkwijk L, Hofmann UB, Ruiter DJ, de Waal RM. Induction of vascular endothelial growth factor receptor-3 expression on tumor microvasculature as a new progression marker in human cutaneous melanoma. Cancer Res. 2002;62:7059-7065. [PubMed] |
| 13. | Jackson DG, Prevo R, Clasper S, Banerji S. LYVE-1, the lymphatic system and tumor lymphangiogenesis. Trends Immunol. 2001;22:317-321. [PubMed] |
| 14. | Mouta Carreira C, Nasser SM, di Tomaso E, Padera TP, Boucher Y, Tomarev SI, Jain RK. LYVE-1 is not restricted to the lymph vessels: expression in normal liver blood sinusoids and down-regulation in human liver cancer and cirrhosis. Cancer Res. 2001;61:8079-8084. [PubMed] |
| 15. | Breiteneder-Geleff S, Soleiman A, Kowalski H, Horvat R, Amann G, Kriehuber E, Diem K, Weninger W, Tschachler E, Alitalo K. Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries: podoplanin as a specific marker for lymphatic endothelium. Am J Pathol. 1999;154:385-394. [PubMed] |
| 16. | Wigle JT, Harvey N, Detmar M, Lagutina I, Grosveld G, Gunn MD, Jackson DG, Oliver G. An essential role for Prox1 in the induction of the lymphatic endothelial cell phenotype. EMBO J. 2002;21:1505-1513. [PubMed] |
| 17. | McCarter MD, Clarke JH, Harken AH. Lymphangiogenesis is pivotal to the trials of a successful cancer metastasis. Surgery. 2004;135:121-124. [PubMed] |
| 18. | Duff SE, Li C, Jeziorska M, Kumar S, Saunders MP, Sherlock D, O'Dwyer ST, Jayson GC. Vascular endothelial growth factors C and D and lymphangiogenesis in gastrointestinal tract malignancy. Br J Cancer. 2003;89:426-430. [PubMed] |
| 19. | Beasley NJ, Prevo R, Banerji S, Leek RD, Moore J, van Trappen P, Cox G, Harris AL, Jackson DG. Intratumoral lymphangiogenesis and lymph node metastasis in head and neck cancer. Cancer Res. 2002;62:1315-1320. [PubMed] |
| 20. | Straume O, Jackson DG, Akslen LA. Independent prognostic impact of lymphatic vessel density and presence of low-grade lymphangiogenesis in cutaneous melanoma. Clin Cancer Res. 2003;9:250-256. [PubMed] |
| 21. | Amioka T, Kitadai Y, Tanaka S, Haruma K, Yoshihara M, Yasui W, Chayama K. Vascular endothelial growth factor-C expression predicts lymph node metastasis of human gastric carcinomas invading the submucosa. Eur J Cancer. 2002;38:1413-1419. [PubMed] |
| 22. | Schietroma C, Cianfarani F, Lacal PM, Odorisio T, Orecchia A, Kanitakis J, D'Atri S, Failla CM, Zambruno G. Vascular endothelial growth factor-C expression correlates with lymph node localization of human melanoma metastases. Cancer. 2003;98:789-797. [PubMed] |
| 23. | Jeltsch M, Kaipainen A, Joukov V, Meng X, Lakso M, Rauvala H, Swartz M, Fukumura D, Jain RK, Alitalo K. Hyperplasia of lymphatic vessels in VEGF-C transgenic mice. Science. 1997;276:1423-1425. [PubMed] |
| 24. | Skobe M, Hawighorst T, Jackson DG, Prevo R, Janes L, Velasco P, Riccardi L, Alitalo K, Claffey K, Detmar M. Induction of tumor lymphangiogenesis by VEGF-C promotes breast cancer metastasis. Nat Med. 2001;7:192-198. [PubMed] |
| 25. | Mattila MM, Ruohola JK, Karpanen T, Jackson DG, Alitalo K, Härkönen PL. VEGF-C induced lymphangiogenesis is associated with lymph node metastasis in orthotopic MCF-7 tumors. Int J Cancer. 2002;98:946-951. [PubMed] |