修回日期: 2004-09-17
接受日期: 2004-09-24
在线出版日期: 2005-01-01
目的: 探讨幽门螺杆菌(H. pylori)感染时胃黏膜组织中核因子-κB(NF-κB)p65蛋白、IL-8及环氧合酶-2(COX-2)mRNA和蛋白的表达间的关系.
方法: 采集H. pylori阴性慢性胃炎18例和H. pylori阳性慢性胃炎38例患者的胃黏膜活检标本, 采用免疫组化法和原位杂交法检测胃黏膜中NF-κB p65蛋白、IL-8及COX-2 mRNA和蛋白的表达情况.
结果: NF-κBp65, IL-8和COX-2主要表达于胃黏膜上皮细胞, 固有层炎性细胞也有不同程度的表达. H. pylori阳性胃黏膜中p65蛋白, IL-8及COX-2 mRNA和蛋白的表达较H. pylori阴性组显著增强(5.6±3.3 vs 3.0±2.5, 3.7±2.6 vs 1.1±1.3, 3.9±2.9 vs 1.9±1.6, 3.0±2.4 vs 1.5±1.1, 2.8±2.3 vs 1.0±0.7, P<0.01), 三者的表达均与胃黏膜炎症程度之间具有显著相关性(P<0.01); 胃黏膜NF-κB p65蛋白表达与IL-8及COX-2 mRNA和蛋白的表达均呈正相关关系(rs分别为0.690, 0.709, 0.448, 0.480, P<0.01).
结论: H. pylori感染导致胃黏膜NF-κB p65, IL-8及COX-2表达增加, NF-κB可能通过调控IL-8和COX-2的表达, 参与了H. pylori相关性胃炎的病理生理过程.
引文著录: 曹萍, 张岫兰, 卢启明, 薛群基. 幽门螺杆菌相关性胃炎中核因子-κB与IL-8, COX-2表达的意义. 世界华人消化杂志 2005; 13(1): 91-93
Revised: September 17, 2004
Accepted: September 24, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 91-93
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/91.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.91
核因子-κB(nuclear factor-κB, NF-κB)是一具有多向性基因转录调节作用的核蛋白因子, 广泛参与多种基因特别是免疫炎症反应相关基因的表达调控, 在机体炎症反应中发挥重要作用[1-4]. 已知IL-8和环氧合酶-2(cyclooxygenase-2, COX-2)是幽门螺杆菌(H. pylori)相关胃炎症反应中较为主要的炎症介质[5-12], 因此我们在原位观察H. pylori相关性胃炎黏膜中核因子-κB p65蛋白、IL-8及COX-2 mRNA和蛋白的表达及细胞定位, 并分析他们之间的关系, 探讨NF-κB在H. pylori致病机制中的作用.
收集2003-09/2004-04甘肃省人民医院经胃镜及病理组织学检查证实的慢性胃炎56例, 男35例, 女21例, 年龄18-70(平均41)岁, 其中H. pylori阴性18例, H. pylori阳性38例, 两组间性别、年龄无显著性差异. 所有研究对象受检前4 wk内均未接受抗生素、铋剂、H2受体拮抗剂、质子泵抑制剂和糖皮质激素治疗. 内镜检查时每例研究对象均于距幽门2-3 cm胃窦大小弯取活检标本4块, 1块用于快速尿素酶试验, 另3块用于病理组织学检测(HE染色和改良Giemsa染色)、免疫组织化学染色和原位杂交染色.鼠抗人NF-κB p65 mAb、兔抗人IL-8和COX-2多克隆抗体购自美国Santa Cruz公司, 免疫组织化学染色试剂盒(S-P即用型)、DAB显色剂和柠檬酸抗原修复液购自福州迈新生物技术开发公司, IL-8 mRNA和COX-2 mRNA原位杂交试剂盒购自武汉博士德生物技术有限公司.
H. pylori诊断采用快速尿素酶试验和改良Giemsa染色, 2项结果均阳性诊断为H. pylori阳性, 2项结果均阴性诊断为H. pylori阴性, 一阴一阳不列入本研究. 内镜活检标本经甲醛固定石蜡包埋, 4靘厚度连续切片备用, 作常规HE染色和改良Giemsa染色以确定病理组织学和H. pylori诊断. 根据悉尼系统胃炎分类标准, 将慢性炎症、活动性、萎缩、肠化和H. pylori密度分别分成0, 1, 2, 3级. 免疫组织化学染色将组织切片脱蜡至水后, 微波修复抗原, 继以免疫组化S-P法染色(步骤按说明书进行), DAB显色, 苏木素复染, 封片. 一抗工作液稀释浓度为: NF-κB p65 1:100; IL-8 1:200; COX-2 1:100. 用PBS替代一抗作阴性对照, 用已知阳性切片作阳性对照. 原位杂交染色将组织切片脱蜡至水, 30 mL/LH2O2室温处理10 min以灭活内源性酶; 胃蛋白酶消化10 min, 暴露核酸片段; 滴加预杂交液, 40 ℃ 4h; 加寡核苷酸探针杂交液, 40 ℃杂交过夜; 加封闭液37 ℃ 30 min; 滴加生物素化鼠抗地高辛37 ℃ 60 min; 加SABC37 ℃ 20 min; 滴加生物素化过氧化物酶37 ℃ 20 min; DAB显色, 苏木素复染, 封片. 用预杂交液替代探针作阴性对照. 结果以胞质或胞核出现棕黄色颗粒为NF-κB p65阳性表达细胞, 以胞质出现棕黄色颗粒为IL-8和COX-2 mRNA及蛋白阳性表达细胞. 每张切片随机观察10个高倍视野, 采用统一的染色积分评价标准, 按染色强度分为4级: 0 = 阴性染色, 1 = 弱阳性染色, 2 = 中度阳性染色, 3 = 强阳性染色; 按阳性细胞数占总细胞数的比例分为5级: 0 = 阴性, 1 = 阳性细胞占1-25%, 2 = 阳性细胞占26-50%, 3 = 阳性细胞占51-75%, 4 = 阳性细胞占76-100%. 每张切片的染色积分以这二者乘积之和表示.
统计学处理 染色积分以mean±SD表示, 应用SPSS10.0统计分析软件包进行统计学处理, 采用秩和检验和Spearman等级相关分析.
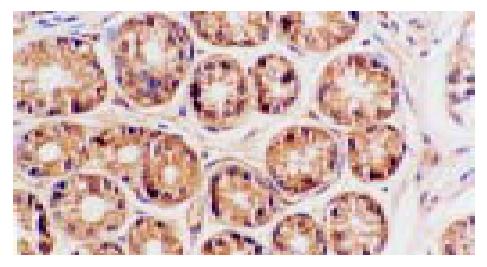
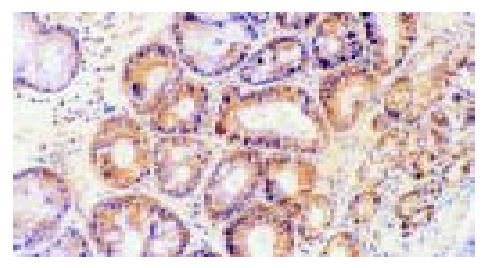
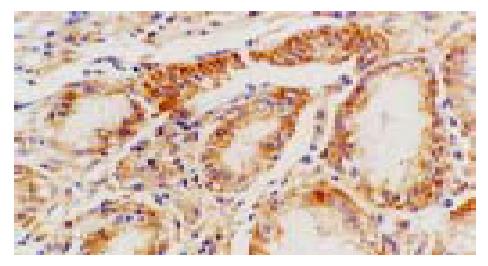
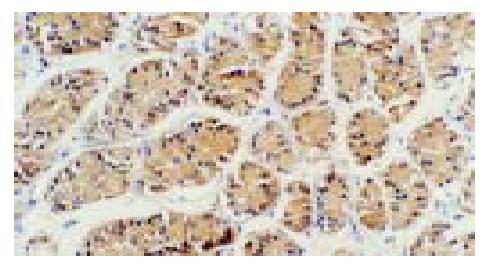
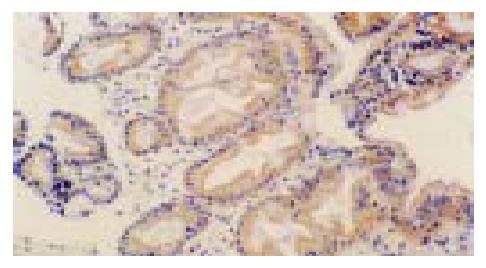
p65蛋白主要表达于胃窦黏膜表面上皮和固有腺上皮细胞, 亦散在表达于部分固有层炎性细胞(主要为单核细胞和淋巴细胞)(图1), 且在H. pylori阴性胃黏膜中p65蛋白阳性染色主要在胞质中, 少数有胞核着色, 而H. pylori感染胃黏膜中则胞质胞核均有阳性染色, 与H. pylori阴性组比较胞核着色明显增加. IL-8 mRNA和蛋白均表达在胃窦黏膜表面上皮和固有腺上皮细胞以及固有层单核细胞的胞质中(图2, 3). COX-2 mRNA和蛋白的阳性染色在胃窦黏膜表面上皮和固有腺上皮细胞及少数单核细胞、内皮细胞的胞质中均可见到, 且几乎所有的肠化上皮均呈阳性(图4, 5).
H. pylori阳性胃黏膜中NF-κB p65蛋白、IL-8及COX-2 mRNA和蛋白的表达较H. pylori阴性组显著增强(P<0.01, 表1), 且p65蛋白、IL-8 mRNA和蛋白的表达与H. pylori密度之间具有明显相关性(rs分别为0.766, 0.527, 0.669; P<0.01), 但COX-2 mRNA和蛋白的表达与H. pylori密度之间无相关性(rs分别为0.368, 0.398; P>0.05). 经Spearman等级相关分析发现, 在H. pylori阳性胃黏膜中NF-κB p65蛋白表达与IL-8及COX-2 mRNA和蛋白的表达均呈正相关关系(rs分别为0.690, 0.709, 0.448, 0.480, P<0.01).
Spearman等级相关分析显示, NF-κB p65蛋白、IL-8及COX-2 mRNA和蛋白的表达均与胃黏膜慢性炎症程度密切相关(rs分别为0.536, 0.491, 0.474, 0.600, 0.411, P<0.01), p65蛋白、IL-8 mRNA和蛋白的表达还与炎症活动性的程度呈正相关(rs分别为0.575, 0.499, 0.521, P<0.01), 但此三者与萎缩和肠化的程度无相关性(P>0.05), 而COX-2 mRNA和蛋白的表达与炎症活动性无关(rs分别为0.236, 0.177; P>0.05), 但与肠化程度呈正相关(rs分别为0.624, 0.401, P<0.05).
本研究结果表明, H. pylori感染者胃黏膜中NF-κB p65表达较H. pylori阴性对照组明显增强, 而且p65阳性染色在H. pylori阴性组主要位于胞质, 在H. pylori阳性组不仅表达在胞质中, 同时胞核着色明显增多, 提示H. pylori感染诱导和激活胃黏膜NF-κB, 使其移位到核, 发挥转录调节功能. 此外, 胃黏膜NF-κB的表达与慢性炎症和活动性的程度相关, 表明NF-κB的诱导激活与H. pylori相关性胃炎的发生发展密切相关. Isomoto et al[13]和Yang et al[14]的研究结果亦支持此观点. COX-2是诱生型酶, 在大多数正常组织中不表达, 在H. pylori相关的胃炎、消化性溃疡、癌前病变及胃癌中表达增高, 因此COX-2的表达可能参与了H. pylori相关性胃炎向癌前病变和胃癌的演进过程. 我们的研究表明, H. pylori感染使胃黏膜中IL-8及COX-2的mRNA和蛋白表达均明显增强, IL-8的表达与胃炎的活动度、炎症程度及H. pylori密度均显著相关, COX-2的表达与慢性炎症和肠化程度有相关性, 这与既往的研究结论一致[7,9-12], 提示IL-8和COX-2参与了H. pylori相关性胃炎的病理生理过程.
炎症反应中细胞因子和炎症递质的表达调控主要在基因转录水平, IL-8和COX-2的基因启动子序列上均含有NF-κB的结合位点, 细胞中NF-κB的激活可诱导IL-8和COX-2的基因转录增强, 而研究已显示H. pylori感染可诱发胃上皮细胞中NF-κB的激活[15-19]. 我们应用原位杂交和免疫组化染色进行原位研究也显示, H. pylori感染诱导和激活胃黏膜NF-κB, 且胃黏膜中NF-κB表达水平与IL-8及COX-2的mRNA和蛋白表达均呈正相关关系, 因此我们推测NF-κB可能通过激活炎性介质IL-8和COX-2的基因转录, 参与了H. pylori的致病过程, 且在其中占据重要地位.
编辑: 潘伯荣 审读: 张海宁
| 1. | Aggarwal BB, Takada Y, Shishodia S, Gutierrez AM, Oommen OV, Ichikawa H, Baba Y, Kumar A. Nuclear transcription factor NF-kappa B: role in biology and medicine. Indian J Exp Biol. 2004;42:341-353. [PubMed] |
| 2. | Aggarwal BB. Nuclear factor-kappaB: the enemy within. Cancer Cell. 2004;6:203-208. [PubMed] |
| 3. | Li Q, Verma IM. NF-kappaB regulation in the immune system. Nat Rev Immunol. 2002;2:725-734. [PubMed] |
| 4. | Jobin C, Sartor RB. The I kappa B/NF-kappa B system: a key determinant of mucosalinflammation and protection. Am J Physiol Cell Physiol. 2000;278:C451-C462. [PubMed] |
| 5. | Sieveking D, Mitchell HM, Day AS. Gastric epithelial cell CXC chemokine secretion following Helicobacter pylori infection in vitro. J Gastroenterol Hepatol. 2004;19:982-987. [PubMed] |
| 6. | Imatani A, Ohara S, Yonechi M, Ohyauchi M, Shimosegawa T. Helicobacter pylori-related cytokines influence gastric acid secretion and gastric mucosal inflammation in gastroduodenal ulcers. Nihon Rinsho. 2004;62:442-447. [PubMed] |
| 7. | Shimizu T, Haruna H, Ohtsuka Y, Kaneko K, Gupta R, Yamashiro Y. Cytokines in the gastric mucosa of children with Helicobacter pylori infection. Acta Paediatr. 2004;93:322-326. [PubMed] |
| 8. | Suzuki T, Ina K, Nishiwaki T, Tsuzuki T, Okada T, Furuta R, Nobata K, Ando T, Kusugami K, Goto H. Differential roles of interleukin-1beta and interleukin-8 in neutrophil transendothelial migration in patients with Helicobacter pylori infection. Scand J Gastroenterol. 2004;39:313-321. [PubMed] |
| 9. | 徐 克强, 张 万岱, 王 继德, 李 子旭, 周 殿元, 张 亚历, 黄 文峰, 姜 泊, 孙 勇. 幽门螺杆菌细胞毒素促进胃黏膜分泌白介素8作用. 世界华人消化杂志. 2002;10:907-911. [DOI] |
| 10. | Wambura C, Aoyama N, Shirasaka D, Kuroda K, Maekawa S, Ebara S, Watanabe Y, Tamura T, Kasuga M. Influence of gastritis on cyclooxygenase-2 expression before and after eradication of Helicobacter pylori infection. Eur J Gastroenterol Hepatol. 2004;16:969-979. [PubMed] |
| 11. | Yu LZ, Gao HJ, Bai JF, Sun G, Zhao HL, Sun L, Miu K, Zhao ZQ. Expression of COX-2 proteins in gastric mucosal lesions. World J Gastroenterol. 2004;10:292-294. [PubMed] |
| 12. | Shah AA, Byrne MF, Cullen L, Walsh T, Fitzgerald DJ, Murray FE. Effect of H. pylori infection on the expression of cyclooxygenase-2 in human gastric mucosa. Prostaglandins Leukot Essent Fatty Acids. 2003;68:1-8. [PubMed] |
| 13. | Isomoto H, Mizuta Y, Miyazaki M, Takeshima F, Omagari K, Murase K, Nishiyama T, Inoue K, Murata I, Kohno S. Implication of NF-kappaB in Helicobacter pylori-associated gastritis. Am J Gastroenterol. 2000;95:2768-2776. [PubMed] |
| 14. | Yang GF, Deng CS, Xiong YY, Gong LL, Wang BC, Luo J. Expression of nuclear factor-kappa B and target genes in gastric precancerous lesions and adenocarcinoma: association with Helicobactor pylori cagA (+) infection. World J Gastroenterol. 2004;10:491-496. [PubMed] |
| 15. | Seo JH, Lim JW, Kim H, Kim KH. Helicobacter pylori in a Korean isolate activates mitogen-activated protein kinases, AP-1, and NF-kappaB and induces chemokine expression in gastric epithelial AGS cells. Lab Invest. 2004;84:49-62. [PubMed] |
| 17. | Bhattacharyya A, Pathak S, Datta S, Chattopadhyay S, Basu J, Kundu M. Mitogen-activated protein kinases and nuclear factor-kappaB regulate Helicobacter pylori-mediated interleukin-8 release from macrophages. Biochem J. 2002;368:121-129. [PubMed] |
| 18. | Kim H, Lim JW, Kim KH. Helicobacter pylori-induced expression of interleukin-8 and cyclooxygenase-2 in AGS gastric epithelial cells: mediation by nuclear factor-kappaB. Scand J Gastroenterol. 2001;36:706-716. |
| 19. | Kim H, Lim JW, Kim KH. Oxidant-sensitive transcription factor and cyclooxygenase-2 by Helicobacter pylori stimulation in human gastric cancer cells. J Environ Pathol Toxicol Oncol. 2002;21:121-129. |