修回日期: 2004-09-17
接受日期: 2004-09-25
在线出版日期: 2005-01-01
目的: 了解慢性乙肝患者肝炎突发时抗原特异性CTL反应水平.
方法: 用四个HBV抗原表位肽四聚体(HBcAg18-27, HBsAg183-191, HBeAg335-343, 多聚酶P的575-583)对外周血中抗原特异性CTL进行检测, 分析健康献血员和慢性乙型肝炎患者病毒抗原表位肽特异性CTL的出现频率.
结果: 6例HLA-A2阳性献血员, 6例HLA-A2阴性的HBV感染患者, 抗原表位肽特异性四聚体阳性细胞占CD8细胞的最高百分比为0.02%, 以0.02%为四聚体检测域值. 29例HLA-A2阳性慢性HBV感染患者, 其中27例外周血四聚体细胞阳性, 检出率93.1%. 肝功能ALT在正常上限5-10倍者四聚体阳性细胞比例描写高于其他组(P<0.05).
结论: HLA-表位肽四聚体技术直接检测外周血中抗原特异性CTL具有特异性高, 敏感性强的特点. 大部分慢性HBV感染患者体内仍存在抗原特异性的CD8细胞, 而且肝炎突发时抗原特异性细胞数量增加.
引文著录: 王洪, 周吉军, 夏杰, 王宇明. 慢性HBV感染肝炎突发患者外周血病毒抗原表位肽特异性CTL的数量研究. 世界华人消化杂志 2005; 13(1): 85-88
Revised: September 17, 2004
Accepted: September 25, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 85-88
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/85.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.85
HBV是非直接致细胞病变病毒, 机体免疫反应是感染发病的主要原因. 细胞毒性T细胞(cytotoxic T lymphocytes, CTL)和Th细胞, 特别是CTL不仅在清除病毒, 而且在肝组织损伤中起主要作用[1-2], 并且认为CTL以直接溶解感染肝细胞的方式造成肝损伤. 慢性乙型肝炎的自然发展过程是肝炎突发(hepatitis flares)和消退(remissions)反复交替、发展的过程. 肝炎突发常指在慢性HBV感染过程中病情稳定或基本稳定一段时间后再次发作, 肝转氨酶的波动, 当ALT升高超过正常上限3倍以上时, 定义为肝炎突发(hepatic flares or acute exacerbation)[3]. 肝炎突发根据肝功能ALT水平分为轻、中、重三型, 其ALT水平分别是正常上限的3-5倍、5-10倍、大于10倍. 肝炎突发不仅仅是ALT的波动, 而且常伴随有血清HBV DNA的波动和HBeAg血清学转换(HBeAg→抗-HBe)[4]并且可能获得控制病毒的效果. 大量临床资料显示, 肝炎突发患者抗病毒治疗效果好于静止期慢性乙型肝炎患者[5-6], 提示肝炎突发时机体免疫反应可能增强. 有研究认为肝炎突发可能是受HLA-Ⅰ限制的针对HBV抗原的CTL作用的结果, 免疫反应是肝炎突发的主要原因[7]. 研究肝炎突发时抗原特异性CTL数量和功能的变化, 不仅有利于阐明肝炎突发的免疫发病机制, 而且还可以指导临床抗病毒治疗. 我们采用了MHC-Ⅰ限制的HLA-A2病毒抗原表位的四聚体, 建立了体外直接检测抗原表位特异性CTL的方法, 并用该方法研究肝炎突发患者抗原特异性CTL出现频数. 现过程总结如下.
1.1.1 病例: 65例慢性乙型肝炎(chronic hepatitis B, CHB)感染患者来源于我科住院和门诊部, 其中男性50例, 女15例, 男女比3.3:1, 年龄18-50岁平均年龄27.4岁. 经检测HBsAg阳性, HBcAg-IgG阳性, 或者HBV DNA阳性, 诊断标准参照2000年第十次全国传染病和寄生虫学会和肝病分会联合修订的病毒性肝炎防治方案. 经检测HLA-A2阳性29例为实验研究组; 另随意挑选6例HLA-A2阴性慢性乙型肝炎患者为对照组. 实验研究组按ALT水平将慢性HBV感染患者分为静止组9例(ALT<40 U/L, 正常上限upper limit of normal, ULN, 肝炎突发组11例(ALT200-400 U/L, 5-10×ULN), 重型突发组9例(ALT>400 U/L, >10×ULN). 所有患者排除甲型肝炎病毒(hepatitis A virus, HAV)、丁型肝炎病毒(hepatitis D virus, HDV)、戊型肝炎病毒(hepatitis E virus, HEV)感染, 无自身免疫性疾病, 近半年未使用拉米夫定和干扰素等免疫调节剂. 献血者13例, 其中HLA-A2阳性献血者6例为阴性对照.
1.1.2 主要试剂及来源: FITC结合鼠抗人HLA-A2单克隆抗体购自Serotec公司. 单克隆抗体(mAbs)FITC结合的鼠抗人CD8单克隆抗体, 溶血素购自BD Pharmingen公司. 四种PE结合HBV抗原表位肽-四聚体购自英国Proimmune公司, 所含HBV抗原表位肽分别为HBcAg18-27, FLPSDFFPSV; HBeAg 183-191, WLSLLVPFV; HBeAg335-343, FLLTRILTI; 多聚酶P575-583, FLLSLGIHL. 四聚体阳性T细胞分别表示为Tc18-27, Te183-191, Te335-343, Tp575-583. PE结合的亲和素购自Prozyme公司. FACS固定液、FACS洗涤液(按Proimmune公司的要求自备).
1.2.1 HLA-A2等位型的鉴定: 所有研究对象取100 μL肝素钠抗凝新鲜全血, 加入检测管和对照管, 分别加入HLA-A2单克隆抗体及同型对照10 μL, 16-27 ℃, 避光放置30 min, 经溶血、FACS洗涤液洗涤, FACS固定液固定, 4 ℃保存, 用于流式细胞仪检测.
1.2.2 四聚体和CD8染色: 所有研究对象分设双阴性对照管、四聚体阴性和CD8阳性对照管、四个四聚体和CD8双阳性检测管, 进行四聚体和CD8染色, 每管取新鲜肝素抗凝全血100 μL, 加入CD8单克隆抗体和四聚体(用量按推荐剂量), 分别加入四聚体和CD8抗体以及相应的同型对照. 避光冰浴30 min, 经溶血、FACS洗涤液洗涤, FACS固定液固定, 4 ℃保存, 用于流式细胞仪检测.
1.2.3 流式细胞仪检测: 抗原特异性CTL的检测采用Becton Dickinson公司流式细胞仪, 数据分析采用CELLQUEST数据分析软件进行.
统计学处理 采用SPSS12.0统计分析软件进行, 各组标准化的样本数值用mean±SD表示, 对各组间数据进行方差分析, 当P<0.05时有显著差异.
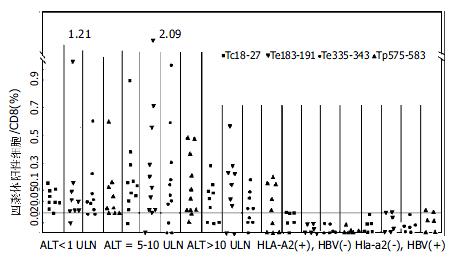
我们检测了29例HLA-A2阳性HBV患者, 6例HLA-A2阴性HBV患者和6例HLA-A2阳性健康献血员外周血中四种四聚体阳性细胞占CD8阳性细胞的比例. HLA-A2阴性HBV患者和健康献血者外周血中很低, 四种抗原肽四聚体阳性细胞都不超过0.02%, 因而, 选0.02%为阴性域值. 在大部分HLA-A2阳性HBV患者外周血中可以检测到不同抗原肽四聚体阳性细胞, 检出率93.1%(27/29), 只是个体差异较大, 最高可以达到2.09%.
我们将慢性HBV感染患者按照ALT水平分为三组, 静止期慢性肝炎(ALT<1×ULN, 肝炎突发(ALT = 5-10×ULN), 重度肝炎突发(ALT>10×ULN). 肝功能化验ALT在正常上限5-10倍者, 四聚体阳性细胞比例高于其他两组, 三组中重度肝炎突发(ALT>10×ULN)最低(图1).
在慢性HBV肝炎患者中, ALT正常组和ALT>10ULN组抗原特异性较低, Te335-343和Tp575-583在ALT正常组高于ALT>10ULN组, 但和两组之间经统计学分析无差异. 对于ALT处于5-10ULN组, Tc18-27、Te183-191和Tp575-583明显高于其他两组, 统计分析相差显著(表1).
CD8细胞的活化以及生物学效应都严格地受HLA-Ⅰ限制, 不同HLA-Ⅰ等位型个体可以有不同的抗原表位, 研究抗原特异性CTL必须结合具体HLA-Ⅰ等位型. 我们所用表位肽是针对HLA-A201等位型个体(与HLA-A2相同), 采用HLA-A2重链制备四聚体, 因此适用于HLA-A2阳性个体的研究[8-10]. 用HLA-A2阴性的HBV感染者和HLA-A2阳性的健康人作为对照, 从而判断所建方法的敏感性和特异性. 我们采用的四聚体复合物检测抗原特异性CTL, 方法可靠, 具有敏感性高, 特异性强的特点[10,11], 为下一步的研究提供了可靠的条件. 在研究中我们对大量的人群进行了HLA-A2的研究, 人群中HLA-A2的比例达45%左右, 与文献报道一致, HLA-A2人群有较好的代表性. 因此, 对HLA-A2个体免疫状态的研究可以反映大部分人群的情况.
以往对抗原特异性CTL的研究多采用Cr51释放实验、有限稀释试验(LDA)等, 这些方法对早期HBV感染的研究起到了重要作用. 但这些方法误差大, 准确性低, 他们都是采用活化细胞的方法来检测抗原特异性CTL, 只反映了具有增生潜能的细胞水平, 明显低估了抗原特异性CTL水平. 四聚体技术具有特异性强、敏感性高的特点, 其敏感性达到10万分之一. 采用四种抗原肽特异性四聚体复合物同时进行检测, 增加了检出的阳性率. 本研究中慢性HBV感染患者四聚体阳性细胞检出率高达93.1%, 说明在慢性HBV感染时, 大部分患者仍存在抗原特异性的细胞免疫反应, 并未出现所谓的"免疫耗竭"(exhaustion, deletion)[12]". 有文献报道, 在病毒慢性感染时, 体内仍存有抗原特异性CD8细胞, 但这些细胞的增生潜力降低, 功能存在部分缺陷, 其功能缺陷可以是T细胞克隆数降低, 出现寡克隆的现象[13], 也可以是T细胞产生细胞因子的能力下降[14-15], 因而用传统方法可能出现"免疫耗竭"的假象. 但确实在慢性HBV感染静止期外周血四聚体阳性细胞出现频率相对较低, 一般在0.2%以下, 在病毒慢性感染时抗原特异性CD8细胞与病毒抗原同时存在[16]. 文献报道, HBV急性自限性感染患者和HBV感染愈合患者, 外周血四聚体阳性细胞高于慢性静止期HBV感染, 可达1%左右, 而慢性静止期HBV感染一般低于0.5%[9-11,17].
病毒特异性T细胞反应低下(hyporesponsiveness)被认为是HBV感染慢性化的一个重要原因. 慢性肝炎突发是常见的临床现象, 在很多研究中都有报道[18-19], 只是最近几年, 随着临床抗病毒治疗实践的增加和免疫学的发展, 人们对肝炎突发才有了更深的认识[6,20]. 大量临床资料显示慢性肝炎突发容易出现HBV DNA复制的终止和HBeAg血清学转换(抗病毒治疗和自然发生), 而且有研究发现慢性HBV感染急性发作(exacerbation)患者[7], 血清转氨酶(ALT)的升高与核心抗原18-27的特异性CTL(Tc18-27)的增生密切相关, 并且在急性发作时Tc18-27细胞表面HLA-DR和CCR5高表达, 而在静止期则为低表达. 我们发现肝炎突发患者四聚体阳性细胞比静止期患者高, 也提示肝炎突发时, 抗原特异性细胞免疫增强. 肝炎突发时机体处于免疫激活状态, 有利于HBV DNA复制的终止和HBeAg血清学转换, 是抗病毒治疗的有利时机.
有大量的研究显示慢性乙肝发生肝炎突发时, ALT水平的高低与发生HBV DNA复制终止和HBeAg血清学转换(HBeAg消失和抗-HBe的出现)的几率平行, 肝炎突发不仅有利于拉米呋定的治疗, 而且还减少YMDD变异株的产生[6], 提示机体免疫反应与ALT水平直接相关, ALT越高, 机体免疫反应越强. 在我们的研究中, 重度肝炎突发(ALT>10碪LN)患者四聚体阳性细胞比轻中度肝炎突发患者低. 可能有两方面的原因: (1)抗原特异性CTL更多的隐藏在肝脏内, 因而外周血中数量少[21]. (2)在重度肝炎突发时, 造成肝损伤的主要效应细胞不是抗原特异性CTL, 有资料也显示, 在发生肝炎突发时, 肝脏中存在大量非抗原特异性CTL, 非抗原特异性CTL是造成损伤的主要效应细胞[2]. 如果对四聚体阳性细胞的绝对计数以及四聚体阳性细胞功能进行研究可能更有利于阐明肝炎突发的免疫学机制.
我们建立了外周全血直接检测抗原特异性CTL数量的方法, 用该方法检测了慢性HBV感染患者外周血抗原特异性CTL数量, 发现慢性HBV感染患者外周血中抗原特异性CTL的检出率很高, 但数量很少. 肝炎突发患者抗原特异性CTL数量升高, 轻中度肝炎突发患者CTL数量高于重度肝炎突发患者CTL数量. 认为肝炎突发时抗原特异性细胞免疫增强, 有利于HBV DNA复制的终止和HBeAg血清学转换, 肝炎突发是抗病毒治疗的有利时机. 如果能够对肝炎突发的全过程进行系统观察, 将有利于阐明肝炎突发的免疫学机制.
编辑: 张海宁
| 1. | Freeman AJ, Marinos G, Ffrench RA, Lloyd AR. Immunopathogenesis of hepatitis C virus infection. Immunol Cell Biol. 2001;79:515-536. [PubMed] |
| 2. | Ando K, Moriyama T, Guidotti LG, Wirth S, Schreiber RD, Schlicht HJ, Huang SN, Chisari FV. Mechanisms of class I restricted immunopathology. A transgenic mouse model of fulminant hepatitis. J Exp Med. 1993;178:1541-1554. [PubMed] |
| 3. | Liaw YF. Hepatitis flares and hepatitis B e antigen seroconversion: implication in anti-hepatitis B virus therapy. J Gastroenterol Hepatol. 2003;18:246-252. [PubMed] |
| 4. | Liaw YF, Pao CC, Chu CM. Changes of serum HBV-DNA in relation to serum transaminase level during acute exacerbation in patients with chronic type B hepatitis. Liver. 1988;8:231-235. [PubMed] |
| 5. | Akuta N, Tsubota A, Suzuki F, Suzuki Y, Hosaka T, Someya T, Kobayashi M, Saitoh S, Arase Y, Ikeda K. Long-term prognosis by lamivudine monotherapy for severe acute exacerbation in chronic hepatitis B infection: emergence of YMDD motif mutant and risk of breakthrough hepatitis -- an open-cohort study. J Hepatol. 2003;38:91-97. [PubMed] |
| 6. | Chien RN, Liaw YF. Short-term lamivudine therapy in patients with chronic hepatitis B. Intervirology. 2003;46:362-366. [PubMed] |
| 7. | Shimada N, Yamamoto K, Kuroda MJ, Terada R, Hakoda T, Shimomura H, Hata H, Nakayama E, Shiratori Y. HBcAg-specific CD8 T cells play an important role in virus suppression, and acute flare-up is associated with the expansion of activated memory T cells. J Clin Immunol. 2003;23:223-232. [PubMed] |
| 8. | He XS, Greenberg HB. Detection and characterization of virus-specific CD8+ T cells using the tetramer approach. Methods Mol Med. 2004;96:89-96. [PubMed] |
| 9. | Reignat S, Webster GJ, Brown D, Ogg GS, King A, Seneviratne SL, Dusheiko G, Williams R, Maini MK, Bertoletti A. Escaping high viral load exhaustion: CD8 cells with altered tetramer binding in chronic hepatitis B virus infection. J Exp Med. 2002;195:1089-1101. [PubMed] |
| 10. | Maini MK, Boni C, Ogg GS, King AS, Reignat S, Lee CK, Larrubia JR, Webster GJ, McMichael AJ, Ferrari C. Direct ex vivo analysis of hepatitis B virus-specific CD8(+) T cells associated with the control of infection. Gastroenterology. 1999;117:1386-1396. [PubMed] |
| 11. | Maini MK, Boni C, Lee CK, Larrubia JR, Reignat S, Ogg GS, King AS, Herberg J, Gilson R, Alisa A. The role of virus-specific CD8(+) cells in liver damage and viral control during persistent hepatitis B virus infection. J Exp Med. 2000;191:1269-1280. [PubMed] |
| 12. | Gallimore A, Glithero A, Godkin A, Tissot AC, Plückthun A, Elliott T, Hengartner H, Zinkernagel R. Induction and exhaustion of lymphocytic choriomeningitis virus-specific cytotoxic T lymphocytes visualized using soluble tetrameric major histocompatibility complex class I-peptide complexes. J Exp Med. 1998;187:1383-1393. [PubMed] |
| 13. | Maru Y, Yokosuka O, Imazeki F, Saisho H, Omata M. Analysis of T cell receptor variable regions and complementarity determining region 3 of infiltrating T lymphocytes in the liver of patients with chronic type B hepatitis. Intervirology. 2003;46:277-288. [PubMed] |
| 14. | Ou R, Zhou S, Huang L, Moskophidis D. Critical role for alpha/beta and gamma interferons in persistence of lymphocytic choriomeningitis virus by clonal exhaustion of cytotoxic T cells. J Virol. 2001;75:8407-8423. [PubMed] |
| 15. | Appay V, Nixon DF, Donahoe SM, Gillespie GM, Dong T, King A, Ogg GS, Spiegel HM, Conlon C, Spina CA. HIV-specific CD8(+) T cells produce antiviral cytokines but are impaired in cytolytic function. J Exp Med. 2000;192:63-75. [PubMed] |
| 16. | Chisari FV, Ferrari C. Hepatitis B virus immunopathogenesis. Annu Rev Immunol. 1995;13:29-60. [PubMed] |
| 17. | Wedemeyer H, He XS, Nascimbeni M, Davis AR, Greenberg HB, Hoofnagle JH, Liang TJ, Alter H, Rehermann B. Impaired effector function of hepatitis C virus-specific CD8+ T cells in chronic hepatitis C virus infection. J Immunol. 2002;169:3447-3458. [PubMed] |
| 18. | Liaw YF, Yang SS, Chen TJ, Chu CM. Acute exacerbation in hepatitis B e antigen positive chronic type B hepatitis. A clinicopathological study. J Hepatol. 1985;1:227-233. [PubMed] |
| 19. | Liaw YF, Tai DI, Chu CM, Pao CC, Chen TJ. Acute exacerbation in chronic type B hepatitis: comparison between HBeAg and antibody-positive patients. Hepatology. 1987;7:20-23. [PubMed] |
| 20. | Liaw YF. Management of YMDD mutations during lamivudine therapy in patients with chronic hepatitis B. J Gastroenterol Hepatol. 2002;17 Suppl 3:S333-S337. [PubMed] |
| 21. | Crispe IN, Dao T, Klugewitz K, Mehal WZ, Metz DP. The liver as a site of T-cell apoptosis: graveyard, or killing field? Immunol Rev. 2000;174:47-62. [PubMed] |