修回日期: 2004-10-03
接受日期: 2004-10-11
在线出版日期: 2005-01-01
门静脉高压症属于血管性疾病, 其病变部位不仅在肝内, 而且肝外门脉系统、体循环及肺循环的血管亦有结构和功能的变化. 国内学者在长期的动物实验和临床实践中发现, 随着门静脉压力的升高, 内脏血管可发生明显的病理改变, 如广泛的门体交通支形成和内脏大动脉、静脉的构型改建等, 将其称为门静脉高压性血管病变. 广义上说, 血管病变还包括内脏, 特别是胃、肠的微血管病变, 称为门脉高压性胃病和门静脉高压性肠血管病变, 主要以血管改变为基本病变, 可引起便血、大便隐血或消化道大出血. 门静脉高压还可合并肺血管病变, 从而产生肺动脉高压和肺静脉高压. 引起肺动脉高压的原因可能是血管活性物质经侧支循环到达肺部, 亦可能是肺本身产生血管活性物质, 从而造成肺的小动脉和动脉发生不可逆性的损伤. 肺静脉高压可导致肺、气管、支气管静脉曲张, 曲张静脉破裂后可引起咯血.
引文著录: 李涛, 杨镇. 门脉高压性血管病变研究进展. 世界华人消化杂志 2005; 13(1): 64-68
Revised: October 3, 2004
Accepted: October 11, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 64-68
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/64.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.64
门静脉高压症属于血管性疾病, 其病变部位不仅在肝内, 而且肝外门脉系统、体循环及肺循环的血管亦有结构和功能的变化. 国内学者在长期的动物实验和临床实践中发现, 随着门静脉压力的升高, 内脏血管可发生明显的病理改变, 如广泛的门体交通支形成和内脏大动脉、静脉的构型改建等, 将其称为门静脉高压性血管病变[1]. 广义上说, 血管病变还包括内脏, 特别是胃、肠的微血管病变, 称为门脉高压性胃病和门静脉高压性肠血管病变, 主要以血管改变为基本病变, 可引起便血、大便隐血或消化道大出血. 门静脉高压还可合并肺血管病变, 从而产生肺动脉高压和肺静脉高压. 引起肺动脉高压的原因可能是血管活性物质经侧支循环到达肺部, 亦可能是肺本身产生血管活性物质, 从而造成肺的小动脉和动脉发生不可逆性的损伤. 肺静脉高压可导致肺、气管、支气管静脉曲张, 曲张静脉破裂后可引起咯血[2-3]. 穿壁静脉(perforating vein)是门静脉高压症时胃壁特有的血管结构[4], 应视为一种血管病变, 胃浆膜外的曲张血管与穿壁静脉连接, 使反常血流进入胃壁的黏膜下层, 而形成曲张静脉. 我们就门脉高压性血管病变的病理及发病机制两方面内容的研究进展进行扼要综述.
内脏静脉壁的结构, 如胶原、弹力纤维和平滑肌等的改变与静脉病变有密切关系. 光镜下见门静脉管壁的平滑肌细胞肥大增生. 电镜发现平滑肌细胞的横面积较正常细胞增加一倍, 血管中膜横切面的面积亦随之增大. 门静脉部分结扎鼠的模型证实, 门静脉的结构、收缩力、收缩成分和结构蛋白均有改变, 结蛋白和肌动蛋白的比例增加, 结蛋白的增加与中间丝增多有关. 血管内膜增厚, 内含增生的胶原纤维和大量方向不一的平滑肌, 中膜也显著增厚, 肌纤维增粗、致密, 外膜有炎性细胞浸润, 门静脉的有效收缩力增加一倍[5].
门静脉高压症患者的脾静脉和胃冠状静脉同样存在动脉化构形改建[6], 表现为: (1)内膜明显增厚, 呈现弥漫性增厚和局灶性增厚斑, 形成新内膜, 内含增生的胶原纤维和大量方向不一的平滑肌细胞. 增生斑块呈丘状, 突向腔内, 亦含有大量胶原纤维和排列紊乱的平滑肌细胞, 受损血管内皮表面有血小板和血细胞黏附、聚集、逐步形成微小血栓, 类似于动脉粥样硬化样斑块. 血管内膜广泛受损, 并有炎性细胞浸润. (2)中膜层显著增厚, 内环肌呈纵、横、斜方向排列, 外纵肌发达, 肌纤维增粗、致密. (3)外膜层有炎性细胞浸润, 并见合并炎症的小淋巴结, 自养血管有挤压现象, 并有血栓形成. (4)部分平滑肌细胞的表型由收缩型向合成型转化, 即胞质内出现较多的粗面内质网、核糖体而肌丝减少, 并从中膜向内膜迁移.
血管内皮细胞附着于血管内膜表面, 是一层半透膜屏障, 同时他还具有复杂的代谢和内分泌功能. 内皮细胞在心血管疾病中的重要性日益受到重视, 但内皮细胞与门静脉高压症的关系有待深入研究. 研究证实, 非肝硬变患者血管内膜完整, 内膜下层有一薄层平滑肌, 外膜滋养血管完整、通畅; 肝硬变患者血管内膜严重受损, 内皮细胞脱落, 内膜下层裸露伴组织水肿, 管壁内有大量炎性细胞和成纤维细胞. 大量血细胞与裸露的内膜下层黏附, 血管腔内有附壁血栓形成. 血管外膜自养血管受挤压变扁平, 亦有血栓形成. McCarthy et al[7]发现当血管内皮细胞及基底膜受损时, 血管对血管紧张素-Ⅱ的敏感性增加, 故内膜的损伤可影响血管的收缩功能.
门脉高压症患者体循环处于一种高排低阻的状态, 即心排出量和动脉血压降低, 而且, 常常合并有脾肿大和脾功能亢进, 这使得患者的脾动脉发生明显的组织病理学改变, 即动脉壁收缩结构的破坏[8]. 具体表现为: (1)动脉内皮细胞受损, 部分内皮细胞脱落, 血小板黏附内膜, 内膜增厚, 中膜平滑肌移行至内膜. (2)Weigert染色证实动脉壁内弹性膜折叠的波纹变平坦, 或完全消失, 并分裂成多层, 有的部位完全断裂. 动脉壁中层弹力纤维亦广泛断裂和退化. 电镜下清晰可见弹力膜分裂、变直、部分断裂. (3)光镜下见中膜平滑肌移行至内膜, 中膜平滑肌细胞有的萎缩、变形, 另一部分则肥大、增生. 平滑肌细胞被胶原纤维分隔, 排列紊乱. 电镜下见平滑肌细胞大小、形态不一, 部分萎缩、变形, 局部胞质坏死形成空泡, 甚至整个肌细胞溶解成黏糊样, 另有一部分平滑肌细胞代偿性肥大、增生. 一些平滑肌细胞的胞质内细胞器明显增多, 线粒体数目增多并肿胀, 嵴消失, 形成空泡. 部分肌细胞胞质内出现较多粗面内质网、核糖体及高尔基体, 而肌丝减少, 体现出平滑肌细胞表型由收缩型向合成型转变. 有的平滑肌细胞的胞质和胞核呈现细胞凋亡的特征, 如膜泡化, 核染色质固缩, 贴于核膜内侧形成块状, 以及凋亡小体等. (4)光镜下见整个管壁胶原纤维及细胞外基质增多, 致管壁胶原化、基质化, 血管增厚、变硬、弹性下降. 电镜下见动脉壁细胞外基质明显增多, 但弹力纤维呈退化和断裂状态.
门脉高压性血管病变的机制尚不完全清楚, 门脉系统的血流动力学改变、免疫反应、基因调控、血管活性物质等因素可能参与了门脉高压性血管病变的过程.
血管壁是一种复杂的生物学材料, 有多层复合结构, 在一定压力范围内, 血管张力、跨壁血压和血管的几何参数遵循生物力学Laplaces定律: T = P(R/W). 血管的张力(T)有一定调节限度, 在弹性范围内, 当血液的跨壁压(P)增加时, 可通过增加管壁厚度(W)、减少血管半径(R)来代偿. 因此, 门静脉的高压力状态可使血管壁增厚.
门脉系统任何部位血管阻力的增加均可导致门静脉高压. 神经体液因素及血管活性药物可主动调控血管平滑肌的收缩. 这种血管阻力的主动变化可发生在肝内微循环, 亦可发生在肝前的门体交通支血管和门静脉及其属支. 影响血管阻力可用Poiselle定律表达: R = 8 μL/μr4, 其中μ为血液的黏度系数, L是血管长度, r是其半径. 由此可见, 肝外门静脉系统血管半径的变化亦是影响门脉血流阻力的主要因素. 内脏静脉的内膜增生、斑块形成、内壁粗糙、弹性及收缩力减弱, 可限制血管舒张并促进附壁血栓形成, 使血管闭塞和管腔变小, 导致血液淤滞及血流不畅, 甚至血流阻断, 增加血流阻力. 当内脏静脉和门体交通支血管收缩时, 门静脉血管阻力可显著增加. 侧支血管曲折迂回, 其长度增加亦能显著影响血流阻力. 门静脉血液中血红蛋白和血浆蛋白浓度的改变, 尤其是胃肠道出血后血液黏度增加, 又可增加门静脉血流的阻力.
血管平滑肌细胞(VSMC)的增生肥大是门脉高压性血管病变的重要内容. Krieger et al[9]发现, 血管机械性的负荷的增加能直接诱导肌球蛋白基因表达, 使RNA和蛋白增加, 诱导肌细胞生长, 因此, VSMC的增生肥大可能是血管对压力增高的一种适应性代偿反应.
持久的门静脉高压力和高血流量的刺激可能是引起门脉高压症患者血管内膜损伤的主要原因. 滋养血管受压使管壁的血供及血氧分压下降, 引起血管内膜缺血性损伤和营养障碍. 肝硬化时肝、肾功能障碍、氧自由基清除下降, 门静脉血中有害物质及氧自由基增多可直接损伤血管内膜.
血管内皮细胞在心血管疾病发病机制中的作用日益引起重视, 门脉高压症的内皮细胞损伤可破坏管壁结构, 导致功能障碍, 影响物质交换, 引起炎症和免疫反应. 肝硬化患者血管外周组织中的细胞明显增多, 主要为淋巴细胞和炎性细胞, 并伴有淋巴滤泡的增生. 免疫组化证实, 门静脉高压症患者的胃冠状静脉壁有血小板源性生长因子(PDGF), 碱性成纤维细胞生长因子(βFGF)、表皮生长因子(FGF), 转化生长因子(TGF-α)等多种生长因子的强阳性表达[10]. 表明胃冠状静脉内压力增高, 可激活血管壁中的平滑肌细胞, 使其释放多种血管活性物质. 这些生长因子又可刺激血管平滑肌增生分化、迁移以及导致胶原纤维、弹性纤维代谢异常. 平滑肌细胞表型转变是对机械性刺激的一种慢性反应, 他不仅可导致细胞迁移, 并可诱发胶原和弹性硬蛋白的合成, 从而使静脉壁增厚、变硬、弹性减弱和血管顺应性下降, 引起血流阻力增加.
研究还证实, 门脉高压症的内脏静脉壁内C3、C4、IgG、IgE、IgA等炎性因子的水平明显高于正常对照组[11]. 因此, 门脉高压症患者的门脉系血管存在明显的免疫炎症反应, 免疫复合物的沉积及免疫炎症反应可能参与门脉高压性血管病变的过程.
有研究用免疫组化和免疫荧光激光扫描共聚焦显微镜技术检测门静脉高压症患者脾静脉和门静脉高压大鼠模型门静脉内皮细胞eNOS、ET-1、PKC、NF-κB的表达, 探讨门静脉高压时其血管内皮细胞eNOS、ET-1表达改变与信息分子PKC、NF-κB的关系, 结果表明门静脉高压症患者脾静脉和门静脉高压大鼠模型门静脉内皮细胞PKC表达呈阳性或强阳性, 对照组呈阴性或弱阳性表达. eNOS、ET-1与NF-κB双重免疫荧光标记的激光扫描共聚焦显微镜检测显示荧光定位均主要在血管内皮, 三者在门静脉高压患者脾静脉和门静脉高压大鼠模型门静脉内皮的荧光信号强度均高于对照组, 说明门静脉血中ET-1和NO的增高是由于门静脉系统内皮细胞合成增多所致, 内皮细胞合成NO的增多与其eNOS表达上调有关. 门静脉高压时其血管内皮细胞的机械应力信号通路被激活, 内皮细胞ET-1和eNOS表达上调与该通路激活有关.
目前认为, 在血管病变的发生中, 内皮细胞和血管平滑肌细胞是两大效应细胞, 各种损伤因子如切应力、流体静压、内毒素、细胞因子、生长因子、炎症递质等, 首先可造成内皮细胞损伤、脱落致胶原纤维暴露, 血小板聚集, 内皮细胞表达黏附分子如ICAM-1, 并释放趋化因子如单核细胞趋化肽-1(MCP-1)[12], 以及补体激活后释放的补体片段C5a[13], 作为趋化因子促使单核细胞与内皮细胞结合并穿透内皮细胞浸入内膜下层, 也促使血管平滑肌细胞向内膜下迁移, 血管平滑肌细胞出现表型转变, 向内膜下迁移及增生、合成大量细胞外基质沉积于血管壁以形成新生内膜, 导致血管构型改建, 血管病变形成. 在这一过程中, 内皮细胞与血管平滑肌细胞之间的相互调控作用贯穿于血管病变发生的始终, 内皮细胞可被看作是各种刺激因子的感受细胞, 而血管平滑肌细胞则成为效应细胞. 这是血管对各种损伤的修复反应, 但同时也是血管病变的形成过程.
c-fos是一种信息传递因子, Dzau et al[14]发现, 血管平滑肌细胞接受信息后, 核内原癌基因c-fos开始表达, 使DNA和mRNA合成增加, 细胞增生. 肝硬化患者脾静脉c-fos表达增强, 表明平滑肌的增生、迁移和表型转变与癌基因的激活有关, 他的信息传导通路能将机械信号和增生基因表达联系起来, 成为血管构形改建的生物学基础.
某些抑癌基因, 如p53基因, 是细胞凋亡的有效调节因子, 可以促进血管平滑肌细胞的凋亡, 而原核基因, 如c-myc和bc1-2, 则可抑制血管平滑肌细胞的凋亡[15-16]. 门脉高压症患者bax基因表达增强, 并参与门脉高压血管平滑肌细胞凋亡的调节. 这表明门脉高压性血管病变过程与基因调控有关. MAPK[17-18]途径是调控细胞增生、分化、凋亡的重要信号传导通路, 许多细胞外刺激因素如紫外线[19]、氧应激[20-21]、细胞因子[22-23]、炎症递质[24-26]等均可刺激细胞上调MAPK的表达与激活. 有实验用针对ERK1/2204位Tyr磷酸化位点特异性抗体研究证实, 在门脉高压症时, 脾静脉血管壁磷酸化ERK1/2表达增高, 其下游因子c-fos的表达也明显增高, 结果提示ERK1/2/c-fos信号传导通路的激活可能参与了门脉高压性血管病变的发生与发展过程.
胶原纤维是一种重要的血管细胞外基质蛋白, 可保持血管壁的韧性与强度. 在人类血管壁中, 胶原纤维蛋白主要由Ⅰ型、Ⅲ型和Ⅴ型构成[27], 在血管内皮损伤时, 胶原纤维可作为一种强烈的启动因子促进血小板聚集. 在介入性血管损伤[27]及动脉粥样硬化[28-29]形成过程中, 均发现血管壁Ⅰ、Ⅲ型胶原及前胶原合成增多.Ⅰ、Ⅲ型胶原及前胶原均属细胞外基质成分, 在血管病变发生时主要由血管平滑肌细胞合成及分泌. 研究认为, Ⅰ、Ⅲ型胶原成分构成比的轻微改变, 即可启动动脉粥样硬化的形成. 在门脉高压性血管病变的研究中, 已发现在胃冠状静脉壁内有纤维连接蛋白和层黏连蛋白合成增多, 提示细胞外基质在门脉高压性血管病变的发生中起重要作用. 有研究用RT-PCR方法研究Ⅰ、Ⅲ型前胶原在门脉高压性血管病变中的表达情况, 以探讨血管病变的发生机制. 结果表明门脉高压症时脾静脉壁Ⅲ型前胶原mRNA表达较非门脉高压症患者增高约5-6倍(P<0.01), 而Ⅰ型前胶原mRNA表达与非门脉高压症患者相比差异无显著性(P>0.05), 说明在门脉高压性血管病变的发生中, Ⅲ型前胶原作为大量表达的细胞外基质成分沉积于血管壁, 是促进脾静脉血管构型改建的重要原因之一.
血管活性物质包括两种: 其一是循环的、体液性的物质, 另一类是血管局部产生的、内源性的物质, 通过旁分泌和自分泌系统作用于血管平滑肌细胞. 免疫组化证实, 门静脉高压症时内脏动脉壁iNOS、P物质、血管活性肠肽(VIP)等活性增加[8], 其中iNOS在脾动脉血管平滑肌细胞内的表达增强, 表明一氧化氮(NO)的产生也相应增多. NO是一种较强的血管舒张因子, 可降低血管对内源性缩血管活性物质的反应性. 其机制主要是NO通过激活血管平滑肌细胞内的可溶性鸟苷酸环化酶, 使cGMP生成增多, 导致细胞内Ca2+减少, 使平滑肌舒张, 血管扩张, 阻力下降. 正常肝脏、门静脉系和内脏动静脉中以eNOS为主, 当肝硬化门静脉高压发生时eNOS表达和活性下降[30]. 应用基因技术转染eNOS[31]或异源性nNOS[32]基因可以明显降低PHT动物门静脉压力. Morales-Ruiz应用PCR技术和核酶保护检测法发现肝硬化大鼠胸主动脉、腹主动脉和肠系膜动脉内iNOSmRNA表达明显增强; Suga et al[33]的研究证明肠系膜动脉对可释放NO的血管扩张剂的舒血管效应明显强于门静脉系. 因此, NO的过度释放可能在门脉高压症的内脏血管低收缩性和血管扩张的发病机制中发挥重要作用[34].
内皮素(Endothelin, ET)是人体最强的缩血管多肽, 对肝脏微循环和门静脉压具有关键性的调节作用. Tieche用定量RT-PCR和RIA方法检测发现胆管结扎肝硬化大鼠模型, 结扎3 d后ET基因表达增加6倍、28 d后ET肽增加30倍, 并且直接与肝脏星状细胞(hepatic stellate cells, HSCs)活化及门静脉压力升高相关. ET基因的表达及活性增加在门静脉和肝脏微循环中比内脏动脉更加明显, 而且其对静脉的收缩效应也明显强于动脉[35], 致使ET与NO成为调节门静脉高压中的两个重要的拮抗因素.
血管紧张素Ⅱ(angtension Ⅱ, AngⅡ)是一种内源性8肽物质, 与靶细胞膜上特异性受体结合成受体-配体复合物后, 诱导靶细胞内Ca2+浓度升高, 后者作为第二信使, 通过不同的级联反应, 产生具有强烈缩血管和促进平滑肌增生效应. 肝硬化门静脉高压时NO、PGT2等扩血管物质直接或间接作用使血管内皮细胞和平滑肌细胞表面AngⅡ受体(AT1、AT2)表达降低, 与AngⅡ亲和力下降, 以及明显增生肥大的VSMC表型改变均可影响血管对AngⅡ的反应性[36].
TGF-β作为一种重要的生长因子, 他在调节血管外基质的沉积中起关键作用[37], 他促进Ⅰ、Ⅲ型前胶原mRNA的转录, 在肝脏及其他组织纤维化中起关键作用, 在肝硬化动物模型及慢性肝炎患者中, TGF-β浓度升高, 并伴随着靶器官内血管外基质的沉积, 在肝脏星状细胞, TGF-β可促进胶原的合成[38], 应用TGF-B抗体或TGF-β受体拮抗剂, 可抑制胶原合成, 相反如加入外源性的TGF-B可使平滑肌内胶原合成增加[39-40]. TGF-β作用广泛, 他主要通过TGF-β受体发挥其生物学效应, TGF-β受体属丝氨酸-苏氨酸激酶, TGF-β与其受体结合后, 磷酸化Smad蛋白, 然后进入核内来调节转录[41], TGF-β还可通过顺序激活Ras、Raf-1、MEK来使细胞外基质合成增加[42-43].
NF-κB作为一种重要的转录调节因子, 在门脉高压血管病变中发挥重要作用[44]. NF-κB激活后, 释放出抑制性亚单位IκB进入核内, 通过JNK、AP-1途径, 促进纤维化相关基因的转录, NF-κB还促进ICAM(intercellular adhesion molecule-1)、VCAM-1(vascular cell adhesion molecule-1) 基因转录[45], 我们知道血管构型改建除了因为血管外胶原沉积增多外, 细胞外基质与血管平滑肌结合位点是造成血管硬化的主要原因, 在此过程中, 黏附分子参与调节平滑肌与血管外基质的结合, 从而促进血管病变的发生.
VEGF基因启动子有AP-1结合位点[46], AP-1与其结合后可促进VEGF的转录, VEGF作用广泛, 首先他可增加血管壁通透性, 是已知的最强烈的促血管通透性增高因子[47], VEGF通过其受体FLt-1和FLk-1起作用, 在肝纤维化时内脏血管主要表达FLt-1, VEGF可通过其FLt-1受体促进细胞增生及胶原合成[48], 另外VEGF他还对单核巨噬细胞具有趋化作用, 增加巨噬细胞的黏附能力, 再由于血管通透性增高, 单核细胞及巨噬细胞进入血管内膜, 造成了炎症因子的释放, 通过各种途径也可以促使平滑肌细胞增生及胶原合成增多[49], VEGF可与碱性细胞生长因子、TGF-β、透明质酸一起相互作用, 共同促进平滑肌细胞增生及胶原合成.
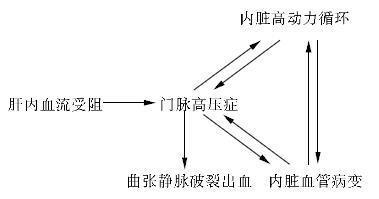
总之, 门脉高压性血管病变的病理改变包括内脏静脉的动脉化构形改建、内脏静脉的内膜损伤以及内脏动脉壁收缩结构的破坏. 门脉高压性血管病变的发病机制可能与门脉系统的血流动力学改变、免疫反应、基因调控、血管活性物质等因素有关. 肝硬化等导致的肝内血流受阻是门脉高压症形成的始动因素, 一方面, 门脉高压症可促进内脏高动力循环和内脏血管病变的形成和发展. 内脏血管病变包括内脏动脉壁收缩结构的破坏, 以及内脏静脉的构型改建. 内脏血管病变是门脉压力和血流量增加的结果. 另一方面, 内脏血管病变又可促进门脉高压症和内脏高动力循环的形成与发展. 这三个因素在肝硬化门脉高压症的发病机制中具有相互作用的关系, 并共同参与形成曲张静脉破裂出血. 三者之间的相互关系如图1所示[50].
编辑: 张海宁
| 2. | Lebrec D. Pharmacological treatment of portal hypertension: hemodynamic effects and prevention of bleeding. Pharmacol Ther. 1994;61:65-107. [PubMed] |
| 3. | Youssef AI, Escalante-Glorsky S, Bonnet RB, Chen YK. Hemoptysis secondary to bronchial varices associated with alcoholic liver cirrhosis and portal hypertension. Am J Gastroenterol. 1994;89:1562-1563. [PubMed] |
| 4. | Burtin P, Calès P, Oberti F, Joundy N, Person B, Carpentier S, Boyer J. Endoscopic ultrasonographic signs of portal hypertension in cirrhosis. Gastrointest Endosc. 1996;44:257-261. [PubMed] |
| 5. | Malmqvist U. Effects of long-term portal hypertension on structure, active force and content of contractile and structural proteins in smooth muscle of the rat portal vein. Acta Physiol Scand. 1994;150:171-179. [PubMed] |
| 7. | McCarthy AL, Woolfson RG, Raju SK, Poston L. Abnormal endothelial cell function of resistance arteries from women with preeclampsia. Am J Obstet Gynecol. 1993;168:1323-1330. [PubMed] |
| 8. | Yang Z, Ren D, Li D, Qiu F. [Portal hypertensive vasculopathy of splenic artery]. Zhonghua Waike Zazhi. 1999;37:412-414. [PubMed] |
| 9. | Krieger JE, Dzau VJ. Molecular biology of hypertension. Hypertension. 1991;18:I3-17. [PubMed] |
| 10. | Yang Z, Tian L, Peng L, Qiu F. Immunohistochemical analysis of growth factor expression and localization in gastric coronary vein of cirrhotic patients. J Tongji Med Univ. 1996;16:229-233. [PubMed] |
| 11. | Mba Mba C, Yang Z. Role of injury of gastric parietal vessels by immunocomplexes in the mechanism of gastric mucosal lesion in portal hypertension with cirrhosis. J Tongji Med Univ. 1997;17:44-48. [PubMed] |
| 12. | Watanabe T, Pakala R, Katagiri T, Benedict CR. Monocyte chemotactic protein 1 amplifies serotonin-induced vascular smooth muscle cell proliferation. J Vasc Res. 2001;38:341-349. [PubMed] |
| 13. | Niculescu F, Rus H. Complement activation and atherosclerosis. Mol Immunol. 2003;36:949-955. [PubMed] |
| 14. | Dzau VJ, Gibbons GH, Morishita R, Pratt RE. New perspectives in hypertension research. Potentials of vascular biology. Hypertension. 1994;23:1132-1140. [PubMed] |
| 15. | Bennett MR, Evan GI, Schwartz SM. Apoptosis of rat vascular smooth muscle cells is regulated by p53-dependent and -independent pathways. Circ Res. 1995;77:266-273. [PubMed] |
| 16. | Chen HW, Huang HC. Effect of curcumin on cell cycle progression and apoptosis in vascular smooth muscle cells. Br J Pharmacol. 1998;124:1029-1040. [PubMed] |
| 17. | Johnson GL, Lapadat R. Mitogen-activated protein kinase pathways mediated by ERK, JNK, and p38 protein kinases. Science. 2002;298:1911-1912. [PubMed] |
| 18. | Agell N, Bachs O, Rocamora N, Villalonga P. Modulation of the Ras/Raf/MEK/ERK pathway by Ca(2+), and calmodulin. Cell Signal. 2002;14:649-654. [PubMed] |
| 19. | Sasu S, LaVerda D, Qureshi N, Golenbock DT, Beasley D. Chlamydia pneumoniae and chlamydial heat shock protein 60 stimulate proliferation of human vascular smooth muscle cells via toll-like receptor 4 and p44/p42 mitogen-activated protein kinase activation. Circ Res. 2001;89:244-250. [PubMed] |
| 20. | Blaschke F, Stawowy P, Goetze S, Hintz O, Gräfe M, Kintscher U, Fleck E, Graf K. Hypoxia activates beta(1)-integrin via ERK 1/2 and p38 MAP kinase in human vascular smooth muscle cells. Biochem Biophys Res Commun. 2002;296:890-896. [PubMed] |
| 21. | Komai N, Morishita R, Yamada S, Oishi M, Iguchi S, Aoki M, Sasaki M, Sakurabayashi I, Higaki J, Ogihara T. Mitogenic activity of oxidized lipoprotein (a) on human vascular smooth muscle cells. Hypertension. 2002;40:310-314. [PubMed] |
| 22. | Goetze S, Xi XP, Kawano Y, Kawano H, Fleck E, Hsueh WA, Law RE. TNF-alpha-induced migration of vascular smooth muscle cells is MAPK dependent. Hypertension. 1999;33:183-189. [PubMed] |
| 23. | Jiang B, Xu S, Brecher P, Cohen RA. Growth factors enhance interleukin-1 beta-induced persistent activation of nuclear factor-kappa B in rat vascular smooth muscle cells. Arterioscler Thromb Vasc Biol. 2002;22:1811-1816. [PubMed] |
| 24. | Christopher J, Velarde V, Jaffa AA. Induction of B(1)-kinin receptors in vascular smooth muscle cells: cellular mechanisms of map kinase activation. Hypertension. 2001;38:602-605. [PubMed] |
| 25. | Douillet CD, Velarde V, Christopher JT, Mayfield RK, Trojanowska ME, Jaffa AA. Mechanisms by which bradykinin promotes fibrosis in vascular smooth muscle cells: role of TGF-beta and MAPK. Am J Physiol Heart Circ Physiol. 2000;279:H2829-H2837. [PubMed] |
| 26. | Agata J, Miao RQ, Yayama K, Chao L, Chao J. Bradykinin B(1) receptor mediates inhibition of neointima formation in rat artery after balloon angioplasty. Hypertension. 2000;36:364-370. [PubMed] |
| 27. | Karim MA, Miller DD, Farrar MA, Eleftheriades E, Reddy BH, Breland CM, Samarel AM. Histomorphometric and biochemical correlates of arterial procollagen gene expression during vascular repair after experimental angioplasty. Circulation. 1995;91:2049-2057. [PubMed] |
| 28. | Shi Y, O'Brien JE, Ala-Kokko L, Chung W, Mannion JD, Zalewski A. Origin of extracellular matrix synthesis during coronary repair. Circulation. 1997;95:997-1006. [PubMed] |
| 29. | Bahadori L, Milder J, Gold L, Botney M. Active macrophage-associated TGF-beta co-localizes with type I procollagen gene expression in atherosclerotic human pulmonary arteries. Am J Pathol. 1995;146:1140-1149. [PubMed] |
| 30. | Rockey DC, Chung JJ. Reduced nitric oxide production by endothelial cells in cirrhotic rat liver: endothelial dysfunction in portal hypertension. Gastroenterology. 1998;114:344-351. [PubMed] |
| 31. | Van de Casteele M, Omasta A, Janssens S, Roskams T, Desmet V, Nevens F, Fevery J. In vivo gene transfer of endothelial nitric oxide synthase decreases portal pressure in anaesthetised carbon tetrachloride cirrhotic rats. Gut. 2002;51:440-445. [PubMed] |
| 32. | Yu Q, Shao R, Qian HS, George SE, Rockey DC. Gene transfer of the neuronal NO synthase isoform to cirrhotic rat liver ameliorates portal hypertension. J Clin Invest. 2000;105:741-748. [PubMed] |
| 33. | Suga T, Itoh H, Shimomura A, Kusagawa M, Ito M, Takase K, Konishi T, Nakano T. Comparison of the effects of various vasodilators on the rat portal vein and mesenteric artery. Eur J Pharmacol. 1993;242:129-136. [PubMed] |
| 34. | Hartleb M, Michielsen PP, Dziurkowska-Marek A. The role of nitric oxide in portal hypertensive systemic and portal vascular pathology. Acta Gastroenterol Belg. 1997;60:222-232. [PubMed] |
| 35. | Lüscher TF, Yang Z, Tschudi M, von Segesser L, Stulz P, Boulanger C, Siebenmann R, Turina M, Bühler FR. Interaction between endothelin-1 and endothelium-derived relaxing factor in human arteries and veins. Circ Res. 1990;66:1088-1094. [PubMed] |
| 36. | Cahill PA, Redmond EM, Sitzmann JV. Endothelial dysfunction in cirrhosis and portal hypertension. Pharmacol Ther. 2001;89:273-293. [PubMed] |
| 37. | George J, Roulot D, Koteliansky VE, Bissell DM. In vivo inhibition of rat stellate cell activation by soluble transforming growth factor beta type II receptor: a potential new therapy for hepatic fibrosis. Proc Natl Acad Sci USA. 1999;96:12719-12724. [PubMed] |
| 38. | Schlumberger W, Thie M, Rauterberg J, Robenek H. Collagen synthesis in cultured aortic smooth muscle cells. Modulation by collagen lattice culture, transforming growth factor-beta 1, and epidermal growth factor. Arterioscler Thromb. 1991;11:1660-1666. [PubMed] |
| 39. | O'Callaghan CJ, Williams B. Mechanical strain-induced extracellular matrix production by human vascular smooth muscle cells: role of TGF-beta(1). Hypertension. 2000;36:319-324. [PubMed] |
| 40. | Simonson MS. Endothelins: multifunctional renal peptides. Physiol Rev. 1993;73:375-411. [PubMed] |
| 41. | Reimann T, Hempel U, Krautwald S, Axmann A, Scheibe R, Seidel D, Wenzel KW. Transforming growth factor-beta1 induces activation of Ras, Raf-1, MEK and MAPK in rat hepatic stellate cells. FEBS Lett. 1997;403:57-60. [PubMed] |
| 42. | Davis BH, Chen A, Beno DW. Raf and mitogen-activated protein kinase regulate stellate cell collagen gene expression. J Biol Chem. 1996;271:11039-11042. [PubMed] |
| 43. | Gómez-Garre D, Largo R, Tejera N, Fortes J, Manzarbeitia F, Egido J. Activation of NF-kappaB in tubular epithelial cells of rats with intense proteinuria: role of angiotensin II and endothelin-1. Hypertension. 2001;37:1171-1178. [PubMed] |
| 44. | Liu H, Lo CR, Czaja MJ. NF-kappaB inhibition sensitizes hepatocytes to TNF-induced apoptosis through a sustained activation of JNK and c-Jun. Hepatology. 2002;35:772-778. [PubMed] |
| 45. | Tomita N, Morishita R, Tomita S, Kaneda Y, Higaki J, Ogihara T, Horiuchi M. Inhibition of TNF-alpha, induced cytokine and adhesion molecule. Expression in glomerular cells in vitro and in vivo by transcription factor decoy for NFkappaB. Exp Nephrol. 2001;9:181-190. [PubMed] |
| 46. | Tischer E, Mitchell R, Hartman T, Silva M, Gospodarowicz D, Fiddes JC, Abraham JA. The human gene for vascular endothelial growth factor. Multiple protein forms are encoded through alternative exon splicing. J Biol Chem. 1991;266:11947-11954. [PubMed] |
| 47. | Keck PJ, Hauser SD, Krivi G, Sanzo K, Warren T, Feder J, Connolly DT. Vascular permeability factor, an endothelial cell mitogen related to PDGF. Science. 1989;246:1309-1312. [PubMed] |
| 48. | Corpechot C, Barbu V, Wendum D, Kinnman N, Rey C, Poupon R, Housset C, Rosmorduc O. Hypoxia-induced VEGF and collagen I expressions are associated with angiogenesis and fibrogenesis in experimental cirrhosis. Hepatology. 2002;35:1010-1021. [PubMed] |
| 49. | Barleon B, Sozzani S, Zhou D, Weich HA, Mantovani A, Marme D. Migration of human monocytes in response to vascular endothelial growth factor(VEGF) is mediated via the receptor Flt-1. Blood. 1996;87:3336-3343. [PubMed] |
| 50. | Yang Z, Zhang L, Li D, Qiu F. Pathological morphology alteration of the splanchnic vascular wall in portal hypertensive patients. Chin Med J (Engl). 2002;115:559-562. [PubMed] |