修回日期: 2004-08-07
接受日期: 2004-08-25
在线出版日期: 2005-01-01
目的: 研究VEGF, TGF-β1, MMP-2, MMP-9在卵巢原发上皮性肿瘤、库肯勃瘤中的表达及其相关性, 以探讨其在库肯勃瘤发生、发展中的作用.
方法: 应用免疫组化S-P法检测VEGF, TGF-β1, MMP-2, MMP-9在45例卵巢原发上皮性肿瘤、38例库肯勃瘤中的表达情况.
结果: VEGF、TGF-β1在卵巢原发上皮性肿瘤和库肯勃瘤组织中的表达显著高于正常卵巢组织(VEGF: χ2 = 5.318, P = 0.021; χ2 = 22.985, P = 0.001. TGFβ1: χ2 = 9.778, P = 0.002; χ2 = 12.584, P = 0.001). MMP-2, MMP-9在正常卵巢组织中表达缺如; VEGF, MMP-2, MMP-9在库肯勃中阳性表达率明显高于卵巢原发上皮性肿瘤(VEGF: χ2 = 13.149, P = 0.001; MMP-2: χ2 = 33.668, P = 0.001; MMP-9:χ2 = 38.839, P = 0.001); TGF-β1阳性表达率在卵巢原发上皮性肿瘤和库肯勃瘤之间无显著差异. VEGF, TGF-β1, MMP-2, MMP-9在卵巢原发上皮性肿瘤、库肯勃瘤中, 任意两指标阳性表达均有正相关性(P<0.05或P<0.01).
结论: VEGF, TGF-β1, MMP-2, MMP-9参与卵巢癌、库肯勃瘤的发生、发展及演进过程, 并可为卵巢上皮性肿瘤及库肯勃瘤的鉴别诊断提供一定依据.
引文著录: 高颖, 娄阁, 杨桐树, 张启凡. 库肯勃瘤组织VEGF, TGF-β1, MMP-2, MMP-9表达的意义. 世界华人消化杂志 2005; 13(1): 49-54
Revised: August 7, 2004
Accepted: August 25, 2004
Published online: January 1, 2005
AIM: To examine the expression of vascular endothelial growth factor (VEGF), transformation-growth factor-β1 (TGF-β1), matrix metalloproteinase (MMP)-2 and MMP-9 in primary epithelial ovarian carcinoma and Krukenberg tumor, and to explore their effects in the carcinogenesis and development of Krukenberg tumor.
METHODS: The expression of VEGF, TGF-β1, MMP-2 and MMP-9 was measured by immunohistochemical S-P method in 45 cases of primary epithelial ovarian carcinoma and 38 cases of Krukenberg tumor.
RESULTS: The positive rates of VEGF and TGF-β1 expression were significantly higher in the tissues of primary epithelial ovarian carcinoma and Krukenberg tumor than those in the normal ovarian tissues (VEGF: χ2 = 5.318, P = 0.021; χ2 = 22.985, P = 0.001; TGFβ1: χ2 = 9.778, P = 0.002; χ2 = 12.584, P = 0.001). The positive rates of MMP-2 and MMP-9 expression were zero in the normal ovarian tissues. The expressions of VEGF, MMP-2 and MMP-9 were remarkably higher in the Krukenberg tumor than those in the primary epithelial ovarian carcinoma (χ2 = 13.149, P = 0.001; χ2 = 33.668, P = 0.001; χ2 = 38.839, P = 0.001). The positive expression of TGF-β1 was not significantly different between tissues of primary epithelial ovarian carcinoma and Krukenberg tumor. The expression of VEGF, TGF-β1, MMP-2 and MMP-9 positively correlated with one another in primary epithelial ovarian carcinoma and Krukenberg tumor (P < 0.05 or P < 0.01).
CONCLUSION: VEGF, TGF-β1, MMP-2 and MMP-9 play important roles in the carcinogenesis and development of ovarian carcinoma and Krukenberg tumor. They may provide evidence for the differential diagnosis between the two diseases.
- Citation: Gao Y, Lou G, Yang TS, Zhang QF. Expression of VEGF, TGF-β1, MMP-2 and MMP-9 in Krukenberg tumor. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 49-54
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/49.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.49
卵巢是恶性肿瘤常见的转移部位. 一切从其他器官转移至卵巢的肿瘤, 都叫做转移性卵巢癌(metastasis ovarian tumors)或继发性卵巢癌(secondary ovarian tumors). 德国人库肯勃(Krukenberg)于1896年首先报道, 故称库肯勃瘤(Krukenbergs tumor). 绝大多数库肯勃瘤来源于胃部[1-2], 也有一些来源于乳腺﹑肠道以及其他一些含有黏液性腺体的器官[3-6]. 库肯勃瘤发病隐匿, 侵袭力强, 恶性程度高, 预后极差. 但库肯勃瘤的发病及转移机制目前尚不十分清楚. 库肯勃瘤治疗效果差与其高度恶性的生物学行为密切相关. 近年来, 介导肿瘤新生血管形成与细胞外基质降解的相关基因引起了人们极大关注. VEGF, TGF-β1, MMP-2, MMP-9在肿瘤中的表达与生物学作用已被人们有所认识. 但迄今未见VEGF, TGF-β1, MMP-2, MMP-9在库肯勃瘤中相关性的研究报道. 采用免疫组化方法检测VEGF, TGF-β1, MMP-2, MMP-9在卵巢原发上皮性肿瘤、库肯勃瘤中的表达及其相关性, 以探讨其在库肯勃瘤发生、发展中的作用.
哈尔滨医科大学第三附属医院1992/2001年手术切除且资料完整的卵巢原发上皮性肿瘤45例(浆液性腺癌15例, 黏液性腺癌16例, 其他类型14例), 库肯勃瘤38例, 原发灶均为胃癌. 年龄20-75(平均42.15)岁. 所有病例均经组织学或细胞学诊断, 术前未经放化疗.
mA6均购自武汉博士德公司, 采用免疫组化S-P法, 染色步骤按说明进行, 用PBS替代一抗作阴性对照. 光镜下见肿瘤细胞的细胞质中出现明确的棕黄色颗粒的细胞为阳性细胞. 阳性强度分为: 弱阳性为1分, 强阳性为3分, 介于二者之间为2分, 同时计算阳性细胞的百分数, <5%计为0分, 5-15%计为1分, 26-50%计为2分, 51-75%计为3分, >75%计为4分, 强度评分与阳性率评分乘积为该组织的免疫组化最后评分.
统计学处理 实验所得数据资料采用方差分析, 计数资料采用χ2检验, 用Bivariate的pearson方法计算变量间的相关性, 所有计算均用SPSS软件包完成.
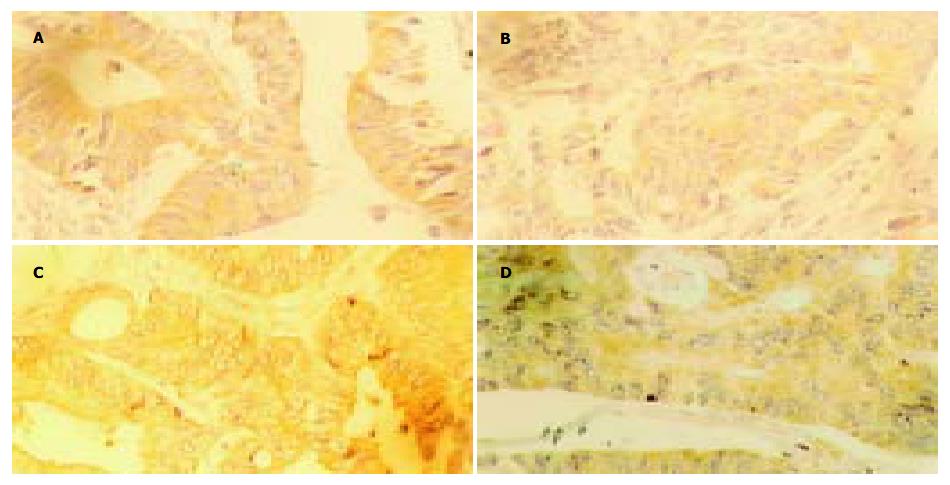
VEGF阳性染色颗粒主要分布于细胞质内(图1A), 在卵巢正常组织和卵巢原发上皮性肿瘤、库肯勃瘤和胃癌组织中的阳性表达率存在明显差异(卵巢正常组织 vs 卵巢原发上皮性肿瘤χ2 = 5.318, P = 0.021; 卵巢正常组织 vs 库肯勃瘤χ2 = 22.985, P = 0.001; 卵巢正常组织 vs 胃癌χ2 = 22.985, P = 0.001). 在卵巢原发上皮性肿瘤阳性表达率为31.1%, 在库肯勃瘤中阳性表达率为71.1%, 二者之间有显著差异(χ2 = 13.149, P = 0.001). VEGF阳性表达率在卵巢癌个病理类型间没有明显统计学差异(P = 0.135), 而其阳性表达率在库肯勃瘤中﹑低未分化之间有显著差异(χ2 = 6.388, P = 0.011). TGF-β1阳性棕黄色颗粒位于细胞质内(图1B), 在卵巢肿瘤组织、库肯勃瘤和胃癌中的阳性表达率显著高于正常卵巢组织(卵巢正常组织 vs 卵巢原发上皮性肿瘤χ2 = 9.778, P = 0.002; 卵巢正常组织 vs 库肯勃瘤χ2 = 12.584, P = 0.001; 卵巢正常组织 vs 胃癌χ2 = 7.021, P = 0.008). TGF-β1在卵巢浆液性、黏液性和其他类型上皮性肿瘤之间的阳性表达率没有明显统计学差异(χ2 = 2.419, P = 0.298), 低分化和未分化库肯勃瘤TGF-β1阳性表达率显著高于中分化库肯勃瘤(χ2 = 14.182, P = 0.001). MMP-2和MMP-9的阳性染色颗粒表达位于细胞质内(图1C-D). MMP-2和MMP-9阳性表达在正常卵巢组织表达缺如(0/20), 库肯勃瘤的MMP-2和MMP-9阳性表达率显著高于卵巢原发上皮性肿瘤(MMP-2: χ2 = 33.668, P = 0.001, MMP-9: χ2 = 38.839, P = 0.001). MMP-2和MMP-9阳性表达率与卵巢原发上皮性肿瘤的病理类型无关, 与库肯勃瘤的分化程度无关(P>0.05). VEGF、TGF-β1和MMP-2阳性表达率在胃癌和库肯勃瘤之间差异不显著(VEGF: χ2 = 0.000, P = 1.000; TGF-β1: χ2 = 1.165, P = 0.280; MMP-2: χ2 = 2.443, P = 0.118), 库肯勃瘤MMP-9的阳性表达率显著高于胃癌(χ2 = 4.094, P = 0.043). 低分化胃癌MMP-2和MMP-9阳性表达率显著高于高中分化胃癌(MMP-2: χ2 = 5.964, P = 0.015; MMP-9:χ2 = 6.133, P = 0.013).
采用对阳性表达程度评分的方法对检测指标进行打分, 利用等级相关进行检验. 结果表明, 在库肯勃瘤中VEGF阳性表达程度与TGF-β1、MMP-2和MMP-9阳性表达程度均存在明显的相关性, TGF-β1与MMP-2和MMP-2与MMP-9之间也存在显著相关性(表2). 在卵巢原发上皮性肿瘤中VEGF、TGF-β1、MMP-2和MMP-9表达之间均有显著相关性(表2), 其中VEGF与MMP-9以及TGF-β1与MMP-2和MMP-9相关系数均大于0.7. 在胃癌原发灶中除VEGF与MMP-2表达没有相关性外, 其他各项检测之间均有显著相关性, 其中仅有TGF-β1与MMP-9的相关系数大于0.7. 尽管VEGF与MMP-9的相关系数仅为0.385, 但具有显著性(表2).
| TGF-β1 | MMP-2 | MMP-9 | |||||
| r | P | r | P | r | P | ||
| 库肯勃瘤 | VEGF | 0.245 | 0.021 | 0.498 | 0.000 | 0.000 | 0.498 |
| TGF-β1 | 0.290 | 0.006 | |||||
| MMP-2 | 0.488 | 0.001 | |||||
| 卵巢原发性上皮性肿瘤 | VEGF | 0.579 | 0.006 | 0.608 | 0.003 | 0.711 | 0.000 |
| TGF-β1 | 0.772 | 0.000 | 0.772 | 0.000 | |||
| MMP-2 | 0.457 | 0.037 | |||||
| 胃癌原发灶 | VEGF | 0.552 | 0.002 | 0.385 | 0.035 | ||
| TGF-β1 | 0.492 | 0.006 | 0.728 | 0.000 | |||
| MMP-2 | 0.439 | 0.015 | |||||
肿瘤的侵袭转移是一个复杂的过程, 包括多个环节和步骤, 其相关的因素有肿瘤细胞表面的多种黏附分子的表达情况, 细胞外基质的组成和降解情况, 肿瘤细胞通过自分泌和旁分泌作用所产生的蛋白水解酶的水平, 肿瘤细胞自身的增生状况, 以及细胞外基质中新生血管的形成情况等等; 本组实验所研究的只是这些复杂因素中的几种, 着重从肿瘤细胞的内部寻找库肯勃瘤发病及转移的相关因素, 为其早期诊断、治疗及预后评估提供更多的思路.
血管内皮生长因子(VEGF)是目前所知的作用最强的促血管生成因子, 在肿瘤血管生成过程中发挥核心作用. VEGF为分子质量34-46 ku的二聚体糖蛋白, 与位于血管内皮细胞或某些肿瘤细胞表面的VEGF受体(Flt-1和KDR/Flt-1)特异性结合, 能够促进血管内皮细胞分裂增生, 增加血管的通透性, 促进纤维蛋白的排出. 形成血管内皮细胞黏附移行的新基质, 血管内皮细胞在VEGF的刺激下增生移行, 形成新的肿瘤供血血管网. VEGF在肿瘤的发生、发展、浸润和转移中发挥重要作用[7-11].
已有研究表明, VEGF在卵巢癌患者血清以及癌组织中呈高表达, 与卵巢癌恶性进展相关, 并与患者预后相关[12-18]. 在我们的实验中VEGF在正常卵巢组织中低表达, 在卵巢原发上皮性肿瘤及库肯勃瘤中的表达高于正常卵巢组织(P<0.05), 说明VEGF的高水平表达与卵巢癌形成、生长和转移密切相关.
VEGF促进肿瘤转移已在大量实验研究中得到了证实. VEGF在卵巢原发上皮性肿瘤与库肯勃瘤之间有显著差异(P<0.05), 在卵巢黏液性及混合性上皮性肿瘤与库肯勃瘤中﹑低未分化之间有显著差异(P<0.05); VEGF在胃癌原发灶中亦有高表达, 提示VEGF可促进肿瘤的转移, 在肿瘤的转移过程中起关键作用, 参与了肿瘤转移灶的形成. 研究发现, VEGF在胃癌组织中呈高表达水平, 且与胃癌的高侵袭性及肝转移具有显著的统计学意义, 并可作为胃癌预后不良的指标[19-25]. Takahashi et al[26-29]转移的结肠癌中VEGF的表达较无转移者明显增高, 推测VEGF的表达与结肠癌的转移关系密切, 同时在膀胱癌、肺癌及乳腺癌等实验研究中得到了相似的结论, 均与本研究所显示的结果一致.
TGF-β是一类结构相关蛋白的异二聚体多肽. 在多种细胞和肿瘤细胞表面存在着受体. TGF-β1上人体内主要的存在形式. 与其受体上被激活的S-mad结合发挥作用. 不仅可以导致转化细胞恶性增生, 也是正常细胞生长调节的一个重要机制[30-33].
TGF-β1是上皮细胞生长抑制因子, 在多数上皮来源的肿瘤中过度表达, 与肿瘤的发生有关. TGF-β1表达与胃癌、甲状腺癌细胞增生有关[34-37]. 有研究发现, TGF-β1有对细胞增生的双向作用、促进细胞转化和分化、抑制免疫以及刺激细胞外基质增生的作用. 我们的研究结果显示, 随着肿瘤的进展, 恶性肿瘤细胞常常分泌大量的细胞因子并获得了由其导致的对生长抑制的耐受造成恶性肿瘤的异常增生, 随即较多的表达了TGF-β1. 随着TGF-β1合成分泌量不断增加, 其免疫抑制功能不断增强, 更重要的是TGF-β1通过其促进血管生成作用[38-40]-当前肿瘤研究的热点之一促进了肿瘤的不断进展.
在本实验中TGF-β1在正常卵巢组织、卵巢上皮性肿瘤组织、库肯勃瘤及胃原发灶中均有表达, TGF-β1卵巢肿瘤组织和正常卵巢组织中有显著差异(P<0.05); 在卵巢浆液性、黏液性和其他类型上皮性肿瘤分别与库肯勃瘤中、低未分化之间有显著差异(P<0.05). 提示TGF-β1在肿瘤的进展、侵袭转移中有重要作用, 但有关其作用机制还需进一步研究.
肿瘤侵袭转移时至少需3次穿过基底膜, 即从原位突破包绕肿瘤的基底膜, 进、出血管通过血管壁基底膜. 肿瘤细胞通过自身或刺激宿主细胞分泌蛋白水解酶来"消化"这些屏障. 基质金属蛋白水解酶是一类Zn2+依赖性降解细胞外基质的分泌性或跨膜性蛋白成分, 迄今为止, 已发现20个家族成员. 根据其作用底物不同, 可分为间质胶原酶、明胶酶、基质溶解酶、膜型基质金属蛋白酶. 其中MMP-2/MMP-9又称为明胶酶A/B, 在肿瘤组织中以活性形式(相对分子质量Mr 62000/82000)和非活性形式(72000/92000)存在, 主要作用底物Ⅳ型胶原[41-42]. 近年来研究结果表明, MMP-2、MMP-9的高表达同多种肿瘤的转移有关, 因而已成为肿瘤研究的热点[43-51].
在本组实验中MMP-2、MMP-9在正常卵巢组织中表达缺失, 卵巢原发上皮性肿瘤中表达较低, 可能与标本保存时间过长, 染色结果不理想有关. 但从中可以看出, MMP-2、MMP-9与卵巢肿瘤的浸润和转移关系密切, MMP-2、MMP-9的表达与卵巢肿瘤病理类型无关. 在恶性肿瘤组织中表达高于正常组织, 且二者在库肯勃瘤与卵巢原发上皮性肿瘤组织中的表达均有显著差异(P<0.05), 在胃癌原发灶中亦有高表达, 提示MMP-2、MMP-9可促进肿瘤的浸润和转移, 参与了胃癌的远处转移. 这一结果支持Monig et al人的观点[52-54], MMP-2、MMP-9在肿瘤组织中过度表达可提示肿瘤已发生侵袭和转移.
在我们的实验中MMP-2在库肯勃瘤中、低未分化之间的表达无显著差异(P>0.05), 说明MMP-2与库肯勃瘤的分化程度无关, 有关这方面的结论, 还需进一步研究探讨. MMP-2在胃癌原发灶中分化与低分化之间有显著差异(P<0.05), 这与众多文献报道不完全一致, 还需进一步验证.
肿瘤的侵袭转移是多因素参与、多步骤完成的分子生物学变化过程. 按Liotta et al提出的癌细胞侵袭转移的三步骤假说, 从分子水平上将这个过程分为: (1)黏附: 首先, 肿瘤细胞通过细胞表面受体和细胞外基质成分的黏附蛋白发生特异性结合; (2)降解: 随之激活肿瘤细胞或宿主细胞的蛋白水解酶, 使贴近肿瘤细胞表面的有限区域内基质发生降解; (3)运动: 肿瘤细胞移入被蛋白酶水解后的基质区, 其运动方向被趋化因子诱导, 肿瘤细胞得以向纵深方向移动. 以上步骤紧密配合、不断重复, 导致肿瘤细胞持续侵袭直至远处转移. 在此过程中, 涉及黏附分子、蛋白水解酶, 运动因子以及多种基因等因素的相互作用与调节; 同时也与EMC成分、细胞表面结构、细胞骨架系统状态、细胞间跨膜信息传递密切相关; 而且逃避宿主免疫监视(即免疫逃避)及血管形成、药物耐药等对肿瘤的侵袭与转移来说也是极为重要的. 在我们的研究中VEGF、TGFβ1、MMP-2﹑MMP-9在卵巢原发上皮性肿瘤、库肯勃瘤中, 任意两指标阳性表达均有正相关性(P<0.05). 可以说明上述因子均参与了肿瘤的侵袭转移过程, 在库肯勃瘤的转移机制中发挥重要作用, 但有关他们之间的相互关系及库肯勃瘤的形成机制, 目前尚不清楚, 有待于进一步研究探讨.
编辑: 潘伯荣 审读: 张海宁
| 1. | Kakushima N, Kamoshida T, Hirai S, Hotta S, Hirayama T, Yamada J, Ueda K, Sato M, Okumura M, Shimokama T. Early gastric cancer with Krukenberg tumor and review of cases of intramucosal gastric cancers with Krukenberg tumor. J Gastroenterol. 2003;38:1176-1180. [PubMed] |
| 2. | Nishioka K, Arai K, Iwasaki Y, Katayanagi S, Takahashi K, Yamaguchi T, Matsumoto H, Miyamoto H, Horiguchi S. Two patients with metastatic ovarian tumor (Krukenberg's tumor) of gastric origin who underwent oophorectomy with paraaortic and intrapelvic lymph node dissection. Gan To Kagaku Ryoho. 2003;30:1839-1843. [PubMed] |
| 3. | Yada-Hashimoto N, Yamamoto T, Kamiura S, Seino H, Ohira H, Sawai K, Kimura T, Saji F. Metastatic ovarian tumors: a review of 64 cases. Gynecol Oncol. 2003;89:314-317. [PubMed] |
| 4. | Praz V, Nordback P, Billing A, Merlini M. Krukenberg's tumor, three years after a colic carcinoma. Swiss Surg. 2002;8:237-239. [PubMed] |
| 5. | La Fianza A, Alberici E, Pistorio A, Generoso P. Differential diagnosis of Krukenberg tumors using multivariate analysis. Tumori. 2002;88:284-287. [PubMed] |
| 6. | Benâaboud I, Ghazli M, Kerroumi M, Mansouri A. [Krukenberg tumor: 9 cases report]. J Gynecol Obstet Biol Reprod (Paris). 2002;31:365-370. [PubMed] |
| 7. | Gerber HP, Ferrara N. The role of VEGF in normal and neoplastic hematopoiesis. J Mol Med (Berl). 2003;81:20-31. [PubMed] |
| 8. | Vacca A, Ria R, Ribatti D, Semeraro F, Djonov V, Di Raimondo F, Dammacco F. A paracrine loop in the vascular endothelial growth factor pathway triggers tumor angiogenesis and growth in multiple myeloma. Haematologica. 2003;88:176-185. [PubMed] |
| 9. | Bellamy WT. Expression of vascular endothelial growth factor and its receptors in multiple myeloma and other hematopoietic malignancies. Semin Oncol. 2001;28:551-559. [PubMed] |
| 10. | Zhang H, Wu J, Meng L, Shou CC. Expression of vascular endothelial growth factor and its receptors KDR and Flt-1 in gastric cancer cells. World J Gastroenterol. 2002;8:994-998. [PubMed] |
| 11. | Conti CJ. Vascular endothelial growth factor: regulation in the mouse skin carcinogenesis model and use in antiangiogenesis cancer therapy. Oncologist. 2002;7 Suppl 3:4-11. [PubMed] |
| 12. | Taraboletti G, Poli M, Dossi R, Manenti L, Borsotti P, Faircloth GT, Broggini M, D'Incalci M, Ribatti D, Giavazzi R. Antiangiogenic activity of aplidine, a new agent of marine origin. Br J Cancer. 2004;90:2418-2424. [PubMed] |
| 13. | Harlozinska A, Sedlaczek P, Kulpa J, Grybos M, Wójcik E, Van Dalen A, Einarsson R. Vascular endothelial growth factor (VEGF) concentration in sera and tumor effusions from patients with ovarian carcinoma. Anticancer Res. 2004;24:1149-1157. [PubMed] |
| 14. | Hata K, Nakayama K, Fujiwaki R, Katabuchi H, Okamura H, Miyazaki K. Expression of the angopoietin-1, angopoietin-2, Tie2, and vascular endothelial growth factor gene in epithelial ovarian cancer. Gynecol Oncol. 2004;93:215-222. [PubMed] |
| 15. | Wong C, Wellman TL, Lounsbury KM. VEGF and HIF-1alpha expression are increased in advanced stages of epithelial ovarian cancer. Gynecol Oncol. 2003;91:513-517. [PubMed] |
| 16. | Del Carmen MG, Smith Sehdev AE, Fader AN, Zahurak ML, Richardson M, Fruehauf JP, Montz FJ, Bristow RE. Endometriosis-associated ovarian carcinoma: differential expression of vascular endothelial growth factor and estrogen/progesterone receptors. Cancer. 2003;98:1658-1663. [PubMed] |
| 17. | Manenti L, Paganoni P, Floriani I, Landoni F, Torri V, Buda A, Taraboletti G, Labianca R, Belotti D, Giavazzi R. Expression levels of vascular endothelial growth factor, matrix metalloproteinases 2 and 9 and tissue inhibitor of metalloproteinases 1 and 2 in the plasma of patients with ovarian carcinoma. Eur J Cancer. 2003;39:1948-1956. [PubMed] |
| 18. | Gadducci A, Viacava P, Cosio S, Cecchetti D, Fanelli G, Fanucchi A, Teti G, Genazzani AR. Vascular endothelial growth factor (VEGF) expression in primary tumors and peritoneal metastases from patients with advanced ovarian carcinoma. Anticancer Res. 2003;23:3001-3008. [PubMed] |
| 19. | Ishikawa M, Kitayama J, Kazama S, Nagawa H. Expression of vascular endothelial growth factor C and D (VEGF-C and -D) is an important risk factor for lymphatic metastasis in undifferentiated early gastric carcinoma. Jpn J Clin Oncol. 2003;33:21-27. [PubMed] |
| 20. | Yan C, Zhu ZG, Yu YY, Ji J, Zhang Y, Ji YB, Yan M, Chen J, Liu BY, Yin HR. Expression of vascular endothelial growth factor C and chemokine receptor CCR7 in gastric carcinoma and their values in predicting lymph node metastasis. World J Gastroenterol. 2004;10:783-790. [PubMed] |
| 21. | Kakeji Y, Koga T, Sumiyoshi Y, Shibahara K, Oda S, Maehara Y, Sugimachi K. Clinical significance of vascular endothelial growth factor expression in gastric cancer. J Exp Clin Cancer Res. 2002;21:125-129. [PubMed] [DOI] |
| 22. | 段 伦喜, 钟 德午, 胡 辅珍, 赵 华, 杨 竹林, 易 文君, 舒 国顺, 华 颂文. 胃癌组织VEGF, Flt1, bFGF, P53表达与胃癌预后的关系. 世界华人消化杂志. 2004;12:546-549. [DOI] |
| 26. | Takahashi Y, Mai M. Significance of angiogenesis and clinical application of anti-angiogenesis. Nihon Geka Gakkai Zasshi. 2001;102:381-384. [PubMed] |
| 27. | Kitadai Y, Amioka T, Haruma K, Tanaka S, Yoshihara M, Sumii K, Matsutani N, Yasui W, Chayama K. Clinicopathological significance of vascular endothelial growth factor (VEGF)-C in human esophageal squamous cell carcinomas. Int J Cancer. 2001;93:662-666. [PubMed] |
| 28. | Linderholm BK, Lindh B, Beckman L, Erlanson M, Edin K, Travelin B, Bergh J, Grankvist K, Henriksson R. Prognostic correlation of basic fibroblast growth factor and vascular endothelial growth factor in 1307 primary breast cancers. Clin Breast Cancer. 2003;4:340-347. [PubMed] |
| 29. | Liu F, Zhang YJ. Roles of VEGF-C and its receptor Flt-4 in proliferation and metastasis of primary breast cancer. Aizheng. 2003;22:1053-1056. [PubMed] |
| 30. | Miyazono K, Kusanagi K, Inoue H. Divergence and convergence of TGF-beta/BMP signaling. J Cell Physiol. 2001;187:265-276. [PubMed] |
| 31. | Sasaki A, Masuda Y, Ohta Y, Ikeda K, Watanabe K. Filamin associates with Smads and regulates transforming growth factor-beta signaling. J Biol Chem. 2001;276:17871-17877. [PubMed] |
| 32. | Chen W, Fu X, Sheng Z. Review of current progress in the structure and function of Smad proteins. Chin Med J (Engl). 2002;115:446-450. [PubMed] |
| 33. | Liu F. Receptor-regulated Smads in TGF-beta signaling. Front Biosci. 2003;8:s1280-s1303. [PubMed] |
| 34. | Kimura ET, Kopp P, Zbaeren J, Asmis LM, Ruchti C, Maciel RM, Studer H. Expression of transforming growth factor beta1, beta2, and beta3 in multinodular goiters and differentiated thyroid carcinomas: a comparative study. Thyroid. 1999;9:119-125. [PubMed] |
| 35. | Nilsson E, Doraiswamy V, Parrott JA, Skinner MK. Expression and action of transforming growth factor beta (TGFbeta1, TGFbeta2, TGFbeta3) in normal bovine ovarian surface epithelium and implications for human ovarian cancer. Mol Cell Endocrinol. 2001;182:145-155. [PubMed] |
| 36. | Boelaert K, McCabe CJ, Tannahill LA, Gittoes NJ, Holder RL, Watkinson JC, Bradwell AR, Sheppard MC, Franklyn JA. Pituitary tumor transforming gene and fibroblast growth factor-2 expression: potential prognostic indicators in differentiated thyroid cancer. J Clin Endocrinol Metab. 2003;88:2341-2347. [PubMed] |
| 38. | Gold LI. The role for transforming growth factor-beta (TGF-beta) in human cancer. Crit Rev Oncog. 1999;10:303-360. [PubMed] |
| 39. | Pasche B. Role of transforming growth factor beta in cancer. J Cell Physiol. 2001;186:153-168. [PubMed] |
| 40. | Teicher BA. Malignant cells, directors of the malignant process: role of transforming growth factor-beta. Cancer Metastasis Rev. 2001;20:133-143. [PubMed] |
| 41. | Sun XM, Dong WG, Yu BP, Luo HS, Yu JP. Detection of type IV collagenase activity in malignant ascites. World J Gastroenterol. 2003;9:2592-2595. [PubMed] |
| 42. | Wang YJ, Liu HL, Guo HT, Wen HW, Liu J. Primary hepatocyte culture in collagen gel mixture and collagen sandwich. World J Gastroenterol. 2004;10:699-702. [PubMed] |
| 47. | Matsumoto K, Minamitani T, Orba Y, Sato M, Sawa H, Ariga H. Induction of matrix metalloproteinase-2 by tenascin-X deficiency is mediated through the c-Jun N-terminal kinase and protein tyrosine kinase phosphorylation pathway. Exp Cell Res. 2004;297:404-414. [PubMed] |
| 48. | Ouyang YW, Peng ZL, Yao XY, Liu SL, He YD. [The expression of matrix metalloproteinase-2 and -9 in cervical cancer and a study of their relationship]. Sichuan Daxue Xuebao Yixueban. 2004;35:330-333. [PubMed] |
| 49. | Klein G, Vellenga E, Fraaije MW, Kamps WA, de Bont ES. The possible role of matrix metalloproteinase (MMP)-2 and MMP-9 in cancer, e.g. acute leukemia. Crit Rev Oncol Hematol. 2004;50:87-100. [PubMed] |
| 50. | La Rocca G, Pucci-Minafra I, Marrazzo A, Taormina P, Minafra S. Zymographic detection and clinical correlations of MMP-2 and MMP-9 in breast cancer sera. Br J Cancer. 2004;90:1414-1421. [PubMed] |
| 51. | Katayama A, Bandoh N, Kishibe K, Takahara M, Ogino T, Nonaka S, Harabuchi Y. Expressions of matrix metalloproteinases in early-stage oral squamous cell carcinoma as predictive indicators for tumor metastases and prognosis. Clin Cancer Res. 2004;10:634-640. [PubMed] |
| 52. | Mönig SP, Baldus SE, Hennecken JK, Spiecker DB, Grass G, Schneider PM, Thiele J, Dienes HP, Hölscher AH. Expression of MMP-2 is associated with progression and lymph node metastasis of gastric carcinoma. Histopathology. 2001;39:597-602. [PubMed] |
| 53. | Zhang S, Li L, Lin JY, Lin H. Imbalance between expression of matrix metalloproteinase-9 and tissue inhibitor of metalloproteinase-1 in invasiveness and metastasis of human gastric carcinoma. World J Gastroenterol. 2003;9:899-904. [PubMed] |