修回日期: 2004-09-20
接受日期: 2004-10-11
在线出版日期: 2005-01-01
目的: 探讨复方甘草酸苷(SNMC)抑制小鼠暴发性肝衰竭肝细胞凋亡的作用及可能的机制.
方法: 将昆明种小鼠70只随机分为A, B, C三组, 分别为正常对照组(5只)、模型组(5只)和SNMC保护组(60只), A组和B组小鼠于给药后6 h全部断颈处死, C组于给药后6 h, 1 d, 3 d, 5 d和7 d各断颈处死5只, 留取肝组织, 应用末端转移酶标记技术(TUNEL)检测肝细胞原位凋亡的情况; 电镜下观察细胞超微结构的改变; 应用免疫组化法分别检测肝组织中Fas, Fas配体(FasL)和天冬氨酸半光氨酸蛋白酶-3(caspase-3)的表达.
结果: C组随着SNMC治疗时间的延长, 凋亡指数逐渐降低, 由6 h的32.3%降至7 d的5%. 与B组相比, C组在1 d, 3 d, 5 d和7 d的调亡指数均有显著性降低(P<0.01); Fas及caspase-3在A组有少量表达, FasL未见表达. B组Fas, FasL及caspase-3阳性表达细胞明显增加, C组随治疗时间的延长, 表达逐渐减少(P<0.01).
结论: 肝细胞异常凋亡在小鼠暴发性肝衰竭的发病中具有重要作用, 其机制可能是通过Fas/FasL系统活化所介导的肝细胞凋亡, 同时也证明SNMC对抑制这种细胞凋亡有一定作用.
引文著录: 毕蔓茹, 杨宝山, 马英骥, 陈立艳, 王岩, 高峰, 王福祥. 复方甘草酸苷对小鼠暴发性肝衰竭Fas/FasL介导的肝细胞凋亡的保护作用. 世界华人消化杂志 2005; 13(1): 26-30
Revised: September 20, 2004
Accepted: October 11, 2004
Published online: January 1, 2005
AIM: To study the effect of Stronger Neo-Minophagen C (SNMC) on inhibiting hepatocyte apoptosis in mice with fulminant hepatic failure (FHF) and its mechanism.
METHODS: Seventy mice were divided randomly into three groups: A (normal control group, n = 5), B (model group, n = 5) and C (SNMC-protecting group, n = 60). Mice in groups A and B were killed 6 h after treated with SNMC. Mice in group C were killed 6 h, 1, 3, 5 and 7 d after treated with SNMC respectively, five mice for each time. The hepatocyte apoptosis in situ was detected by TUNEL. The ultrastructure of hepatocytes was examined by electron microscopy. The expression of Fas, FasL and caspase-3 was detected by immunohistochemistry.
RESULTS: The hepatocyte apoptosis index was 32.3% 6 h after treated with SNMC in group C, which was decreased to 5% after 7 d. The apoptosis index was significantly lower 1, 3, 5 and 7 d after treated with SNMC in group C than that in group B (P < 0.01). Small amount of Fas and caspase-3 were expressed in group A, while no FasL was expressed. The cells with Fas, FasL and Caspase-3 expression were increased significantly. However, Fas, FasL and Caspase-3 expression was decreased with the increasing of time in group C, and their levels were significantly lower 1, 3, 5 and 7 d after treated with SNMC than those in group B (P<0.01).
CONCLUSION: SNMC can effectively protect hepatocytes from apoptosis in mice with FHF, and the mechanism may be related to its effect on the inhibition of Fas/FasL.
- Citation: Bi MR, Yang BS, Ma YJ, Chen LY, Wang Y, Gao F, Wang FX. Effect of SNMC on inhibiting hepatocyte apoptosis induced by Fas/FasL in mice with fulminant hepatic failure. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 26-30
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/26.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.26
近年研究证实细胞凋亡在重型肝炎发病过程中具有重要意义[1-3], 尤其是肝组织中Fas抗原介导的肝细胞凋亡可能是引起重型肝炎的重要原因[4-5]. 动物实验[6-7]也证实细胞凋亡在小鼠暴发性肝衰竭早期就可出现, 并具有重要意义. 有人认为[8]重型肝炎通过抑制残存细胞凋亡, 促进肝细胞再生是肝功能恢复的关键. 然而对重型肝炎肝细胞凋亡的药物阻断方面却研究较少. 目前我们在临床上将复方甘草酸苷(SNMC)应用于重型肝炎的治疗, 并取得一定疗效. 有报道[9]SNMC有调控细胞凋亡的作用. 为了探讨肝细胞凋亡在重型肝炎中的作用及SNMC对肝细胞凋亡的保护作用, 我们建立小鼠暴发性肝衰竭模型来从分子水平进一步研究其机制.
昆明种小鼠, 雌雄各半, 10-12周龄, 质量20-22 g, 购自哈尔滨医科大学第一临床医学院动物实验中心. D-氨基半乳糖(D-Galn)、细菌脂多糖(LPS)购自Sigma公司; 复方甘草酸苷由日本美能发源制药公司提供. 兔抗小鼠FasmAb、兔抗小鼠FasLmAb和兔抗小鼠Caspase-3mAb购自武汉博士德生物工程有限公司; 免疫组织化学染色试剂盒和末端转移酶标记(TUNEL)试剂盒购自北京中山生物技术有限公司.
预实验: 将20只小鼠随机分为模型组和SNMC治疗组, 每组各10只. 模型组小鼠给予D-Galn 1000 mg/kg+LPS100 μg/kg一次ip建立小鼠暴发性肝衰竭模型, 其肝脏组织病理变化相当于重型肝炎肝组织的病理特征. SNMC治疗组给予D-Galn 1000 mg/kg+LPS100 μg/kg一次ip, 同时给予SNMC1mL/kg2次/d ip, 两组共观察7d, 结果模型组小鼠在9-21 h内全部死亡, 治疗组小鼠存活6只. 根据预实验结果我们将正式实验的昆明种小鼠70只随机分为3组, A组为正常对照组(5只); B组为模型组(5只); C组为SNMC保护组(60只). A组腹腔注射生理盐水0.2 mL作为正常对照; B组和C组分别给予D-Galn 1000 mg/kg+LPS100 μg/kg一次性ip建立小鼠暴发性肝衰竭模型. C组同时给予SNMC1 mL/kg2次/d ip. 将A组和B组小鼠于用药后6 h全部断颈处死, C组小鼠于用药后6 h, 1 d, 3 d, 5 d及7 d分别断颈处死5只, 打开腹腔, 摘取肝左叶, 割取肝组织3块, 1块用25 g/L戊二醛固定, 用于电镜分析; 剩余2块用40 g/L多聚甲醛固定, 送病理科石蜡包埋、切片. 石蜡切片常规脱蜡、水化, 再用细胞凋亡检测试剂盒检测, 按TUNEL说明书步骤进行. 最后常规DAB显色, 苏木素复染, 中性树胶封固. 计算凋亡指数并判定肝细胞凋亡程度: 无细胞核棕褐色染色为阴性; 细胞核呈棕褐色染色为阳性. 石蜡切片常规脱蜡、水化, 继以免疫组化试剂盒检测, 步骤按说明书进行. Fas单抗和FasL单抗分别稀释1:100和1:200, Caspase-3抗体稀释1:100, 最后常规DAB显色, 苏木素复染, 中性树胶封固.
统计学处理 实验数据以均数±标准差表示, 组间比较用方差分析.
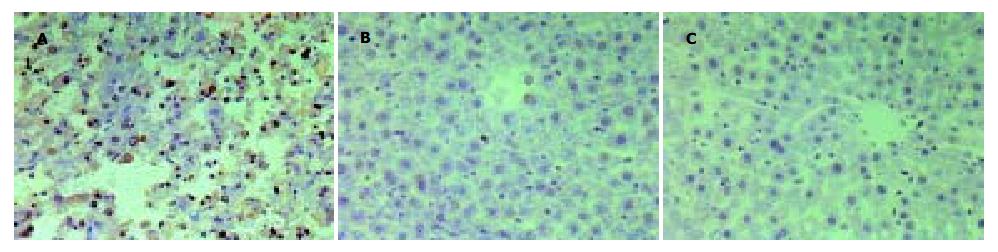
每组各时间点观察2张切片, 每张切片分析5个视野, 每个视野计数100个细胞核, 计数中凋亡细胞百分比的均数为凋亡指数[10](表1). 凋亡的肝细胞多表现为胞膜完整、核改变, 细胞核呈棕褐色着染或细胞浆因核DNA逸出而呈阳性着染, 凋亡小体也呈阳性着色. A组未见凋亡细胞, B组肝组织可见较多凋亡细胞(33.2±4.4), 多分布于炎症坏死区及汇管区(图1A), C组随着治疗时间的延长, 凋亡细胞逐渐减少, 且染色逐渐减弱(图1B-C).
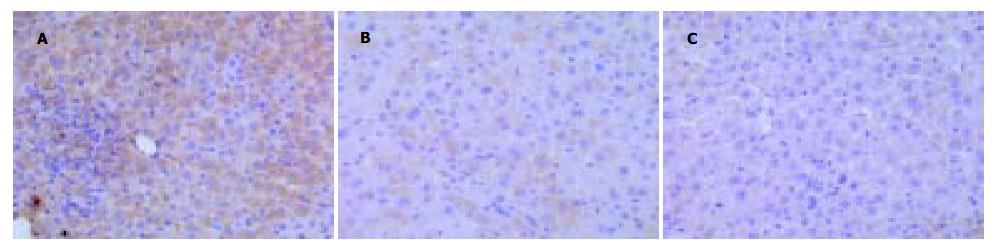
阳性细胞表现为胞质和(或)胞膜呈棕黄色着色. 每组各切片均匀分散地选择3个高倍视野(400倍)进行Fas及FasL阳性细胞记数, 取平均值作为该组阳性细胞数. A组正常肝细胞中Fas抗原有少量表达(5.3±2.8), 且散在分布, 肝细胞大小形态正常, 肝板结构清晰. FasL在正常肝组织未见表达. B组肝细胞Fas及FasL抗原均呈广泛弥漫性表达(82.3±11.0; 61.4±7.6), 且阳性细胞着色较深. 表达以胞质型多见, 少数以胞膜为主, 且在淋巴细胞浸润区周围明显(图2A、3A). C组随着治疗时间的延长, Fas及FasL抗原表达逐渐减少, 着色逐渐减弱(见图2B-C; 3B-C). 从1 d开始Fas及FasL的表达与模型组有显著差异(82.3±11.0 vs 64.7±10.9, t = 5.8, P<0.01; 61.4±7.6 vs 43.1±7.8, t = 7.2, P<0.01).
阳性细胞表现为胞质呈棕黄色着色. 阳性细胞记数方法同上. A组Caspase-3有少量细胞表达(3.9±2.4), 散在分布. B组在大部分肝细胞浆中均有表达(85.6±6.3), 且弥漫分布, 在淋巴细胞浸润区周围较明显. C组随着治疗时间的延长, Caspase-3表达逐渐减少, 从1 d开始Caspase-3的表达与模型组有显著差异(85.6±6.3 vs 72.3±5.2, t = 12.2, P<0.01).
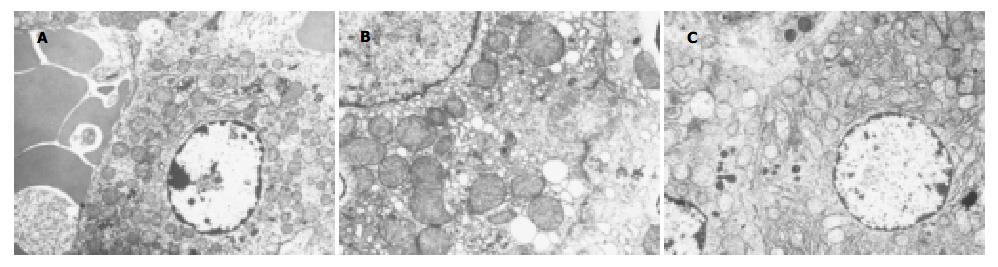
A组可见肝细胞板排列整齐, 肝细胞核仁明显, 细胞内膜结构丰富. B组可见肝细胞核缩小, 染色质边集核膜下, 线粒体肿胀, 质膜和细胞内膜结构明显紊乱(图4A). C组6 h细胞核浓缩的染色质紧靠核膜下, 粗面内质网扩张脱颗粒; 3 d肝细胞膜结构基本接近正常, 细胞核膜下有轻度的染色质边集, 线粒体嵴清晰可见(图4B); 7 d肝细胞膜结构完整, 细胞器丰富, 线粒体嵴密集, 基质密度适中, 窦内皮细胞结构完好, 狄氏间隙内可见肝细胞的微绒毛深入(图4C).
重型肝炎的发病机制十分复杂, 除病毒直接作用外, 免疫介导的肝损伤具有重要作用. 特异性细胞毒性T细胞(CTL)介导的细胞毒效应可能是重型肝炎病变的主要机制[1,10-11], CTL介导的肝细胞凋亡有两种分子机制: 以穿孔素为基础和以Fas抗原为基础的机制. 研究表明, 后一种机制可能在重型肝炎的发病中起更重要的作用. Fas抗原是细胞表面的一种凋亡信号受体, 其诱导细胞凋亡的实质是肝细胞表面的Fas抗原与表达FasL的细胞毒T淋巴细胞相互作用活化靶细胞固有的死亡程序, 使细胞发生凋亡[12]. Fas/FasL系统的作用机制还未完全阐明, 但其主要过程包括死亡受体分子的活化, 凋亡酶体的形成, 胱冬酶家族的活化, 最终导致细胞凋亡的发生[13-18]. SNMC是甘草的皂甙成分, 由甘草次酸和2分子葡萄糖醛酸组成. 用于慢性肝炎患者的治疗, 结果肝功能得到了明显改善, 最近发现SNMC还具有抗细胞凋亡作用[9], 但其确切机制尚未完全阐明.
最新研究发现, 当LPS与D-GalN联合应用时可复制出类似人类暴发性肝衰竭的损伤模型, 更重要的是在肝脏损伤过程中有细胞凋亡的发生, 尤其在损伤早期凋亡特别明显, 因而成为研究暴发性肝衰竭的理想模型[19-20]. 我们建立小鼠暴发性肝衰竭模型, 并应用SNMC进行体内肝细胞保护. 通过预实验发现, 模型组小鼠在9-21 h内全部死亡, 而SNMC治疗组小鼠7 d存活率可达60%, 初步证明SNMC对小鼠暴发性肝衰竭有一定保护作用. TUMEL检测证实, 治疗组随着治疗时间的延长, 凋亡指数明显下降, 由6 h的32.3%降至7 d的5%(P<0.05), 且电镜下观察模型组细胞呈现核缩小、染色质边集等典型凋亡的形态学变化, 而治疗组随治疗时间的延长而明显改善. 说明SNMC对抑制肝细胞凋亡有一定作用. 免疫组化法检测Fas及FasL结果表明, 模型组小鼠肝组织中二者均高水平表达, 在淋巴细胞浸润区尤为显著, 且治疗组随着治疗时间的延长, Fas、FasL的表达逐渐减少, 从1 d开始与模型组有显著差异(P<0.01). 这与TUNEL检测凋亡细胞的结果相一致, 说明Fas、FasL的表达与肝细胞凋亡密切相关; Fas、FasL高表达的地方淋巴细胞浸润也较明显, 推测其诱导肝细胞凋亡的过程可能有淋巴细胞(主要是CTL)参与, 通过CTL介导的细胞毒效应, 活化靶细胞固有的死亡程序, 使肝细胞发生凋亡. 同时也推测SNMC可能是通过抑制Fas、FasL的表达来阻止肝细胞的凋亡.
Caspase-3是凋亡发生的标志酶, 细胞凋亡的主要执行者, 通过特异地裂解一套底物而导致细胞凋亡. 本实验在模型组中caspase-3高水平表达(85.6±6.25), 随治疗时间延长表达逐渐减少, 从1 d开始与模型组有显著差异(P<0.01), 与Fas及FasL的表达基本一致. 说明Fas/FasL系统引发肝细胞凋亡的过程有caspase-3参与, 并根据已有资料推测可能是Fas与FasL结合后形成一种死亡诱导信号复合物(DISC), 依次激活下游的效应Caspase, 并最终引起caspase-3的活化, 导致凋亡的发生. 我们认为肝细胞异常凋亡在小鼠暴发性肝衰竭的发病中具有重要作用, 其机制可能是通过Fas/FasL系统活化介导的肝细胞凋亡. 同时也证明SNMC对抑制这种细胞凋亡有一定作用. 但其具体机制尚有待于进一步研究.
编辑: 潘伯荣 审读: 张海宁
| 6. | Leist M, Gantner F, Bohlinger I, Tiegs G, Germann PG, Wendel A. Tumor necrosis factor-induced hepatocyte apoptosis precedes liver failure in experimental murine shock models. Am J Pathol. 1995;146:1220-1234. [PubMed] |
| 7. | 臧 国庆, 周 霞秋, 俞 红, 谢 青, 王 斌, 赵 国明, 郭 清, 向 月琴, 廖 丹. 肿瘤坏死因子-α诱导肝细胞凋亡在暴发性肝衰竭中的作用. 中华消化杂志. 2000;20:163-166. |
| 10. | Kondo T, Suda T, Fukuyama H, Adachi M, Nagata S. Essential roles of the Fas ligand in the development of hepatitis. Nat Med. 1997;3:409-413. [PubMed] |
| 11. | Gantner F, Leist M, Lohse AW, Germann PG, Tiegs G. Concanavalin A-induced T-cell-mediated hepatic injury in mice: the role of tumor necrosis factor. Hepatology. 1995;21:190-198. [PubMed] |
| 14. | Finkel E. Pathways to death become clearer in the Antipodean sunshine. Lancet. 1998;351:653. [PubMed] |
| 15. | Steller H. Artificial death switches: induction of apoptosis by chemically induced caspase multimerization. Proc Natl Acad Sci USA. 1998;95:5421-5422. |
| 16. | Salvesen GS, Dixit VM. Caspases: intracellular signaling by proteolysis. Cell. 1997;91:443-446. [PubMed] |
| 17. | Jones RA, Johnson VL, Buck NR, Dobrota M, Hinton RH, Chow SC, Kass GE. Fas-mediated apoptosis in mouse hepatocytes involves the processing and activation of caspases. Hepatology. 1998;27:1632-1642. [PubMed] |
| 19. | Zhang YS, Tu ZG. Regulation of alpha 1-adrenoceptor on rat hepatocyte apoptosis induced by D-galactosamine and lipopolysaccharide. Acta Pharmacol Sin. 2000;21:627-632. [PubMed] |