修回日期: 2004-09-20
接受日期: 2004-10-11
在线出版日期: 2005-01-01
目的: 构建携带反义多药耐药相关蛋白(MRP)基因的重组腺病毒微球, 了解包载反义RNA重组腺病毒微球逆转肝细胞癌MRP的治疗效果.
方法: 采用可降解的生物材料聚乳酸-聚乙烯醇(PELA)包被携带反义MRP基因的重组腺病毒制成微球, 体外测定微球的粒径、载病毒量、包封率及释放规律, 并用其转染人肝癌耐药细胞株HepG2/ADM, 48 h及120 h后检测转染细胞荧光强度. MTT法检测耐药细胞的阿霉素半数致死量(IC50); 流式细胞仪检测细胞内红色荧光强度; 以β-actin为内参照, 以RT-PCR法观察转染后MRPmRNA表达量的高低. 观察经肝动脉注射rAdV微球后肿瘤体积大小、生长率及平均生存时间.
结果: 成功构建了携带反义MRP基因的重组腺病毒微球, 直径约1.765 μm, 包封率为52.4%, 载病毒率为5.5×1011efu/g, 在120 h内释放病毒量接近50%, 总的释放时间长于240 h. 释放出的病毒保持活性, 10 mg微球48 h对HepG2/ADM耐药细胞株转导效率可达90%以上. HepG2/ADM细胞48 h及120 h阿霉素IC50为9.72, 4.15 μg; 以HepG2细胞内DNR的荧光强度为对照, rAdv微球组转染后120 h与HepG2/ADM及rAdv组比较, 细胞内DNR浓度有所升高(168.6±6.97 vs 98.39±6.17; 168.6±6.97 vs 112.52±9.21, t = 13.68及9.69, P = 0.001及0.001<0.01). 诱导后HepG2/ADM MRP高表达, 转染Adv微球后48 h及120 h, MRPmRNA的表达强度较转染前明显降低, 以120 h表达最弱. 转染Adv微球后120 h与48 h相比, MRPmRNA/βactin的比值分别较转染前降低16.7%及63.6%; 120 h较转染AdV48 h表达降低26.25%. 治疗组 vs 对照组, 生理盐水组, 空白微球组及rAdv组(n = 4), 肿瘤生长率显著降低(0.96±0.25 vs 8.79±0.34; 4.82±0.30; 4.67±0.67; 2.97±0.29, t = 36.10, 24.43, 12.28及13.81, P = 0.0001, 0.0009, 0.001及0.001<0.05). 平均生存时间显著延长(43.6±7.4 vs 23.4±3.2; 25.3±3.7; 26.5±4.1; 33.7±2.9, t = 5.521, 4.599, 4.522, 2.796, P = 0.005, 0.007, 0.007及0.049<0.05).
结论: 聚乳酸-聚乙烯醇共聚物(PELA)包载反义RNA重组腺病毒制备的微球, 可有效抑制MRP的表达提高耐药细胞对化疗药物的敏感性, 这为高分子化学与基因治疗的结合提供了临床应用的理论基础.
引文著录: 余少鸿, 严律南, 周绍兵, 张燕, 苟兴华, 韩蕾, 陈永兵. 包载反义RNA重组腺病毒微球的制备及逆转肝癌的体内外效果. 世界华人消化杂志 2005; 13(1): 20-25
Revised: September 20, 2004
Accepted: October 11, 2004
Published online: January 1, 2005
AIM: To construct the microsphere, in which recombinant adenovirus (rAdV) was encapusulated, carrying antisense multidrug resistance-associated protein (MRP) gene (as-mrp) and to investigate its effect on reversing MRP-mediated mutidrug resistance of hepatocellular carcinoma.
METHODS: The microsphere was constructed with biodegradable poly-DL-lactide-poly (ethylene-glycol) encapsulating as-mrp rAdV, and its diameter, the encapsulating rate, the virus loads and the releasing kinetics were determined in vitro. Human hepatocellular carcinoma HepG2/ADM cells were transfected with the microspheres, and the fluorescence intensity was assayed after 48 hours and 120 hours. IC50 of adriamycin on drug-resistant cells was determined. The level of MRP mRNA expression was detected by reverse transcription polymerase chain reaction (RT-PCR), and the ratio of MRP mRNA to β-actin mRNA (MRP/β-actin) was calculated. Intracelluar rubidomycin (DNR) concentration was examined by flow cytometry. Wistar rats were implanted with Walker-256 tumor solid piece to establish a liver cancer model. After injected with rAdV, the tumor size, growth rate and the average survival time were determined.
RESULTS: The microsphere, in which as-mrp rAdV was encapusulated, was constructed successfully. Its diameter, the encapsulating rate and the virus loads were 1.765 μm, 52.4% and 5.5×1011efu/g, respectively. Almost 50% of the viruses were released within 120 h, and the total releasing time lasted more than 240 h. The released viruses remained active. More than 90% HepG2/ADM cells could be transfected with 10 mg microspheres. IC50 of adriamycin on HepG2/ADM cells 48 and 120 h after transfection were 9.72 and 4.15 μg, respectively. Intracellular DNR intensity of the cells 120 h after transfection was significantly higher than that 48 h after transfection and the non-transfected cells (168.6±6.97 vs 98.39±6.17, t = 13.68, P < 0.01; 168.6±6.97 vs 112.52±9.21, t = 9.69, P < 0.01). The values of MRP/β-actin 120 and 48 h after transfection were decreased by 16.7% and 63.6% respectively as compared with that before transfection, and the value after 120 h was decreased by 26.25% as compared with that after 48 h. Compared with control group, normal saline group, rAdv group and microsphere without rAdv group, the tumor growth rate was decreased significantly in rAdv microsphere group (0.96±0.25 vs 8.79±0.34, 4.82±0.30, 4.67±0.67, 2.97±0.29; P < 0.05). The mean life time was prolonged significantly (43.6±7.4 vs 23.4±3.2, 25.3±3.7, 26.5±4.1, 33.7±2.9; P < 0.05).
CONCLUSION: The microsphere, in which rAdV carrying antisense MRP was encapusulated, can effectively inhibit MRP expression and improve the sensitivity of drug-resistant cells. This provides an experimental basis for the combination of macromolecular chemistry and gene therapy in the treatment of hepatocellular carcinoma.
- Citation: Yu SH, Yan LN, Zhou SB, Zhang Y, Gou XH, Han L, Chen YB. Construction of microsphere encapusulating recombinant adenovirus with antisense multidrug resistance-associated protein gene and its effect on hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 20-25
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/20.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.20
肝细胞癌(hepatic cellular carcinoma, HCC)是我国常见的恶性肿瘤, 多药耐药(multidrug resistance, MDR)现象导致了肝癌对化疗不敏感. 多药耐药相关蛋白(multidrug resistance-associated protein, MRP)是新近发现的ABC(ATP-binding cassette, ABC)跨膜转运蛋白超家族的成员之一, Mr为190000, 由MRP基因编码, 在多种不同组织来源的耐药细胞系过度表达. 并且在对化疗不敏感的肝癌患者体内及体外培养的肝癌细胞中, 也已检测到MRP基因或蛋白的表达增高[1-5]. 杨家印et al[6-7]应用针对于MRPAUG起始密码子的反义20聚硫代磷酸寡核苷酸, 用脂质体作载体, 24 h后能有效逆转MRPmRNA水平, 但作用时间短.
腺病毒不具有包膜, 直径70-90 nm, 在36 ℃以下病毒较稳定, 在-70 ℃可长期保存; 不但具有体积小、易包被和不易灭活等适于微球载药的优点; 而且具有感染宿主范围较广, 制备容易, 高纯度, 高滴度. 缺点是表达时间相对短暂, 反复应用易导致机体免疫反应. 晚期肝癌95%的血供来自肝动脉, 我们将携带反义MRP基因片断的重组腺病毒微球经肝动脉注射, 缓释病毒至瘤区营养血管, 使基因药物维持在较高水平, 并防止病毒受到免疫排斥, 增强疗效, 减少用药量和给药次数. 将封闭mrp的反义重组AdV与微球控释给药系统相结合, 对肝癌细胞MDR的逆转可起到很好的疗效.
腺病毒载体AdEasy系统由JohnsHopkins肿瘤中心的He博士惠赠. 其中骨架质粒pAdEasy-1(氨苄青霉素抗性)为缺失E1区和E3区的5型野生型腺病毒基因组质粒. 穿梭质粒pAdTrack-CMV(卡那霉素抗性)带有绿色荧光蛋白(green fluorescent protein, GFP)基因. 包载反义MRP基因重组腺病毒由四川大学华西医院普外科陈琳博士构建并经RT-PCR证实, 病毒的滴度为2.5×1012efu/L. RT-PCR试剂盒、MTT试剂盒均购自Life Technologies公司, Wistar 雄性大鼠(成年鼠250-300 g, 断乳鼠50-80 g)由四川大学华西医学实验动物中心提供. Walker-256细胞株由上海医学工业研究院细胞室提供. 聚乳酸-聚乙烯醇由中科院成都有机化学研究所合成, 盐酸阿霉素柔红霉素(DNR)购自意大利法玛西亚普强公司.
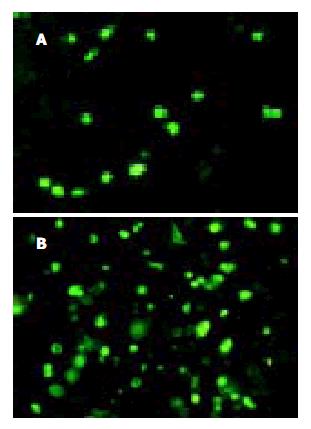
1.2.1 病毒微球的制备: 腺病毒水溶液配制内水相(W1), 20 g/L聚乙烯醇(PVA)水溶液配制外水相(W2), 二氯甲烷溶解聚乳酸-聚乙烯醇(PELA)成200 g/L溶液配制油相(O), 将腺病毒水溶液加至PELA二氯甲烷液中, 搅拌该乳液, 加至含PVA水溶液中, 继续搅拌, 用溶剂抽提法(50 g/L的异丙醇溶液)除去有机溶剂. 离心分离, 洗涤, 冷冻干燥得微球粉末. 将微球在蒸馏水中超生分散30 min后, 用激光粒度衍射仪测定平均粒径(D)、标准偏差(SD)大小及分布曲线. 再用少量水水化, 空气干燥, 用扫描电子显微镜观察微球的表面形态及分散状态. 测定微球包裹后剩余的液体病毒的滴度及上述原始病毒液的滴度, 计算包封率和载病毒率. 包封率 = [(原始的病毒液的病毒滴度×液体量)-(剩余液的病毒滴度×液体量)]/(原始的病毒液的病毒滴度×液体量)×100%载病毒率 = [(原始的病毒液的病毒滴度×液体量)-(剩余液的病毒滴度×液体量)]/微球重量×100%另取微球融于DMEM液中, 37 ℃温育, 搅拌, 离心, 吸出上清液, 更换培养液, 荧光计数法测定病毒的滴度; 0, 24, 48, 72, 96, 120, 144, 168, 192, 216, 240 h病毒释放量, 绘制释放曲线. 设阴性及阳性对照, 将HepG2/ADM肝癌细胞接种, 加入载rAdV微球, 在荧光显微镜下计数感染48 h及120 h后GFP表达阳性的细胞, 同时计数该视野的全部细胞数; 实验时, 每组实验均作4个孔, 计算器平均转染率(%) = GFP表达阳性的细胞数/总细胞数×100%.
1.2.2 体外实验: 了解微球对人肝癌细胞株HepG2/ADM生长曲线的影响, 将HepG2/ADM细胞接种, 培养过夜后用微球10 mg感染细胞, 观察其形态, 连续观察7 d. 同法观察反义RNA重组腺病毒及空白微球感染细胞生长情况. 用1 mg rAdV微球感染HepG2/ADM耐药细胞, 培养48 h, 120 h后加入0.01, 0.1, 1, 10, 100 mg/L阿霉素共同培养4 d后, MTT法测定肿瘤细胞存活率(TCL), 以药物浓度为横轴, 存活率为纵轴绘制浓度效应曲线, 确定半数抑制浓度(IC50). 另设设立空白微球及包载反义MRP重组腺病毒为阴性及阳性对照, 感染肝癌细胞, 同法确定IC50. 根据柔红霉素(DNR)可自发红色荧光的原理, 将转染48 h, 120 h后HepG2/ADM细胞于DNR浓度为10 mg/L的培养基中培养45 min后, 收集细胞, 用流式细胞仪检测细胞内红色荧光强度, 以荧光指数FI代表DNR浓度. FI = 实验组细胞荧光强度/对照组细胞荧光强度. 收集对数生长期细胞, 利用RNA分离试剂盒并按照说明书提取细胞总RNA. 25 μL反应体系: 在0.2 mL离心管中加入dNTP2.5 μmol/L, 10×buffer4 μmol/L, 逆转录酶(AMN)0.5 μmol/L, Mg++5 uL, RNA酶抑制剂0.5 μmol/L, Taq酶0.5 μmol/L, RNA0.5 μmol/L, 10 μmol/L MRP上游引物, 下游引物各1 μmol/L, 总2 μmol/L, β-actin上下游引物各0.4 μmol/L. RT-PCR一步法测定mRNA的表达. MRP引物由TakaRa生物技术工程(大连)有限公司合成. 其序列为: P1: 5'-AAAAAGCTTCGCTCTGGGACTGGAATGTC-3'; P2: 5'-AAAAGATCTAAGTGATGTCACGAAACAGGTC -3', 扩增片段500 bp. β-actin的PCR引物由Life Technologies公司合成, 5'-ACCCCCACTGAAAAAGATGA-3'和5'-ATCTTCAAACCTCCATGATG -3', 扩增片段838 bp. 50 ℃变性30 min; 94 ℃ 2 min; 94 ℃ 10 s; 58 ℃ 35 s; 72 ℃ 25 s; 以上三步骤二十四次循环; 72 ℃ 5 min; 最后4 ℃延伸60 min结束反应. 以β-actin为内参照, PCR扩增产物于15 g/L琼脂糖凝胶60 v电泳20 min, Bio-Rad全自动凝胶图像分析系统扫描定量, MRPmRNA/β-actin比值表示MRP表达水平的高低.
1.2.3 体内实验: 将冻存的Walker-256细胞株复苏, 体外培养至细胞数2-4×109/L, 取1 mL注入断奶后体重80 g左右的♀wistar大鼠腹腔内; 7 d后抽取腹水, 于另1只♂ wistar大鼠前肢sc 0.5 mL; 1 wk后肿瘤长成1 cm3大小, 无菌下取出肿瘤, 取边缘瘤组织切成1 mm3瘤块, 置RPMI1640培养液中备用. 取雄性Wistar大鼠40只, 采用肝内隧道植入法造模. 模型制作后1 wk, 取上腹正中切口进腹, 检查肿瘤生长情况. 于肝门的右侧游离肝动脉, 远肝端结扎, 在手术放大镜下插入外径0.5 mm, 内径0.2 mm导管, 妥善固定后接注射器注药. 分别于造模后7 d再次剖腹, 暴露肝脏, 按动物体重随机分为五组, 按实验要求予不同处理. 组1: 对照组, 仅测肿瘤的最长径及最短径, 开腹与关腹时间与插管时间相当. 组2: 肝动脉结扎并插管注入生理盐水0.5 mL. 组3: 肝动脉结扎并插管注入含1×1012efu/l重组腺病毒液. 组4: 肝动脉结扎并插管注入空白微球, 量相当于组5. 组5: 肝动脉结扎并插管注入含1×1012efu/L重组腺病毒液微球. 每组均为8只. 在大鼠手术后48 h, 接受阿霉素(2 μg/g, 溶于0.2 mL生理盐水中), ip, 2次/wk, 连续2 wk. 阿霉素治疗完后24 h各取4只处死, 处死后剖腹完整切取瘤体, 用游标卡尺测定肿瘤最长径(a)和最短径(b), 以公式V = ab2/2计算肿瘤体积及肿瘤生长率及抑制率. 肿瘤生长率 = 治疗前体积/治疗后体积肿瘤抑制率 = (对照组肿瘤平均体积-治疗组肿瘤平均体积)/对照组肿瘤平均体积计算, 同时送病理检查. 将每组剩余4只荷瘤大鼠在相同条件下饲养, 记录每只动物死亡时间. 荷瘤自然生存时间 = 死亡时间-肿瘤植入时间.
统计学处理 组间比较用t检验, 用SPSS10.0进行分析.
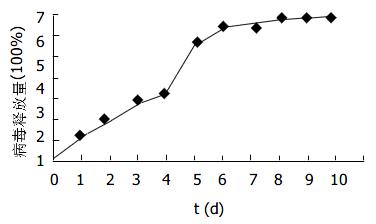
微球平均直径(50%)为1.765 μm, 平均直径(<10%)为1.030 μm, 平均直径为(>90%)3.183 μm, 呈正态分布, 微球间距为1.220um. 呈圆球状, 大小较均匀, 形态较规则, 分散性好, 微球间无明显黏连(图1)包封前病毒的原始滴度 = 2.1×1014efμ/L, 加入病毒液的体积 = 5 mL包封后剩余液体病毒的滴度 = 5×1012 efμ/L, 剩余液的体积 = 500 mL包封时加入聚乳酸-聚乙烯醇重量 = 1000 mg包封率 = 52.4%, 载病毒率 = 5.5×1011/g反义RNA重组腺病毒微球在37 ℃条件下, DMEM培养液中, 在120 h内释放病毒量接近50%, 总的释放时间长于240 h. (图2, 3).
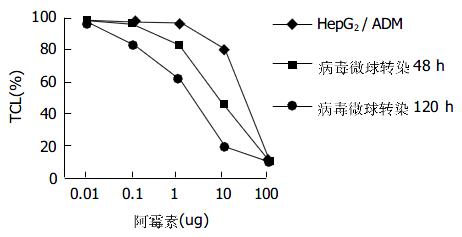
感染HepG2/ADM肝癌细胞48 h后转染率为90%以上. 由图4可见, 以HepG2细胞存活率为对照, 随着ADM诱导浓度的逐步增高, 转染后48及120 h HepG2/ADM的ADM IC50值逐步下降, 与HepG2/ADM组及rAdv组比较P<0.05, 并随时间增加下降更加明显, 转染前及转染后48及120 h ADM IC50值为25.86, 9.72, 4.15 μg. 由表1可见, 以HepG2细胞内DNR的荧光强度为对照, rAdv微球组转染后120 h与HepG2/ADM及rAdv组比较, 细胞内DNR浓度有所升高(168.6±6.97 vs 98.39±6.17; 168.6±6.97 vs 112.52±9.21, P均<0.05). 由图5可见, 诱导后HepG2/ADM MRP高表达, 转染Adv微球后48 h及120 h, MRPmRNA的表达强度较转染前明显降低, 以120 h表达最弱. 转染Adv微球后120 h与48 h相比, MRPmRNA的表达强度明显降低, MRPmRNA/β-actin的比值分别较转染前降低16.7%及63.6%; 转染Adv微球后48 h较转染AdV升高68.75%, 120 h较转染AdV表达降低26.25%.
由表2可见, 治疗前肿瘤的体积及肿瘤的生长率各组间无明显差异(P>0.05). 治疗后治疗组 vs 对照组, 生理盐水组, 空白微球组及rAdv组(n = 4), 肿瘤生长率显著降低(0.96±0.25 vs 8.79±0.34; 2.97±0.29; 4.82±0.30; 4.67±0.67, P = 均<0.05). 平均生存时间显著延长(43.6±7.4 vs 23.4±3.2; 25.3±3.7; 26.5±4.1; 33.7±2.9, P = 均<0.05). rAdV微球组肿瘤组织大片坏死, 肿瘤组织细胞变性坏死严重, 汇管区浸润淋巴加微球组动物肝血窦内有微球存在, 其余脏器未见异常. (细胞多, 部分胆管壁破坏. rAdV组肿瘤组织中等程度坏死, 其他组轻度坏死. rAdV)
耐药是HCC治疗中的一大棘手的问题. 多药耐药相关蛋白(MRP)基因及其编码的P190蛋白与HCC的MDR有关. 目前, 国内外已有人利用重组腺病毒为载体, 将MRP反义RNA导入人肝癌细胞可有效逆转耐药的表型[8], 但作用时间较短. 缺乏安全而有效的载体是基因治疗中急需解决的问题. 国外学者报道腺病毒微球可减少病毒载体的免疫原性, 并通过调节微球的大小控制病毒的释放速度, 起到缓释的作用, 并不降低病毒活性, 应用于包被基因载体及疫苗, 取得较好效果[9-16]. 聚乳酸-聚乙烯醇共聚物(PELA)是一种高分子可降解材料, 由疏水性聚乳酸(PLA)与亲水性聚乙烯醇(PEG)聚合而成, 具有亲水、无毒、无免疫原性, 高包封率, 能提高包封物稳定性及可调节性等优点, 已有人将其应用于包裹白蛋白, DNA, 疫苗等方面, 取得良好的效果[17-21]. 用改良溶剂挥发法双乳液(W1/O/W2)体系制备微球, 不必长时间搅拌挥发有机溶剂, 病毒活性影响较小, 其包封产率可达52.4%, 10 d的累积释放百分率约为70%. 我们制得的微球粒径在1-3 μm之间的占90%, 平均粒径为1.765 μm, 分散性较好, 载病毒量较大, 120 h时较大比例的释放, 并且病毒释放出来后具有高度活性, 使体内有较高的治疗浓度, 然后在后续的时间则以较慢的速度释放, 总的释放时间长于240 h, 用于逆转肝癌耐药细胞多药耐药现象研究. 病毒微球转染后48和120 h时HepG2/ADM的阿霉素半数致死量(IC50)比转染前明显降低. 病毒微球转染后, 随着转染时间延长, IC50下降的程度越大. 在MRP介导的多药耐药中, 细胞内药物浓度的变化是主要因素[22]. 柔红霉素(DNR)是一种抗肿瘤抗生素, 可抑制肿瘤细胞DNA和RNA的合成. 另外, DNR也是MRP的蛋白产物P190比较特异的作用底物[23], 并且能自发荧光, 通过通过流式细胞技术对细胞内DNR浓度的检测, 可间接了解MRP表达情况. 随着耐药细胞MRP表达的增高, 细胞内DNR浓度下降, 但DNR浓度部分升高. 对病毒微球转染前后epG2/ADM检测MRPmRNA水平, 采用了β-actin为表达内对照, 结果表明, 病毒微球转染后48和120 h时HepG2/ADMMRP明显下降(P<0.05). 说明体外转染病毒微球后可有效逆转肝癌耐药细胞株. 经肝动脉注射PELA微球, 主要停留在肝血窦, 释放反义MRP基因病毒, 有效缩小肿瘤体积, 延长基因治疗作用时间, 达到基因治疗的效果, 又可使治疗基因靶向性到达肿瘤组织. 基因治疗和靶向治疗共同作用, 大量杀死肿瘤组织, 延长了动物的生存期.
编辑: 潘伯荣 审读: 张海宁
| 1. | 戴 越盟, 林 琦远, 严 律南, 林 萍, 智 星, 雷 松, 屈 艺. 多药耐药相关蛋白在阿霉素诱导人肝癌细胞SMMC-7721耐药性产生中的作用及机制. 中国普外基础与临床杂志. 2001;8:8-11. |
| 2. | Yang JY, Luo HY, Lin QY, Liu ZM, Yan LN, Lin P, Zhang J, Lei S. Subcellular daunorubicin distribution and its relation to multidrug resistance phenotype in drug-resistant cell line SMMC-7721/R. World J Gastroenterol. 2002;8:644-649. [PubMed] |
| 3. | Wang BL, Chen XP, Zhai SP. Expression and implication of multidrug resistance associated -protein gene in primary hepatocellular carcinoma. Zhonghua Ganzangbing Zazhi. 2003;11:609-611. [PubMed] |
| 4. | Zhai BJ, Wu F, Shao ZY, Hu K, Wang ZB. Establishment of human multidrug-resistant hepatocellular carcinoma cell line (HepG2/Adm) and biological characteristics evaluation. Ai Zheng. 2004;23:391-395. [PubMed] |
| 5. | Wang BL, Chen XP, Zhai SP, Chen DF. Clinical significance of mrp gene in primary hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2003;2:397-403. [PubMed] |
| 6. | 杨 家印, 罗 华友, 林 琦远, 严 律南, 林 萍, 雷 松, 黄 代新, 赵 永恒. 反义寡核苷酸降低细胞株SMMC-7721/ADM之MRP基因表达的研究. 中国普外基础与临床杂志. 2001;8:141-144. |
| 7. | Luo HY, Yang JY, Liu ZM, Lin QY, Yan LN. Reversal of multidrug resistance gene MDR1 and MRP of drug-resistant human hepatocellular carcinoma cells SMMC-7721/ADM with antisense phosphorothioate oligonucleotides. Zhonghua Ganzangbing Zazhi. 2004;12:85-87. [PubMed] |
| 8. | 陈 琳, 苟 兴华, 严 律南, 赵 永恒, 韩 蕾, 李 德华, 胡 海洋, 赵 兰英. 携带反义多药耐药相关蛋白的重组腺病毒的构建及其应用的初步研究. 中国普外基础与临床杂志. 2003;10:117-120. |
| 9. | Kalyanasundaram S, Feinstein S, Nicholson JP, Leong KW, Garver RI. Coacervate microspheres as carriers of recombinant adenoviruses. Cancer Gene Ther. 1999;6:107-112. [PubMed] |
| 10. | Steel JC, Cavanagh HM, Burton MA, Kalle WH. Microsphere-liposome complexes protect adenoviral vectors from neutralising antibody without losses in transfection efficiency, in-vitro. J Pharm Pharmacol. 2004;56:1371-1378. [PubMed] |
| 11. | García del Barrio G, Hendry J, Renedo MJ, Irache JM, Novo FJ. In vivo sustained release of adenoviral vectors from poly(D,L-lactic-co-glycolic) acid microparticles prepared by TROMS. J Control Release. 2004;94:229-235. [PubMed] |
| 12. | Sailaja G, HogenEsch H, North A, Hays J, Mittal SK. Encapsulation of recombinant adenovirus into alginate microspheres circumvents vector-specific immune response. Gene Ther. 2002;9:1722-1729. [PubMed] |
| 13. | Schalch P, Rahman GF, Patejunas G, Goldschmidt RA, Carbray J, Retuerto MA, Kim D, Esser K, Crystal RG, Rosengart TK. Adenoviral-mediated transfer of vascular endothelial growth factor 121 cDNA enhances myocardial perfusion and exercise performance in the nonischemic state. J Thorac Cardiovasc Surg. 2004;127:535-540. [PubMed] |
| 14. | Bhatt UY, Sferra TJ, Johnson A, Williams C, Shirey K, Venema T, Nuovo GJ, Nahman NS. Glomerular beta-galactosidase expression following transduction with microsphere-adenoviral complexes. Kidney Int. 2002;61:S68-S72. [PubMed] |
| 15. | Nahman NS, Sferra TJ, Kronenberger J, Urban KE, Troike AE, Johnson A, Holycross BJ, Nuovo GJ, Sedmak DD. Microsphere-adenoviral complexes target and transduce the glomerulus in vivo. Kidney Int. 2000;58:1500-1510. [PubMed] |
| 16. | Mittal SK, Aggarwal N, Sailaja G, van Olphen A, HogenEsch H, North A, Hays J, Moffatt S. Immunization with DNA, adenovirus or both in biodegradable alginate microspheres: effect of route of inoculation on immune response. Vaccine. 2000;19:253-263. [PubMed] |
| 17. | Deng XM, Xiong CD, Cheng LM. Studies on the copolymerization of D, L-lactide and poly(ethylene glycol) with alminnum complex catalyst. J Appl Poly Sci. 1995;55:1193-1196. |
| 18. | Deng XM, Zhou SB, Li XH, Zhao J, Yuan ML. In vitro degradation and release profiles for poly-D, L- lactide - poly (ethylene glycol) microspheres containing human serum albumin. J Control Release. 2001;71:165-173. |
| 19. | Li XH, Zhang YH, Yuan RH, Deng XM. Influence of process parameters on the protein stability encapsulated in poly-dl-lactide-poly(ethylene glycol) microspheres. J Control Release. 2000;68:41-52. |
| 20. | Zhou SB, Deng XM, Li XH. Investigation on a novel core-coated microspheres protein delivery system. J Control Release. 2001;75:27-36. |
| 21. | Zhou SB, Deng XM, Yang H. Biodegradable poly(-caprolactone)- poly(ethylene glycol) block copolymers: characterization and their use as drug carriers for a controlled delivery system. Biomatterials. 2003;24:3563-3570. |
| 22. | Wang F, Jiang X, Yang DC, Elliott RL, Head JF. Doxorubicin-gallium-transferrin conjugate overcomes multidrug resistance: evidence for drug accumulation in the nucleus of drug resistant MCF-7/ADR cells. Anticancer Res. 2000;20:799-808. |
| 23. | Paul S, Belinsky MG, Shen H, Kruh GD. ATP-dependent transport of lipophilic cytotoxic drugs by membrane vesicles prepared from MRP-overexpressing HL60/ADR cells. Biochemistry. 1996;35:14003-14011. |