修回日期: 2004-10-25
接受日期: 2004-11-04
在线出版日期: 2005-01-01
目的: 探讨江苏汉族人群肿瘤坏死因子β(tumor necrosis factor β, TNFβ) 1069位点等位基因多态性与胃癌的关系.
方法: 采用聚合酶链反应-限制性片段长度多态性方法对168名健康人和45例胃癌患者TNFβ基因的单碱基突变多态性进行了分析.
结果: 胃癌患者的TNFβ*1/2等位基因频率(66.7%) 较正常人(47.0%) 明显升高(P = 0.019<0.05).
结论: TNFβ*1/2等位基因频率与胃癌易患性相关.
引文著录: 李立人, 鞠少卿. 肿瘤坏死因子β1069位点基因多态性与胃癌易感性的相关性研究. 世界华人消化杂志 2005; 13(1): 115-117
Revised: October 25, 2004
Accepted: November 4, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 115-117
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/115.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.115
胃癌是我国发病率最高的恶性肿瘤, 其发生与外界各种不良因素持续作用以及个体遗传易感性有关. 最近, 人们逐渐意识到不同个体易感性的不同在胃癌发病机制中的重要性. 人群中存在易感个体是由于一些与肿瘤发生相关的基因存在多态性. 随着限制性内切酶、Southern杂交技术以及克隆测序技术的完善, 目前研究较深入的基因多态性主要为单核苷酸多态、微卫星DNA多态、AluI序列多态. 自从1985年Krontiris et al报道了检测ras癌基因多态性可用于估计肿瘤发生的危险性后, 国内外学者在多个层面研究了基因多态性与胃癌发生的相关性, 阐明了基因型与表型之间的联系.
虽然胃癌的发病机制至今还在争论, 但大量的证据认为细胞因子如白介素在胃癌的过程中发挥着重要的作用[1]. 肿瘤坏死因子β(tumor necrosis factor-beta, TNFβ)是体内具有多种生物活性的细胞因子, 具有抗肿瘤、抗病毒感染的作用及诱发炎症反应以及刺激某些正常细胞的生长. 编码TNFβ的基因位于HLA-B以及HLA-C2位点之间的HLA-Ⅲ抗原基因族内, 包含若干个多态性位点. 近年来研究显示TNFβ基因多态性主要有5种, Shimura et al[2]报道第1内含子内, 转录起始位点下游第252位点(+252位点, 也就是TNFβ基因第1069位点)处鸟嘌呤(G)→腺嘌呤(A)碱基变化与胃癌预后有关, 发现携带TNFβ10.5 kb纯合子基因型的胃腺癌患者预后较好, TNFβ基因1069处位点为G称为TNFβ*1, 具有NcoⅠ限制性内切酶的识别位点, 1069位为A的基因称为TNFβ*2, 无NcoⅠ限制性内切酶的识别位点, TNFβ基因G-A突变可调节TNFβ转录水平[3], 与TNF水平特征性增高有密切关系[4]. TNFβ基因多态性是否与人类自身免疫性疾病、感染、肿瘤等许多疾病相关联, 国外学者进行了探讨[5-6], 但结论不完全相同. 我们采用聚合酶链反应-限制性片段长度多态性(polymerase chain reaction-restriction fragment length polymorphism, PCR-RFLP)方法探讨江苏地区汉族人群肿瘤坏死因子β(TNFβ)等位基因多态性与胃癌的相关性.
1.1.1 对象: (1)患者组: 45例胃癌患者(高中分化型14例, 低分化型31例), 其中女性30例, 男性15例, 年龄38-72岁, 平均年龄(56.6±9.2)岁, 均经病理证实胃癌, 临床排除自身免疫病、感染性疾病、其他恶性肿瘤; (2)正常对照组: 168名年龄、性别与胃癌患者组大致匹配的健康体检者及献血员, 其中男性102名, 女性66名, 年龄36-70岁, 平均年龄(54.2±9.7)岁. 以上患者及正常对照组人群均系江苏地区、无血缘关系、三代亲属均为汉族.
1.1.2 仪器和试剂: Gene Amp 9600型PCR扩增仪(美国PE公司), 2360K离心机(德国Hermle公司), SX-100型凝胶自动成像系统(上海生物技术公司); Taq DNA聚合酶(上海华美公司), 限制性内切酶NcoI (Promega公司), dNTP(Pharmacia公司), DNA分子量标准(pUC19 DNA/Msp I)(MBI公司产品).
1.2.1 基因组DNA抽提: 从3 mL 10%EDTA-Na2抗凝外周血中提取有核细胞, 用蛋白酶K隔夜消化, 然后用酚-氯仿法抽取基因组DNA, 调DNA浓度至50 mg/L, -20 ℃保存备用.
1.2.2 引物及合成: 自行设计引物序列, 由上海生工生物工程有限公司合成及纯化. 上、下游引物分别为: TNFβA 5'-CCGTGCTTCGTGCTTTGGACTA-3; TNFβB 5'-A GACGTTCA GGTGGTGTCA T-3', 对应产物为TNFβ基因第1、2外显子间427 bp的基因片段. 每个PCR扩增体系为50 μL. 其中包括基因组DNA 250 ng, 1×PCR缓冲液(50 mmol/L KCl, 10 mmol/L的Tris-Cl, pH 9.0, 1.0%Triton X-100, 1.5 mmol/L MgCl2, 200 μmol/L dNTPs, 引物各0.2 μmol/L, 2U Taq DNA聚合酶. 扩增条件: 95 ℃预变性10 min, 94 ℃ 1 min、64 ℃ 1 min, 72 ℃ 1 min, 共35个循环, 继后72 ℃延伸5 min.
1.2.3 产物鉴定及分析: 任意抽取10份产物(各12.0 μL) 加0.85 μL双蒸水、1.5 μL 10×缓冲液、0.15 μL 100×乙酰化牛血清白蛋白(BSA) 以及0.5 μL NcoI内切酶(10 U/μL), 37 ℃水浴4 h, 30 g/L溴化乙锭琼脂糖电泳, 通过观察条带的情况(有可能酶切不够或过酶切) 确定一份TNF G/G纯合子的模板DNA, 取4管PCR反应管, 各加入5.0 μL纯合子的模板DNA, 扩增结束后合并4管产物, 吸取50.0 μL产物加29.2 μL双蒸水、8 μL 10×缓冲液、0.8 μL 100×BSA以及0.5 μL NcoI内切酶, 混匀后再将其重新分成5管, 37 ℃分别水浴1, 2, 4, 6, 8, 12 h, 65 ℃ 20 min灭活, 30 g/L溴化乙锭琼脂糖电泳, 通过观察条带的情况确定最佳的酶切时间(结果4 h为最佳). 取消化后的产物经30 g/L琼脂糖凝胶(含溴化乙锭0.5 mg/L) 电泳, 约1 h后, 在紫外线灯下观察、记录结果, 并在凝胶自动成像系统进行成像.
统计学处理 TNFβ基因频率及基因型频率用直接计数法, 采用χ2检验进行Hardy-Weinberg平衡吻合度检验, 组间比较χ2检验. 不同人种TNFβ基因频率的构成比用χ2检验进行比较, 所有数据统计由STATA 6.0统计软件包完成.
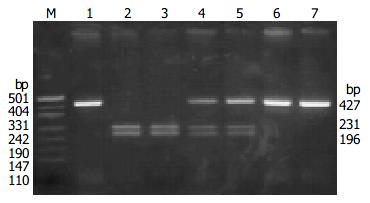
用3', 5'TNFβ引物行PCR扩增反应可获得第1外显子到第2外显子长度为427 bp的一段基因片断扩增产物, 经限制性内切酶NcoI作用后(酶切位点位于1064与1065之间), 根据基因不同, 产生3种酶切结果: (1) TNFβ*1/1纯合子, 扩增的基因片段, 含有NcoI酶切位点, 可被完全酶切为231 bp、196 bp2条带; (2)TNFβ*1/2杂合子, 产生不完全酶切, 出现427 bp、231 bp、196 bp 3条带; (3)TNFβ*2/2纯合子, 其PCR产物经NcoI消化, 则电泳后只出现427 bp 1条带, 其酶切结果(图1).
患者组与正常对照组TNFβ等位基因频率及基因表型的分布(表1), 应用Hardy-Weinberg定律进行检验, 两个群体都达到了遗传平衡(P>0.05). 胃癌患者TNFβ*1/2等位基因频率显著高于正常人群(P = 0.019), 提示TNFβ*1/2等位基因与胃癌的发病有关.
Kim et al[7]曾报道TNFβ两个等位基因之间不仅存在着结构上、还存在着功能上的差异. 体外用植物血凝素刺激韩国人外周血单核细胞, 得出TNFB*1纯合子产生TNFβ的水平高于TNFβ*2纯合子的结论. 我们研究结果显示胃癌患者中TNFβ*1/2基因型频率显著高于正常人群, 提示TNFβ*1/2基因型与胃癌的发病相关, 据Lee et al的实验结果推测, 胃癌的发病可能通过调节TNF的分泌而参与. 至于TNFβ*1/2基因型有无可能增加胃癌患者幽门螺杆菌的感染率, TNFβ*1/2等位基因是否可以作为江苏地区汉族人群胃癌的发病易感基因的一个标记, 还需进一步深入研究.
应当指出, TNFβ位于MHCⅢ抗原基因簇内, 与MHCⅠ类及Ⅱ类抗原基因相邻, TNFβ基因与HLA的某些单倍体有连锁不平衡, 而MHC复合体具有高度多态性. 虽然TNFβ*1/2基因频率在胃癌中升高, 但不能将其作为是疾病的一个遗传标记. HLA其他基因的基因多态性可影响TNFβ活性, 因此TNFβ基因多态性在HLA相关疾病中的地位还不明确, TNFβ基因多态性在这些疾病的发生、发展中是起主要作用, 还是辅助作用, 或是其他因素协同作用, 或者只是其他主要因素的标志, 这些都还不明确. 此外到目前为止, 人们只研究了TNFβ基因多态性对TNF产量的影响, TNFβ基因多态性对TNFβ的活性的影响还没有研究, TNFβ基因多态性是否导致机体产生异常活性的TNFβ, 进而影响了疾病的病程, 都有待于进一步讨论和研究.
编辑: 张海宁
| 1. | Akira S. Signal pathways in immune systems: IL-1 R/Toll-like receptor family. Nihon Rinsho Meneki Gakkai Kaishi. 2000;23:505-510. [PubMed] |
| 2. | Shimura T, Hagihara M, Takebe K, Munkhbat B, Ogoshi K, Mitomi T, Nagamachi Y, Tsuji K. 10.5-kb homozygote of tumor necrosis factor-beta gene is associated with a better prognosis in gastric cancer patients. Cancer. 1995;75:1450-1453. [PubMed] |
| 3. | Kroeger KM, Carville KS, Abraham LJ. The -308 tumor necrosis factor-alpha promoter polymorphism effects transcription. Mol Immunol. 1997;34:391-399. [PubMed] |
| 4. | Pociot F, Briant L, Jongeneel CV, Mölvig J, Worsaae H, Abbal M, Thomsen M, Nerup J, Cambon-Thomsen A. Association of tumor necrosis factor (TNF) and class II major histocompatibility complex alleles with the secretion of TNF-alpha and TNF-beta by human mononuclear cells: a possible link to insulin-dependent diabetes mellitus. Eur J Immunol. 1993;23:224-231. [PubMed] |
| 5. | Yamaguchi E, Itoh A, Hizawa N, Kawakami Y. The gene polymorphism of tumor necrosis factor-beta, but not that of tumor necrosis factor-alpha, is associated with the prognosis of sarcoidosis. Chest. 2001;119:753-761. [PubMed] |
| 6. | Majetschak M, Flohé S, Obertacke U, Schröder J, Staubach K, Nast-Kolb D, Schade FU, Stüber F. Relation of a TNF gene polymorphism to severe sepsis in trauma patients. Ann Surg. 1999;230:207-214. [PubMed] |
| 7. | Kim TG, Kim HY, Lee SH, Cho CS, Park SH, Choi HB, Han H, Kim DJ. Systemic lupus erythematosus with nephritis is strongly associated with the TNFB*2 homozygote in the Korean population. Hum Immunol. 1996;46:10-17. [PubMed] |