修回日期: 2004-11-15
接受日期: 2004-11-25
在线出版日期: 2005-01-01
目的: 研究大肠癌及其癌旁正常组织中COX-2、hMLH1、hMSH2的表达情况及其与临床病理参数的关系, 并探讨其相关性.
方法: 应用COX-2、hMLH1、hMSH2多克隆抗体, 采用免疫组化方法(SP法)检测78例大肠癌手术切除标本及其癌旁正常组织中COX-2、hMLH1、hMSH2蛋白的表达情况.
结果: 在采用免疫组化方法所检测的78例大肠癌及其癌旁正常组织中, COX-2的阳性表达率分别为74.36%(58/78)、0%, hMLH1的阴性表达率分别为29.49%(23/78)、0%, hMSH2的阴性表达率为28.21%(22/78)、0%.
结论: 在大肠癌中, COX-2蛋白表达与hMLH1、hMSH2蛋白的表达缺乏有相反关系, 即COX-2蛋白表达阴性的病例中, 大多存在hMLH1或hMSH2蛋白表达缺乏, 错配修复酶缺乏主要发生在COX-2蛋白表达阴性的病例中. 说明二者可能通过不同的途径参与了结肠癌的发生和发展.
引文著录: 宋伟庆, 韩彩丽, 周保军, 张轶华, 陈怡, 刘玉, 韦金英. COX-2与hMLH1、hMSH2在大肠癌中表达的相关性研究. 世界华人消化杂志 2005; 13(1): 105-109
Revised: November 15, 2004
Accepted: November 25, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 105-109
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/105.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.105
环氧化酶(cyclooxygenase, COX)是前列腺素(Prostaglandin, PG)合成过程中的限速酶. COX有两种同工酶: COX-1, COX-2. COX-1维持正常的生理功能. COX-2被认为是"快速反应"基因, 主要参与多种病理生理过程, 如炎症及肿瘤的发生发展等. hMLH1、hMSH2是两种错配修复酶, 且均是遗传易感基因, 具有修复DNA碱基错配、增强DNA复制的忠实性、维持基因组稳定及降低自发性突变的功能. 实验表明在多种肿瘤中普遍存在错配修复酶hMLH1、hMSH2的缺乏, 从而导致微卫星不稳定性, 最终导致肿瘤的发生[1-2]. 关于COX-2、hMLH1、hMSH2与肿瘤的关系虽有报道, 但COX-2与hMLH1、hMSH2在肿瘤中表达的相关性研究于国内外尚未见有报道. 我们采用免疫组化SP法探讨COX-2与hMLH1、hMSH2在大肠癌组织中的相关性, 以期为大肠癌的早期诊断、治疗和判断预后提供实验依据.
收集河北医科大学附属第二医院外科2000-01/2002-12大肠癌手术切除的大肠癌组织和癌旁正常组织标本各78例, 其中男46例, 女32例, 年龄28-70岁, 平均年龄49岁. 组织学类型如下: 腺癌58例, 黏液腺癌13例, 印戒细胞癌7例. 于78例大肠癌病例中, 38例有淋巴结转移, 侵透浆膜者62例, 高中分化54例, 低未分化24例, A和B期42例, C和D期36例. 术前均未接受任何抗肿瘤治疗. 所有标本取材后立即用40 g/L甲醛固定, 梯度脱水, 透明, 浸蜡, 包埋, 4 μm连续切片, 分别进行HE染色和免疫组化(SP法)染色.
免疫组化染色: (1)实验试剂与配制: hMLH1、hMSH2多克隆抗体购自武汉博士德生物工程有限公司. COX-2多克隆抗体购自Santa Cruz Biotechnology, Inc. SP9001免疫组化试剂盒、DAB显色试剂盒均购自北京中山生物技术有限公司. hMLH1、hMSH2、COX-2一抗的稀释度分别为1/80、1/80、1/50, 微波抗原修复. (2)实验方法: 采用SP法, 进行hMLH1、hMSH2、COX-2检测, 每批染色均设阳性对照(即加入相应抗体确定必然有阳性结果)和阴性对照(用PBS代替一抗). (3)结果判定: a. COX-2: 当胞质或胞核出现棕黄色颗粒时判为COX-2阳性细胞; b. hMLH1、hMSH2: 当胞质或胞核染为棕色者判为阳性细胞, 蓝染者为阴性细胞.
阳性结果判定标准: 每张切片随机选择5个以上高倍视野, 计数不少于500个细胞, 取均数并评分. 根据染色程度及染色细胞百分率进行分析评定: 基本不着色为0分, 着色淡为1分, 着色较深为2分; 着色细胞占计数细胞百分率:≤5%为0分, 6-25%为1分, 26-50%为2分, ≥51%为3分, 将每张切片染色程度与染色细胞百分率得分相乘的积为其最后得分. 0-1分阴性(-), >2分阳性(+).
统计学处理 用SAS软件对结果进行相关性处理. 用R×C表的χ2法分别分析hMLH1与COX-2、hMSH2与COX-2的相关性; 分别检验COX-2、hMLH1、hMSH2与性别、淋巴结转移、组织学类型、分化程度、Dukes分期以及是否侵及浆膜的关联性.
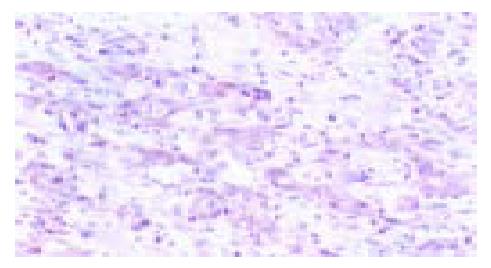
2.1.1 COX-2的表达情况(图1): COX-2在78例正常组织中的阳性表达率为0%, 在癌组织中的阳性表达率为74.36%(58/78); 大肠癌组织与正常组织比较COX-2蛋白的表达有统计学意义.
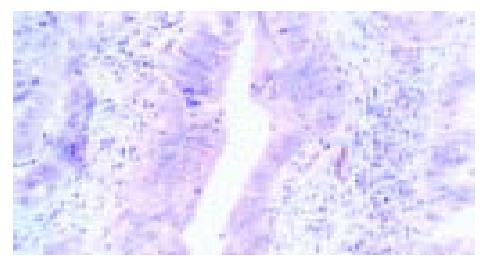
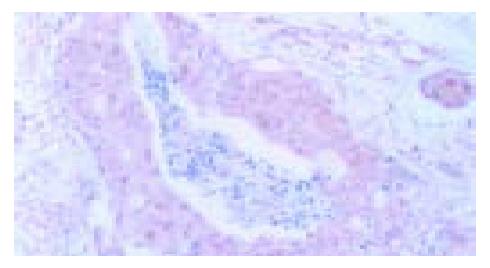
2.1.2 hMLH1、hMSH2的表达情况(图2, 3): hMLH1、hMSH2在78例正常组织中的阴性表达率均为0%; 在癌组织中hMLH1的阴性表达率为29.49%(23/78), hMSH2的阴性表达率为28.21%(22/78); 大肠癌组织与正常组织比较hMLH1、hMSH2蛋白的表达均有统计学意义.
2.1.3 R×C表的χ2法分析: 由表1, 2可见, COX-2蛋白表达水平与hMLH1、hMSH2蛋白阴性表达之间均存在相反关系.
| 组别 | 阴性数 | 阳性数 | 合计 |
| COX-2 | 10 | 13 | 23 |
| hMLH1 | 11 | 44 | 55 |
| 合计 | 21 | 57 | 78 |
| 组别 | 阴性数 | 阳性数 | 合计 |
| COX-2 | 11 | 11 | 22 |
| hMSH2 | 10 | 46 | 56 |
| 合计 | 21 | 57 | 78 |
| 临床病理特征 | n | 阳性 | COX-2阳性率(%) | P值 | |
| 性别 | 男 | 46 | 33 | 71.74 | >0.05 |
| 女 | 32 | 24 | 75.00 | ||
| 淋巴结转移 | 有 | 38 | 30 | 78.95 | <0.05 |
| 无 | 40 | 27 | 67.50 | ||
| 组织学类型 | 腺癌 | 58 | 42 | 72.41 | >0.0 5 |
| 黏液腺癌 | 13 | 9 | 69.23 | ||
| 印戒细胞癌 | 7 | 6 | 85.71 | ||
| 是否侵透浆膜 | 是 | 62 | 46 | 74.19 | >0.05 |
| 否 | 16 | 11 | 68.75 | ||
| 分化程度 | 高中分化 | 54 | 39 | 72.22 | <0.05 |
| 低未分化 | 24 | 18 | 75.00 | ||
| Dukes分期 | A期 | 12 | 7 | 58.33 | <0.05 |
| B期 | 30 | 19 | 63.33 | ||
| C期 | 27 | 19 | 70.37 | ||
| D期 | 9 | 6 | 66.67 |
| 临床病理特征 | n | 阴性 | hMLH1阴性率(%) | P值 | |
| 性别 | 男 | 46 | 11 | 23.91 | >0.05 |
| 女 | 32 | 12 | 34.29 | ||
| 淋巴结转移 | 有 | 38 | 13 | 34.21 | >0.05 |
| 无 | 40 | 10 | 25.00 | ||
| 组织学类型 | 腺癌 | 58 | 12 | 20.69 | <0.05 |
| 黏液腺癌 | 13 | 7 | 53.85 | ||
| 印戒细胞癌 | 7 | 4 | 57.14 | ||
| 是否侵透浆膜 | 是 | 62 | 18 | 29.03 | >0.05 |
| 否 | 16 | 5 | 31.25 | ||
| 分化程度 | 高中分化 | 54 | 15 | 29.63 | >0.05 |
| 低未分化 | 24 | 8 | 33.33 | ||
| Dukes分期 | A期 | 12 | 3 | 25.00 | >0.05 |
| B期 | 30 | 8 | 26.67 | ||
| C期 | 27 | 11 | 40.74 | ||
| D期 | 9 | 1 | 11.11 |
| 临床病理特征 | n | 阴性 | hMLH2阴性率(%) | P值 | |
| 性别 | 男 | 46 | 10 | 21.74 | >0.05 |
| 女 | 32 | 12 | 37.50 | ||
| 淋巴结转移 | 有 | 38 | 9 | 20.51 | >0.05 |
| 无 | 40 | 13 | 32.50 | ||
| 组织学类型 | 腺癌 | 58 | 13 | 22.41 | >0.05 |
| 黏液腺癌 | 13 | 6 | 46.15 | ||
| 印戒细胞癌 | 7 | 3 | 42.86 | ||
| 是否侵透浆膜 | 是 | 62 | 16 | 25.81 | >0.05 |
| 否 | 16 | 6 | 37.50 | ||
| 分化程度 | 高中分化 | 54 | 12 | 22.22 | >0.05 |
| 低未分化 | 24 | 10 | 41.67 | ||
| Dukes分期 | A期 | 12 | 5 | 41.67 | >0.05 |
| B期 | 30 | 7 | 23.33 | ||
| C期 | 27 | 7 | 25.93 | ||
| D期 | 9 | 3 | 33.33 |
2.2.1 COX-2的阳性表达与性别、组织学类型以及有无侵透浆膜无关: P值分别为0.431、0.383、0.672. COX-2的表达水平与淋巴结转移之间有统计学意义, P = 0.001; 用Spearman法进一步检验, rs = 0.85493, P = 0.0001, COX-2的表达水平与有无淋巴结转移呈完全正相关.
2.2.2 hMLH1与性别、淋巴结转移、及是否穿透浆膜均无关联: P值分别为0.431、0.531、0.909. hMLH1与组织学类型之间有统计学意义, P = 0.02(Fisher's确切概率), 在腺癌中hMLH1阳性表达所占比例最高, 黏液腺癌中最低, 统计学差异显著, P<0.05.
2.2.3 hMSH2与性别、淋巴结转移、组织学类型及是否穿透浆膜均无关联: P值分别为0.063、0.490、0.451 (Fisher's确切概率)、0.594.
COX-2主要参与多种病理生理过程, 如炎症及肿瘤的发生、发展. 人类多种恶性肿瘤COX-2阳性表达率较高[3-4]. 本研究结果表明, COX-2在正常组织中为阴性表达, 而在大肠癌中为阳性表达, 提示其在大肠癌的发生发展过程中可能起很重要的促进作用. 近年研究发现COX-2高表达在癌前病变和原位癌即已存在, 提示其高表达可能是癌症发生的早期事件. 在研究人类散发性结直肠腺瘤的实验中发现, COX-2mRNA水平多要高于正常黏膜, 而且随着腺瘤体积的增大, COX-2表达也增高. 这个结果提示COX-2在散发性结直肠腺瘤的发病过程中起着促进肿瘤生长的重要作用[5-6].
Akhtar et al[7]研究发现胃癌上皮细胞中COX-2蛋白表达阳性, COX-2的启动子去甲基化; 而不表达COX-2的胃上皮细胞, COX-2的启动子呈甲基化状态. 提示胃癌组织COX-2蛋白过表达可能是COX-2启动子区域的去甲基化引起, COX-2启动子区域的去甲基化参与了COX-2转录水平的调控.
本实验结果显示COX-2的表达强度与性别、组织学类型以及有无侵透浆膜无关, 与有无淋巴结转移、临床分期呈完全正相关. 研究显示[8], COX-2蛋白表达水平与患者组织学类型和癌组织的浸润深度均无显著性差异, 有淋巴结转移者显著高于无淋巴结转移者, 且在中晚期胃癌中的水平明显高于早期胃癌中的水平. 提示COX-2蛋白表达与结肠癌的发生、发展和转移相关, 因此COX-2有可能作为推测结肠癌转移潜能、临床分期的敏感指标之一. 同时, 本研究中大肠癌组织中高中分化组与低未分化组有显著性差异, Saukkonen et al[9]报道, 高分化胃癌细胞系(MKN-45、MKN-47)与低分化胃癌(HSC-29、KATO-Ⅲ)相比, COX-2mRNA、蛋白水平及酶活性均较高. 因此COX-2表达与结肠癌分化程度关系的意义有待进一步的研究.
DNA的修复有两大类, 一是切除修复(Excision repair), 二是错配修复(Mismatch repair, MMR). 错配修复需要相应的酶参与, 目前人类的错配修复基因系统(Mismatch repair gene, MMR)含有9个错配修复基因, 其中以hMLH1、hMSH2功能最重要. 研究发现[10]MMR基因的突变, 尤其是hMLH1、hMSH2基因的突变是造成遗传性非息肉性结直肠癌(Hereditary nonpolyposis colorectal carcinoma, HNPCC)发生的主要原因. MMR基因发生突变导致DNA错配修复系统功能缺陷或丧失是HNPCC肿瘤发生的前提条件. 本研究结果表明, hMLH1的阴性表达率为29.49%(23/78); hMSH2的阴性表达率为28.21%(22/78), 而Taiji et al报道, 结肠癌组织中hMLH1、hMSH2的核染色缺乏率分别为57.3%、18.3%[11]. 就染色的阴性率而言, 二者结果略有不同, 这可能与所选择的病例类别和组织学类型不同有关. 本研究目前只得到阴性率, 未检测其突变率. 本实验结果表明, hMLH1、hMSH2在胞核和胞质均着色, 而Taiji的研究结果结果显示两种错配修复酶的显色部位仅定位于核, 二者部位不尽相同可能与本实验使用的是多克隆抗体有关.
我们实验显示, hMLH1、hMSH2与性别、淋巴结转移、组织学类型及是否穿透浆膜均无关联, 仅hMLH1与组织学类型有关, 在腺癌中hMLH1阳性表达所占比例最高, 黏液腺癌中最低, 有统计学意义. 研究显示[12], hMLH1或hMSH2蛋白失表达与患者肿瘤部位、组织学类型密切相关. 近端结肠、低-未分化腺癌及黏液腺癌中MMR异常表达比例高(P<0.05), 而与患者年龄、性别、肿瘤大体类型、肿块大小、浸润深度、淋巴结转移与否以及患者的Dukes分期均无显著性相关(P>0.05), 与本实验结果相一致, 其意义有待进一步研究.
目前研究还发现, 结直肠癌的发生可能有2种途径: 一种是染色体不稳定性, 而另一种就是MSI(microsatellite instability). 从而可以将结直肠癌分为2类: 即存在错配修复缺陷和不存在错配修复缺陷的, 其中存在错配修复缺陷的结直肠癌表现为MSI阳性. 实验[2]表明在直肠癌、胃癌、子宫内膜癌、卵巢癌以及肝癌等肿瘤中普遍存在错配修复酶hMLH1、hMSH2的缺乏, 从而导致MSI, 最终导致肿瘤的发生. 本研究用免疫组化方法检测COX-2蛋白, 发现COX-2在有错配修复酶缺陷, 即存在肿瘤微卫星不稳定性和hMLH1和/或hMSH2染色缺陷的结直肠癌组织中表达明显减少, 结肠癌中有hMLH1和hMSH2蛋白的缺乏与COX-2蛋白过表达间有相反关系, 即COX-2蛋白表达阳性的病例, 几乎没有错配修复酶的缺乏; 而错配修复酶的缺乏主要发生在COX-2蛋白表达阴性的病例中, 也就是说二者可能分别属于两类不同性质的肿瘤. Yamamoto et al[13]对100例胃癌和7种细胞株研究发现, 70%的病例可观察到癌组织中COX-2蛋白过表达, 有COX-2蛋白过表达的胃癌细胞株, MSI(-); Karnes et al[14]认为约有15-20%的结直肠癌起源于以MSI为特征的基因途径, 同时伴有DNA错配修复酶的缺乏, 其中以hMLH1或hMSH2的频繁缺失多见, 且此组病例COX-2蛋白染色明显降低或缺乏者占大多数. Lee et al[15]研究也发现, MSI(+)的胃癌COX-2蛋白表达显著降低, MSI(+)的胃癌和蛋白过表达的胃癌有相反的临床病理特征. 本研究结果与国内外报道基本一致.
虽然COX-2、hMLH1、hMSH2在大肠癌中表达的研究已有报道, 但COX-2与hMLH1、hMSH2在大肠癌中表达的相关性研究国内外均未见有报道. 本研究探讨了COX-2与hMLH1、hMSH2在大肠癌组织中表达的相关性, 研究结果表明结肠癌中有hMLH1和hMSH2蛋白的缺乏与COX-2蛋白表达间有相反关系, COX-2和MSI究竟是通过什么机制导致结肠癌的发生, 二者在肿瘤发生发展中是独立起作用, 还是多途径、多环节的? 仍待进一步研究. 可以这样设想, 正常机体基因组的甲基化/去甲基化处于一种平衡状态, 某种因素导致甲基转移酶作用增强, 错配修复基因启动子的甲基化增强, 错配修复酶不表达, 功能丧失, MSI发生, 最终导致一类肿瘤发生; 另一种原因, 使去甲基化酶作用增强, 基因组甲基化作用减弱, COX-2基因启动子去甲基化, COX-2蛋白过表达, 这可能代表了另一类肿瘤的发生途径. 这些提示结肠癌的发生多途径的. 而目前的研究结果提示我们可否考虑用环氧化酶或错配修复酶对结肠癌进行分型, 以指导临床预防和治疗. 如确定为COX-2表达增高, 应用COX-2抑制剂如非甾体类抗炎药阿司匹林等进行治疗; 如为错配修复酶缺乏型结肠癌则可以从启动子的甲基化入手, 应用脱甲基剂或开展基因治疗, 这些都有待做进一步的研究.
编辑: 张海宁
| 1. | Chiaravalli AM, Furlan D, Facco C, Tibiletti MG, Dionigi A, Casati B, Albarello L, Riva C, Capella C. Immunohistochemical pattern of hMSH2/hMLH1 in familial and sporadic colorectal, gastric, endometrial and ovarian carcinomas with instability in microsatellite sequences. Virchows Arch. 2001;438:39-48. [PubMed] |
| 3. | Lim HY, Joo HJ, Choi JH, Yi JW, Yang MS, Cho DY, Kim HS, Nam DK, Lee KB, Kim HC. Increased expression of cyclooxygenase-2 protein in human gastric carcinoma. Clin Cancer Res. 2000;6:519-525. [PubMed] |
| 5. | Hasegawa K, Ichikawa W, Fujita T, Ohno R, Okusa T, Yoshinaga K, Sugihara K. Expression of cyclooxygenase-2 (COX-2) mRNA in human colorectal adenomas. Eur J Cancer. 2001;37:1469-1474. [PubMed] |
| 6. | Zhang H, Sun XF. Overexpression of cyclooxygenase-2 correlates with advanced stages of colorectal cancer. Am J Gastroenterol. 2002;97:1037-1041. [PubMed] |
| 7. | Akhtar M, Cheng Y, Magno RM, Ashktorab H, Smoot DT, Meltzer SJ, Wilson KT. Promoter methylation regulates Helicobacter pylori-stimulated cyclooxygenase-2 expression in gastric epithelial cells. Cancer Res. 2001;61:2399-2403. [PubMed] |
| 9. | Saukkonen K, Nieminen O, van Rees B, Vilkki S, Härkönen M, Juhola M, Mecklin JP, Sipponen P, Ristimäki A. Expression of cyclooxygenase-2 in dysplasia of the stomach and in intestinal-type gastric adenocarcinoma. Clin Cancer Res. 2001;7:1923-1931. [PubMed] |
| 11. | Furukawa T, Konishi F, Shitoh K, Kojima M, Nagai H, Tsukamoto T. Evaluation of screening strategy for detecting hereditary nonpolyposis colorectal carcinoma. Cancer. 2002;94:911-920. [PubMed] |
| 12. | 蔡 崎, 陆 洪芬, 孙 孟红, 张 太明, 施 达仁. 散发性结直肠癌hMLH1和hMSH2蛋白表达. 临床与实验病理学杂志. 2003;19:521-525. |
| 13. | Yamamoto H, Itoh F, Fukushima H, Hinoda Y, Imai K. Overexpression of cyclooxygenase-2 protein is less frequent in gastric cancers with microsatellite instability. Int J Cancer. 1999;84:400-403. [PubMed] |
| 14. | Karnes WE. Implications of low COX-2 expression in colorectal neoplasms with defective DNA mismatch repair. J Cell Biochem Suppl. 2000;34:23-27. [PubMed] |
| 15. | Lee TL, Leung WK, Lau JY, Tong JH, Ng EK, Chan FK, Chung SC, Sung JJ, To KF. Inverse association between cyclooxygenase-2 overexpression and microsatellite instability in gastric cancer. Cancer Lett. 2001;168:133-140. [PubMed] |