修回日期: 2004-07-09
接受日期: 2004-07-11
在线出版日期: 2004-09-15
目的: 探讨树突状细胞(DC)在慢性HBsAg携带者免疫耐受中的作用.
方法: 从外周血分离单个核细胞, 用含GM-CSF, IL-4的AIM-V无血清培养基诱导培养DC.以倒置显微镜和电镜观察DC外部形态和超微结构, 用流式细胞仪检测DC表型, 测定DC表面特异性分子表达, 混合淋巴细胞培养测定其功能, 并检测上清液中IL-12, IFN-γ的水平.
结果: HBsAg携带者的细胞表型分别为: CD80(23.5±4.1%), CD86(70.1±5.8%), HLA-DR(75.2±5.3%), 均明显低于正常对照组(40.9±3.1%, 96.5±4.7%, 95.9±4.8%, P <0.01); 两组CD3、CD14均为阴性表达. 在混合淋巴细胞培养中测定两组细胞诱导T细胞增生能力和细胞因子分泌的水平. HBsAg携带者组cpm值(14 682±2 519)较正常对照组(40 054±3 870)明显降低(P <0.01); HBsAg携带者组细胞因子IL-12, IFN-γ的分泌水平(127±19 ng/L, 822±131 ng/L)较正常对照组(353±44 ng/L, 3 468±515 ng/L)明显下降 (P <0.01).
结论: 慢性HBsAg携带者的免疫耐受状态可能与DC功能低下有关.
引文著录: 梁明, 吕淑兰, 李迪, 李晓光, 李树臣. 树突状细胞在慢性HBsAg携带者免疫耐受中的作用. 世界华人消化杂志 2004; 12(9): 2261-2264
Revised: July 9, 2004
Accepted: July 11, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2261-2264
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2261.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2261
树突状细胞(dendritic cell, DC)是目前发现的功能最强的抗原递呈细胞(APC), 也是惟一能在体内和体外直接激活初始型T细胞的抗原递呈细胞, 明显促进Th细胞和CTL的生成, 因而在激活T细胞介导免疫中具有重要的作用[1-2]. 目前, DC在病毒感染, 肿瘤, 自身免疫病以及超敏反应中国内外都有大量的研究和报道.当病毒感染机体后, 常导致DC数量的减少和功能的缺失, 造成病毒在体内的大规模复制, 研究表明HBV感染的慢性携带机制和免疫耐受机制与DC的抗原递呈功能低下密切相关[3]. 我们采用GM-CSF联合IL-4在无血清培育条件下从正常人和慢性HBsAg携带者外周血单个核细胞成功地诱生DC, 检测二者在形态、表型和功能上的区别. 从而进一步探讨DC在HBsAg携带者所致免疫耐受中的作用.
2001-08/2002-08我科就诊的慢性HBsAg携带者22例, 年龄18-50岁, HBsAg持续阳性半年以上, 无任何临床症状和体征, 肝功能正常. 非妊娠及哺乳期, 未用过免疫调节治疗.正常人组16例. 重组人粒细胞、巨噬细胞集落刺激因子(rhGM-CSF)为军事医学科学院基础研究所的产品. 重组人白介素-4(rhIL-4)购于美国Promega公司. AIM-V无血清培养液购于美国Gibco公司. 人淋巴细胞分离液(1.077 g/L), 购于中国医学科学院血液研究所. FITC标记的鼠抗人mAb CD14, CD3, HLA-DR购于美国Beckman 公司. FITC标记的CD80、PE标记的CD86及同型对照抗体由美国匹兹堡大学肿瘤研究所董新博士惠赠.人IL-12 酶联免疫试剂盒、人IFN-γ酶联免疫试剂盒购于深圳晶美生物制品公司. 丝裂霉素C购于美国Promega公司. [3H]标记的胸腺嘧啶核苷为中国原子核能研究所的产品.
无菌采人外周全血15-20 mL, 用肝素(427 kU/L)抗凝. 人淋巴细胞分离液与外周血1:1的比例加入离心管中密度梯度离心(400 g, 20 min), 用平头吸管吸取单个核细胞层, 用无钙镁PBS液洗细胞2-3次(200 g, 10 min), 用无血清培养基AIM-V 3-4 mL悬浮于25 mL培养瓶中, 37 ℃, 50 mL/L CO2温箱中培养1 h. 贴壁的细胞即为单核细胞.去除悬液(悬液细胞多为T, B细胞), 并用预热的培养基洗去未贴壁的细胞, 重新加入含细胞因子GM-CSF(1 000 kU/L), IL-4(500 kU/L)的AIM-V培养液, 在37 ℃, 50 mL/L CO2温箱中培养7 d, 每隔2-3 d换液1次. 第7 d收获悬浮的细胞及用2.5 g/L胰酶消化所得细胞即为DC. 于培养的1, 4, 7 d倒置显微镜下观察及摄影. 并将培养7 d的DC, 用PBS洗2次, 细胞沉淀结块, 用25 g/L戊二醛固定, 10 g/L俄酸固定, 酒精梯度脱水, 超薄切片, 铅铀染色后透射电镜观察摄影. 收获7 d的DC, PBS 洗2次, 悬浮1 mL计数, 5×109/L, 分装5个Eppendorf管中, 第1管为对照, 其他管分别加入FITC标记的小鼠抗人CD80, CD86, HLA-DR, CD14, CD3各20 mL, 4 ℃暗处标记25 min后, PBS洗2次, 上流式细胞仪检测细胞表型, 计算105个细胞中特异性单抗标记的阳性细胞数. 取同一健康人外周血20 mL, 淋巴细胞分层液密度梯度离心后获取单个核细胞, PBS洗2次, 37 ℃, 50 mL/L CO2孵育1 h, 收集细胞悬液即为T细胞, 调整细胞浓度为2×109/L. 收集7 d的DC细胞, PBS洗2次, 加入丝裂霉素50 mg/L, 37 ℃孵育45 min, PBS洗2次, 调整细胞密度为2×108/L.在96孔培养板中加入T细胞100 mL (2×105/孔), DC细胞100 mL(2×104/孔), 每孔终体积为200 mL, 设3个平行对照孔. 在37℃, 50 mL/L CO2的条件下培养5 d. 于培养48 h取上清, 每孔取100 mL, -20 ℃冻存, 以备检测细胞因子. 培养结束前16 h, 加入[3H]标记的胸腺嘧啶核苷74 kBq/孔, 第5 d用多头细胞样品收集仪收集DC, 80 ℃干燥30 min, 上液闪计数仪检测3H-TDR的掺入率(cpm), 结果用3孔的均值来表示. 另取正常人的PBMC作为DC的阴性对照.将上述MLR反应中48 h收集的上清液应用ELISA检测细胞因子IL-12和g-IFN的浓度.用酶标仪测出每孔的吸光度(A值), 做标准曲线, 根据样品的A值在标准曲线上换算出相对应的浓度值.
统计学处理 采用t检验进行统计学处理, 结果用mean±SD表示, P <0.01为有显著差别.
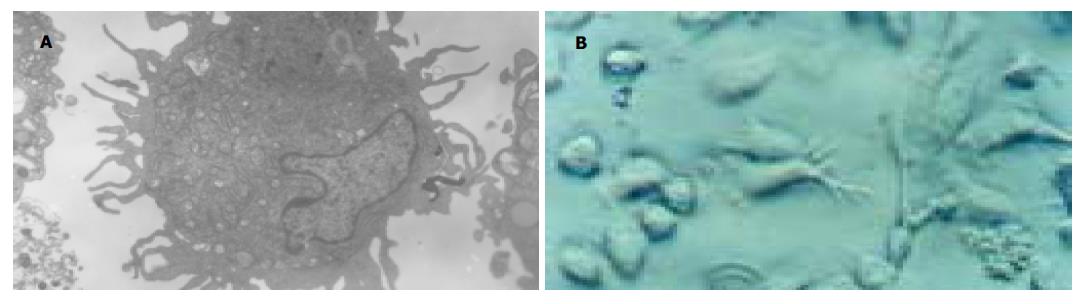
从外周血分离获得的PBMC 贴壁培养1 h后, 贴壁的细胞即为单核细胞. 于贴壁的细胞中加入含GM-CSF和IL-4的AIM-V培养液继续培养24 h后, 可见贴壁的单核细胞均匀的分布成细胞聚体. 继续培养3 d后, 成簇样生长, 形成典型的DC集落.并有少量的DC悬浮于培养液中, 细胞周围有大量树突样突起. 至培养7 d, 可见有大量的不贴壁的细胞及成熟的细胞集落悬浮于培养液中, 高倍镜下观察, 形态不规则, 细胞周围有许多毛刺样的突起, 此为典型的DC(图1A). 透射电镜观察成熟DC, 可见细胞表面有大量不规则的树突样突起, 胞核偏位, 胞质中有丰富的线粒体, 只有少量的高尔基体和分泌颗粒, 偶见溶酶体及粗面内质网(图1B).
无论是患者还是健康人均高表达CD86与HLA-DR, 较高表达CD80, 而单核细胞特异性标志CD14为阴性, T细胞的特异性标志CD3为阴性, 这些均为典型的DC表面标志. HBsAg携带者CD80, CD86, HLA-DR明显低于正常人(P <0.01, 表1).
为了评价不同人群DC刺激同种异体T细胞反应的能力, 进行了混合淋巴细胞反应, 其中HBsAg携带者22例, cpm值为(14 682±2 519)/min; 正常人16名, cpm值为(40 054±3 870)/min. 结果显示HBsAg携带者DC刺激同种异体T细胞反应的能力明显低于正常人(P <0.01). 单独加入DC和T细胞的本底掺入值(cpm)均小于500.
HBsAg携带者22例, IL-12和IFN-γ分别为127±19 ng/L, 822±131 ng/L; 正常人16例, IL-12和IFN-γ分别为353±44 ng/L, 3 468±515 ng/L. 结果显示MLR反应中HBsAg携带者分泌IL-12和IFN-γ水平明显低于正常人(P <0.01).
机体抗病毒免疫主要依赖于CTL途径, 机体内未接触抗原的特异性前T细胞数量极少, 并不具有杀伤活性和增生能力, 只有经过抗原提呈细胞捕获抗原、加工、提呈后, T细胞才能活化增生, 产生CTL应答. DC是体内最强的抗原提呈细胞, DC在人体内分化发育有两个阶段, 即未成熟阶段和成熟阶段. 未成熟DC位于抗原入侵部位, 具有捕获处理抗原的能力, 发育至成熟DC后, 摄取抗原能力下降, 具有激活初始T细胞的能力, DC是惟一能激活静止型T细胞并诱导原发性CTL反应的免疫细胞. 外来抗原由其捕获, 经胞内蛋白溶解处理后, 以抗原肽-MHC-I类分子的形式提呈给CD8+ T细胞, 在B7(CD80 , CD86 )-CD28, ICAM-1-LFA-1, LFA-3-CD2等协同刺激信号作用下, 激活T, B淋巴细胞启动特异性免疫反应, 从而清除病毒[4-6]. 关于DC在病毒性肝炎及肝癌中功能的研究国内外有很多报道, 于建武et al[7]对于慢性乙型肝炎患者的研究和李晓光et al[8]对慢性丙型肝炎的研究均发现DC诱导免疫功能低下.李明松et al和Kakumu et al[9]发现HCC患者外周血DC表面B7和HLA-DR表达低下, 提示其与HCC 患者免疫能力密切相关. 关于慢性HBsAg携带者DC的研究国内尚无报道. 慢性HBsAg携带者的形成主要是与围产期和幼龄期感染HBV有关, 母婴传播为主要途径.其机制可能是由于胚胎期及新生儿期机体免疫功能不健全, 在数量及功能上缺失, 其表达的共刺激信号减少, 同时APC功能低下导致记忆性T, B细胞缺失, 以及HBV感染导致PBMC的凋亡, 从而导致免疫耐受的形成[10-11]. DC在外周血中含量极低, 约占单个核细胞的1%, 直接分离DC有一定的困难, 本实验在Morse et al[12]所采用方法的基础上采取通过分离外周血单核细胞, 无血清培养基中添加rhGM-CSF和rhIL-4的方法在体外大量扩增DC, 为进一步的基础工作和临床应用奠定了基础. 其中rhGM-CSF是维持DC细胞发育分化最根本的细胞因子, 可促进其前体细胞向DC和巨噬细胞方向的发育, 而rhIL-4则抑制粒细胞和巨噬细胞的产生[13]. 本实验研究发现, DC的细胞表型CD80, CD86, HLA-DR表达率明显低于正常人, 表明慢性HBsAg携带者存在着DC表型的不成熟; 在混合淋巴细胞反应中IL-12和IFN-γ明显低于正常人, 说明DC诱导T细胞增生能力的低下, 其机制认为是DC免疫调节和抗原提呈功能存在缺陷, 不能把病毒抗原的信号传递给机体的免疫系统, 从而不能产生特异性的CTL反应清除体内的病毒[14-16], 这可能是形成乙型肝炎免疫耐受的主要原因.造成DC功能下降的原因一方面可能是由于其共刺激分子的降低或细胞因子的产生减少所至, 另一方面可由病毒感染直接造成, Vivier et al发现在感染了麻疹病毒(MV)的患者中可见到DC中有MV的大量复制, DC分泌IL-12下降, 且DC与T细胞均大量凋亡.但有关HBV病毒对DC功能的影响还需进一步的研究.
本结果进一步证实了HBV感染所致免疫耐受与DC的抗原提呈功能低下有密切关系. 提示慢性HBsAg携带者的发病可能和体内抗原提呈细胞, 尤其是DC的功能低下有关. 这一理论也为抗原活化DC过继免疫治疗慢性HBsAg携带者提供了理论基础, 通过DC特异性激活CD8+ T细胞和CD4+辅助T细胞, 产生高水平、高亲和力的抗体反应, 从而达到清除病毒的目的, 这在理论上是可行的[17-19]. 已有实验证明, 通过用HBsAg致敏的DC疫苗, 回输给HBV感染的转基因小鼠, 能观察到小鼠体内IL-12, IL-2和TNF-α的功能增强, HBsAg转阴[20-21]. 因此, DC疫苗的研制应是未来肝炎临床治疗重要手段之一, 对于慢性HBsAg携带者治疗还有待于进一步的研究.
| 1. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] |
| 2. | Zheng BJ, Zhou J, Qu D, Siu KL, Lam TW, Lo HY, Lee SS, Wen YM. Selective functional deficit in dendritic cell--T cell interaction is a crucial mechanism in chronic hepatitis B virus infection. J Viral Hepat. 2004;11:217-224. [PubMed] |
| 3. | Banchereau J, Steinman RM. Dendritic cells and the control of immunity. Nature. 1998;392:245-252. [PubMed] |
| 4. | Melief CJ. Mini-review: Regulation of cytotoxic T lymphocyte responses by dendritic cells: peaceful coexistence of cross-priming and direct priming? Eur J Immunol. 2003;33:2645-2654. [PubMed] |
| 5. | Salio M, Shepherd D, Dunbar PR, Palmowski M, Murphy K, Wu L, Cerundolo V. Mature dendritic cells prime functionally superior melan-A-specific CD8+ lymphocytes as compared with nonprofessional APC. J Immunol. 2001;167:1188-1197. [PubMed] |
| 6. | Anderson CF, Lucas M, Gutiérrez-Kobeh L, Field AE, Mosser DM. T cell biasing by activated dendritic cells. J Immunol. 2004;173:955-961. [PubMed] |
| 9. | Kakumu S, Ito S, Ishikawa T, Mita Y, Tagaya T, Fukuzawa Y, Yoshioka K. Decreased function of peripheral blood dendritic cells in patients with hepatocellular carcinoma with hepatitis B and C virus infection. J Gastroenterol Hepatol. 2000;15:431-436. [PubMed] |
| 10. | Jung MC, Pape GR. Immunology of hepatitis B infection. Lancet Infect Dis. 2002;2:43-50. [PubMed] |
| 11. | Li L, Gu CH, Li X. [The significance of activation-induced cell death (AICD) in pathogenesis of hepatitis B]. Zhonghua Yi Xue Za Zhi. 2003;83:1146-1149. [PubMed] |
| 12. | Morse MA, Zhou LJ, Tedder TF, Lyerly HK, Smith C. Generation of dendritic cells in vitro from peripheral blood mononuclear cells with granulocyte-macrophage-colony-stimulating factor, interleukin-4, and tumor necrosis factor-alpha for use in cancer immunotherapy. Ann Surg. 1997;226:6-16. [PubMed] |
| 13. | Salgaller ML, Tjoa BA, Lodge PA, Ragde H, Kenny G, Boynton A, Murphy GP. Dendritic cell-based immunotherapy of prostate cancer. Crit Rev Immunol. 1998;18:109-119. [PubMed] |
| 14. | Wang FS, Xing LH, Liu MX, Zhu CL, Liu HG, Wang HF, Lei ZY. Dysfunction of peripheral blood dendritic cells from patients with chronic hepatitis B virus infection. World J Gastroenterol. 2001;7:537-541. [PubMed] |
| 15. | Zwaveling S, Ferreira Mota SC, Nouta J, Johnson M, Lipford GB, Offringa R, van der Burg SH, Melief CJ. Established human papillomavirus type 16-expressing tumors are effectively eradicated following vaccination with long peptides. J Immunol. 2002;169:350-358. [PubMed] |
| 16. | Arima S, Akbar SM, Michitaka K, Horiike N, Nuriya H, Kohara M, Onji M. Impaired function of antigen-presenting dendritic cells in patients with chronic hepatitis B: localization of HBV DNA and HBV RNA in blood DC by in situ hybridization. Int J Mol Med. 2003;11:169-174. [PubMed] |
| 17. | Motsinger A, Haas DW, Stanic AK, Van Kaer L, Joyce S, Unutmaz D. CD1d-restricted human natural killer T cells are highly susceptible to human immunodeficiency virus 1 infection. J Exp Med. 2002;195:869-879. [PubMed] |
| 18. | Li YG, Chen M, Zhang DZ, Wang ZY, Zeng WQ, Shi XF, Guo Y, Guo SH, Ren H. [Clinical research on the treatment effect of autologous dendritic cell vaccine on the patients with chronic hepatitis B]. Zhonghua Gan Zang Bing Za Zhi. 2003;11:206-208. [PubMed] |
| 20. | Akbar SM, Horiike N, Onji M, Hino O. Dendritic cells and chronic hepatitis virus carriers. Intervirology. 2001;44:199-208. [PubMed] |
| 21. | Akbar SM, Furukawa S, Hasebe A, Horiike N, Michitaka K, Onji M. Production and efficacy of a dendritic cell-based therapeutic vaccine for murine chronic hepatitis B virus carrierer. Int J Mol Med. 2004;14:295-299. [PubMed] |