修回日期: 2004-06-09
接受日期: 2004-06-24
在线出版日期: 2004-09-15
目的: 探讨应用体外培养的不成熟树突状细胞调节肝脏移植免疫反应的方法及机制.
方法: 建立大鼠同种异体原位肝移植模型, LWE大鼠和SD大鼠随机分为3组: (1)对照组: 术后不予免疫抑制剂; (2) CsA组: 术后2 d起隔日腹腔内按10 mg/kg注射CsA, 共3次; (3) CsA+DC组: 除术后按CsA组腹腔注射CsA外, 8 d阴茎背静脉注射106个供体骨髓体外培养的DCim. 术后观察各组的生存时限及5, 10, 15, 25 d分别取标本行肝脏免疫病理、肝功能及腹腔淋巴结中IL-2 mRNA, IL-4 mRNA含量的检测.
结果: CsA+DC组的平均生存时限为27.0 d, 较对照组及CsA组显著延长(P <0.05); CsA+DC组受体腹腔淋巴结中的IL-2 mRNA含量较对照组及CsA组低(P <0.05), 而IL-4 mRNA含量则较前两组升高(P <0.05).
结论: 联合应用CsA和体外培养的供体特异不成熟树突状细胞可降低大鼠同种异体肝移植术后免疫排斥反应; 通过调节受体内Th1/Th2淋巴细胞比例是其降低大鼠肝移植术后免疫排斥反应的机制之一.
引文著录: 宋予军, 董家鸿, 杨占宇. 供体不成熟树突状细胞联合环孢素A调节肝移植免疫排斥. 世界华人消化杂志 2004; 12(9): 2217-2219
Revised: June 9, 2004
Accepted: June 24, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2217-2219
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2217.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2217
本研究应用同种异体大鼠肝脏移植模型, 依据T淋巴细胞激活的双信号理论对供体特异的树突状细胞(DC)前体细胞进行体外培养, 特异性上调其MHC表达、下调CD80/CD86等表面分子的表达, 探讨体外培养的不成熟树突状细胞(DCim)调节肝脏移植免疫反应的作用及机制.
供体: SD大鼠, ♂, 质量200-250 g; 受体: LEW大鼠, ♂, 质量200-250 g. PCR扩增仪(MJ PTC-200), 凝胶图像扫描分析仪. 粒细胞-巨噬细胞集落刺激因子(GM-CSF), R&D公司; 环孢素A(CsA), 白介素4(IL-4), 白介素10(IL-10); FITC标记山羊抗小鼠IgG(北京中山); Serotec公司: Mouse anti rat OX62, Mouse anti rat CD80, Mouse anti rat CD86, Mouse anti rat MHC-II(OX6)等.
供体、受体随机分为3组: (1)对照组 术后不予免疫抑制剂; (2)CsA组 术后2 d起隔日按10 mg/kg, ip, CsA, 共3次; (3)CsA+DC组 除术后按CsA组腹腔注射CsA外, 术后8 d阴茎背静脉注射106个供体骨髓体外培养的DCim. 以SD大鼠为供体, LEW大鼠为受体行大鼠同种异体肝脏移植. 切取SD大鼠肝脏后, 提取其骨髓细胞, 加含有GM-CSF, IL-4的RPMI 1640培养液(GM-CSF, IL-4终浓度分别为0.6 mg/L, 10 mg/L)调整细胞浓度至1×109/L后置于24孔培养板中. 3 d后吸去原培养液, 换入含有GM-CSF, IL-10, CsA(GM-CSF, IL-10, CsA浓度分别为0.6 mg/L, 0.2 mg/L, 1 mg/L)的DC培养液, 以后每2 d换液90%, 吸去未贴壁的细胞, 8 d以吸管吹打重新悬浮得到不成熟树突状细胞, 将细胞悬液置入另一24孔板, 计数备用. 对照组受体分别于术后5 d, 10 d处死; CsA组受体于术后5 d, 10 d, 15 d处死; CsA+DC组受体分别于术后10 d, 15 d, 25 d处死, 每个时相点8只受体. 取标本进行各项指标的检测. (1)细胞表面分子流式细胞仪检查, 采用间接免疫荧光标记法标记培养得到的供体特异DC细胞表面分子CD80, CD86, OX62, OX6, 流式细胞仪检测. (2)观察各组大鼠术后存活时限(每组大鼠8只受体). (3)肝脏免疫排斥病理学改变.根据Williams et al[1]推荐的标准将急性免疫排斥病理学改变分为四级: 0级, 无排斥证据; 1级, 轻度排斥; 2级, 中度排斥; 3级, 重度排斥. (4)血清ALT、TBIL、Alb水平检测. (5)半定量RT-PCR检测腹腔淋巴结IL-2, IL-4 mRNA表达水平, 按TripureTM总RNA抽提试剂盒说明书进行总RNA提取, RT-PCR引物设计按照Mcknight et al[2]推荐的大鼠β-actin, IL-2, IL-4的引物序列. PCR产物9 mL+ 10×DNA Loading buffer 1 mL混匀, 20 g/L琼脂糖凝胶电泳30 min, 紫外观测电泳条带分子大小. 以β-actin为内参照, 测定样本目的基因的相对表达量, 每试验结果至少重复2次. 采用Microsoft Excel 2000及SPSS 10.0对数据进行统计及检验, P <0.05为相差显著.
DC表面标志性抗原OX62高表达(81.2%), 大鼠细胞表面MHCⅡ分子OX6阳性(51.6%), 而协同刺激分子CD80/CD86低表达(11.6%)或呈阴性(4.1%). 表明经过8 d培养后得到了较为纯化的供体大鼠骨髓来源的不成熟DC细胞.
对照组大鼠第5 d起开始出现黄疸且进行性加深, 精神差, 进食及活动减少, 大鼠平均存活10.6±0.48 d, 均于10-11 d死亡. CsA组大鼠术后黄疸程度要明显轻于对照组, 平均存活15.3±0.62 d, 术后15-16 d死亡. CsA+DC组大鼠术后15 d开始出现轻度黄疸, 无进行性加重, 大鼠于26 d开始死亡, 平均存活27.0±1.0 d, 最长存活29 d.
对照组第5 d即出现严重的急性免疫排斥病理学改变, 到10 d有7只大鼠出现3级急性免疫排斥病理学改变. 而CsA组虽然5 d的急性免疫排斥病理学改变较轻, 但其进行性加重, 至15 d大部分大鼠出现了3级免疫排斥病理学的改变. CsA+DC组虽然也出现轻度急性免疫排斥反应, 但其进展较其余两组明显缓慢, 到25 d时有4只受体急性免疫排斥的病理性学改变达到3级, 3只2级(表1).
| 免疫病理分级 | 对照组 | CsA组 | CsA+DC组 | |||||
| 5 d | 10 d | 5 d | 10 d | 15 d | 10 d | 15 d | 25 d | |
| 0级 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| 1级 | 0 | 0 | 7 | 1 | 0 | 5 | 5 | 1 |
| 2级 | 6 | 1 | 1 | 6 | 2 | 3 | 2 | 3 |
| 3级 | 2 | 7 | 0 | 1 | 6 | 0 | 1 | 4 |
对照组5 d转氨酶及胆红素即明显升高, 且上升较快, 10 d时达到高峰. 而CsA组除了5 d转氨酶水平与对照组无显著差异外, 其余时相点胆红素及转氨酶的水平明显要低于相同时相点的对照组, 且上升较缓慢. 3组中相同时相点, CsA+DC组的转氨酶、胆红素水平最低, 升高趋势也最缓慢. 血清白蛋白, 也以CsA+DC组水平为最高. 总体的肝功能水平CsA+DC组在3组最好.
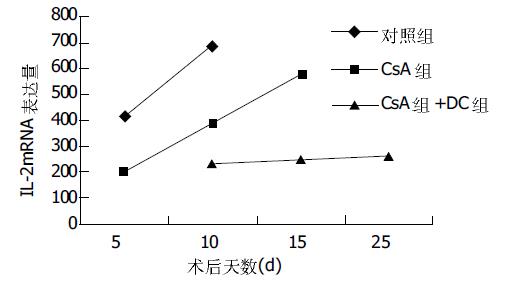
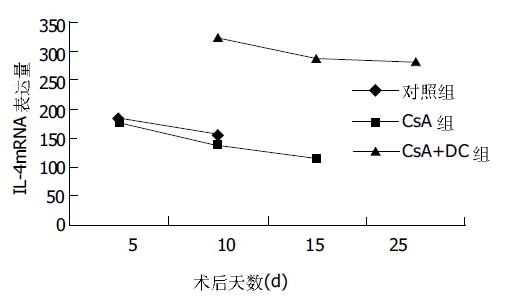
IL-2 mRNA表达水平因各组各时相点的不同而变化很大, 其中对照组在5 d时即有明显的升高, 到10 d时达到最高峰, 而CsA组的上升趋势较缓慢, CsA+DC组的IL-2 mRNA表达水平上升趋势不明显, 到25 d时Rx值为263, 相同时相点显著低于其他两组(P <0.05). 对照组腹腔淋巴结中的IL-4 mRNA表达水平较低, CsA组的IL-4 mRNA表达水平最低, 15 d Rx值117. CsA+DC组的IL-4 mRNA表达在10 d高于其余两组, 此后一直保持在较高的水平, 相同时相点显著高于其他两组(P <0.05, 图1, 2).
肝脏移植后急性免疫排斥反应主要是由T淋巴细胞介导的细胞免疫排斥反应. 抗原经过抗原提呈细胞(APC)处理后提呈给T细胞才能激活T细胞产生抗原特异性应答. APC在诱导T细胞进行增生进而分化成为效应细胞时, 需要有协同刺激分子的参与, 否则, T细胞不能充分活化, 不能表现效应功能, 且可诱导抗原特异的淋巴细胞呈无能状态[3-4]. 在器官移植后移植物内的免疫细胞等可迁移至宿主的淋巴结及脾脏等淋巴器官内形成所谓的"微嵌合"影响宿主的免疫应答[5-7]. 根据以上理论, 本试验拟特异性的调低供体特异的APC(DC)的表面协同刺激分子从而调低宿主对移植物的免疫排斥反应[8-10].
我们在体外利用GM-CSF、IL-4、IL-10、CsA培养供体骨髓提取细胞, 8 d后得到大量的供体特异不成熟DC, 虽然此种不成熟的DC表面MHC呈阳性, 但其协同刺激分子CD80、CD86却低表达或呈阴性. 在同种异体大鼠肝移植术后短期应用CsA使宿主经过一个短期、程度较深的全身免疫抑制过程以抑制或去除在宿主接受器官移植前即存在的自身反应性淋巴细胞克隆后, 在术后8 d静脉输注供体来源的DCim, 达到了调低宿主对供体的免疫排斥反应的目的. 联合应用CsA与供体来源的DCim, 大鼠的平均生存期由CsA组的15.3 d延长至27.0 d, 且其肝脏免疫排斥病理学改变及肝功能的损害亦明显轻于CsA组. 小鼠CD4+ T细胞受抗原刺激后可分化为Th1与Th2两个亚群, 分别分泌不同的细胞因子[11], Th1分泌IL-2、IFN-γ等, Th2分泌IL-4、IL-10等. Th1型和Th2型细胞互相抑制彼此表型的分化和功能. 研究结果表明, 在产生急性排斥的移植器官中检测到大量的Th1型细胞因子存在, 而在产生耐受的移植器官中可检测到Th2细胞因子占优势[12-14]. 宿主腹腔淋巴结的IL-2mRNA的表达水平中, CsA组较对照组为低, 而以CsA+DC组的Th1型细胞因子IL-2mRNA表达最低(P <0.05). Th2型细胞因子IL-4mRNA的表达CsA组低于对照组, CsA+DC组则明显高于对照组(P <0.05), 并维持在较高的水平上. 说明CsA的作用只是抑制了T淋巴细胞的激活和向Th1/Th2细胞的分化, 从而抑制了宿主的免疫排斥反应, 但并不能改变宿主淋巴细胞中Th1细胞与Th2细胞的比例, 一旦药物作用消失, T淋巴细胞依然能被激活、增生、分化产生免疫排斥反应. CsA+DC组的宿主免疫期器官中则明显以Th2细胞占优势, 说明输注体外培养的供体特异的DCim是通过调节免疫器官中的Th1/Th2细胞的比例, 使宿主体内的Th2淋巴细胞升高, 抑制Th0细胞向Th1型淋巴细胞分化, 从而调低宿主的急性免疫排斥反应.
Th2细胞主要通过以下几点降低宿主的免疫排斥反应: 急性免疫排斥反应的效应细胞TDTH, CTL需要Th1细胞分泌的细胞因子IL-2, IFN-γ的刺激激活, Th2细胞因子可以抑制Th1克隆的增生和阻断Th0向Th1细胞分化. 急性排斥反应的效应细胞TDTH, CTL细胞的分化成熟都需IL-12调节[15], Th2型细胞因子还可通过调节APC分泌的细胞因子, 特别是抑制IL-12的产生来调节CD4, CD8细胞的成熟及分化. 这些活化的Th2细胞一部分可分化成记忆性T淋巴细胞, 在体内长时间存在, 即使免疫抑制剂的作用消失仍然能特异性调低宿主对供体抗原的免疫排斥反应并维持较长一个时期.
| 1. | Williams JW, Peters TG, Vera SR, Britt LG, van Voorst SJ, Haggitt RC. Biopsy-directed immunosuppression following hepatic transplantation in man. Transplantation. 1985;39:589-596. [PubMed] [DOI] |
| 2. | McKnight AJ, Barclay AN, Mason DW. Molecular cloning of rat interleukin 4 cDNA and analysis of the cytokine repertoire of subsets of CD4+ T cells. Eur J Immunol. 1991;21:1187-1194. [PubMed] [DOI] |
| 5. | 张 临友, 李 刚. 嵌合与移植. 国外医学·免疫学分册. 2000;23:39-42. |
| 6. | Mazariegos GV, Zahorchak AF, Reyes J, Ostrowski L, Flynn B, Zeevi A, Thomson AW. Dendritic cell subset ratio in peripheral blood correlates with successful withdrawal of immunosuppression in liver transplant patients. Am J Transplant. 2003;3:689-696. [PubMed] [DOI] |
| 7. | Lau AH, Thomson AW. Dendritic cells and immune regulation in the liver. Gut. 2003;52:307-314. [PubMed] [DOI] |
| 8. | 戴 盛明, 杨 春旭. 树突状细胞异质性研究进展. 国外医学·生理、病理科学与临床分册. 2001;21:325-327. |
| 9. | Chiang YJ, Lu L, Fung JJ, Qian S. Liver-derived dendritic cells induce donor-specific hyporesponsiveness: use of sponge implant as a cell transplant model. Cell Transplant. 2001;10:343-350. [PubMed] [DOI] |
| 10. | Otto C, Ohrlein E, Meyer D, Timmermann W, Gassel HJ, Thiede A, Ulrichs K. Detection of dendritic cells with down-regulated CD80/CD86, but normal MHC class II expression after rat liver transplantation. Transplant Proc. 2001;33:442-444. [PubMed] [DOI] |
| 11. | Mosmann TR, Sad S. The expanding universe of T-cell subsets: Th1, Th2 and more. Immunol Today. 1996;17:138-146. [PubMed] [DOI] |
| 13. | 陈 晋. 延长移植物存活分子策略的一些进展. 国外医学·免疫学分册. 2002;25:117-119. |
| 14. | Gao Q, Chen N, Rouse TM, Field EH. The role of interleukin-4 in the induction phase of allogeneic neonatal tolerance. Transplantation. 1996;62:1847-1854. [PubMed] [DOI] |