修回日期: 2004-07-09
接受日期: 2004-07-15
在线出版日期: 2004-09-15
目的: 研究三叶因子3(trefoil factor 3, TFF3)基因在三硝基苯磺酸(TNBS)诱发的大鼠结肠炎肠黏膜表达的变化, 探讨其在结肠炎发生发展中的作用.
方法: 采用TNBS/乙醇灌肠制作大鼠结肠炎模型(n = 15), 观察大鼠腹泻、便血情况, 评价疾病活动性指数(DAI)并记录体重改变, 分别于制模后1, 7及14 d处死大鼠. 生理盐水灌肠作为正常对照组.大体及镜下观察肠黏膜损伤及组织学变化, 并进行评分.生化法检测MPO活性. 逆转录-多聚酶链反应(RT-PCR)检测TFF3基因表达.
结果: 结肠炎组1, 7及14 d 时间点DAI(3.8±0.5 vs 0, 3.3±0.5 vs 0, 2.3±0.5 vs 0)、体质量(-3.2±0.7 vs 4.7±2.2, -7.2±2.0 vs 10.9±0.2, 2.9±0.4 vs 30.5±2.9)、大体评分(7.2±0.9 vs 0, 6.2±1.3 vs 0, 4.6±0.5 vs 0)和组织学评分(8.2±1.2 vs 0, 10.4±0.5 vs 0, 8.4±0.5 vs 0)以及MPO活性(1 745±55 vs 303±21, 1 789±77 vs 315±20, 1 736±127 vs 313±35)较正常对照组均存在显著差异(P <0.05). TFF3在结肠组织炎症的各个时间点均有表达, 致炎后1 d组较正常对照组减少, 7和14 d组明显升高(0.63±0.05 vs 0.72±0.02, 0.94±0.19 vs 0.72±0.02, 1.25±0.74 vs 0.72±0.02, P <0.05).
结论: TNBS诱发的大鼠结肠炎有TFF3基因的表达, 提示TFF3在结肠炎黏膜损伤修复中发挥作用.
引文著录: 宋敏, 李瑾, 夏冰. TNBS诱发大鼠结肠炎中三叶因子3的表达. 世界华人消化杂志 2004; 12(9): 2212-2214
Revised: July 9, 2004
Accepted: July 15, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2212-2214
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2212.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2212
肠黏膜损伤主要是通过细胞增生以及上皮移行重建而修复.三叶因子3(trefoil factor 3, TFF3)是一类对肠黏膜有保护作用的小分子多肽, 其对肠黏膜保护作用的机制可能在于TFF3与黏液糖蛋白结合, 增强黏液糖蛋白的稳定性, 防止有害物质对肠黏膜细胞的损伤[1-2]. 此外, TFF3具有很强的促进细胞增生与移行的能力, 可促进受损区域上皮细胞重建并加快上皮细胞移行速度, 从而修复受损肠黏膜[3-7]. TFF3能促进肠黏膜的修复及愈合[4,8], 仅有少数文献涉及TFF3在炎症性肠病(IBD)黏膜表达的研究. 我们以TNBS/乙醇诱发的大鼠结肠炎为模型, 研究结肠炎大鼠TFF3基因表达变化, 为探讨TFF3对IBD肠黏膜损伤的修复作用提供依据.
三硝基苯磺酸(TNBS)购自Sigma公司; 髓过氧化物酶(MPO)检测试剂盒购自南京建成生物工程研究所;RT-PCR相关试剂购自深圳晶美生物工程有限公司; 相关引物由北京三博远志生物技术有限责任公司合成. 采用TNBS结肠炎动物模型[9]: 30只Wistar 成年♂大鼠, 体质量200-250 g, 由湖北省实验动物研究中心提供.置于温度为22±1 ℃的净化实验室内, 混合食料喂养, 自由饮水.随机分成A, B两组, 每组各15只, 分别于1, 7及14 d 各时间点处死5只大鼠. A组为正常对照组, B组为结肠炎组.大鼠在实验前1 d禁食, 用20 g/L异戊巴比妥钠40 mg/kg ip麻醉. 将一输液管经大鼠肛门插入结肠深约8 cm. B组每只大鼠缓慢注入TNBS(溶于500 mL/L乙醇中至终浓度100 g/L) 0.25 mL, 制成大鼠结肠炎模型[9]. 正常对照组缓慢注入生理盐水0.25 mL. 观察大鼠大便性状改变和有无便血作为疾病活动指数(disease activity index, DAI)[10], 记录体质量变化, 以及进行大体形态[11]及组织学评分[12].
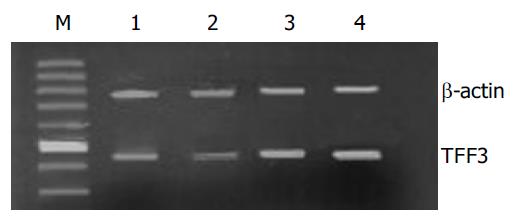
取远端结肠组织0.1 g, 按质量体积比为1:19加入均浆递质1.9 mL进行匀浆, 按试剂盒操作步骤进行检测. 用UV-2000型紫外可见分光光度计于波长460 nm, 1 cm光径, 蒸馏水调零, 测定各管A值, 计算酶活力单位.每克组织湿片在37 ℃的反应体系中H2O2被分解1 mmol为1个酶活力单位.另取远端结肠组织, 用1 g/L DEPC水反复冲洗至少3次, 放入冷凝管, 迅速放入液氮保存.总RNA抽提按TriZolTM方法: 取50-100 mg冻存组织, 捣碎; 加Trizol试剂1 mL, 匀浆; 加氯仿0.2 mL, 振荡15 s, 4-8 ℃离心(12 000 r/min)15 min; 取上清液, 加异丙醇0.5 mL, 4-8 ℃离心(12 000 r/min)10 min; 750 mL/L乙醇1 mL洗涤沉淀, 4-8 ℃离心(7 500 r/min) 5 min, 自然晾干; 加DEPC-H2O 30 mL, 55-60 ℃孵育10 min.将总mRNA 1 mg置于20 mL的反应体系中进行逆转录(42 ℃60 min, 70 ℃ 10 min); 取反应产物2 mL置于50 mL PCR反应体系, 同时加入β-actin引物作为内对照共同扩增. TFF3正义引物: 5'-ATGGAGACCAGAGCCTTCTGGAC-3'; 反义引物: 5'-AGAGGTTTGAAGCACCAGGGC-3', 扩增片断422 bp.β-actin正义引物: 5'-TTGTAACCAACTGGGACGATATGG-3'; 反义引物: 5'-GATCTTGATCTTCATGGTGCTAGG- 3', 扩增片断754 bp. 95 ℃ 40 s, 60 ℃ 40 s, 72 ℃ 60 s, 经历35个循环. PCR扩增产物用15 g/L琼脂糖凝胶电泳分离, 溴化乙锭染色, 紫外灯下观察并照相. 用计算机凝胶图像分析系统进行吸光度分析 .
统计学处理 实验数据以mean±SD 表示, 统计方法通过SPSS11.0软件包采用t检验分析, P <0.05认为差异显著.
结肠炎组大鼠1 d后出现腹泻、便血, 与正常对照组比较, DAI显著增高(P <0.05). 正常对照组大鼠1 d 即出现体质量增加4.7±2.2 g; 而结肠炎组大鼠下降7.2±2.0 g, 7 d开始回升. 炎症组大鼠表现为肠管浆膜湿润, 光泽, 可见瘀点状出血. 黏膜表面颗粒状、质脆. 结肠与周围组织粘连伴近端肠腔扩张, 但未见穿孔. 黏膜质脆, 可见充血水肿、红斑、浅表溃疡形成. 炎症和溃疡位于距肛门8 cm范围内, 溃疡呈白色线状或灶性, 周围黏膜增厚. 光镜下结肠炎组大鼠1 d 表现为病变结肠区域出现溃疡, 肠黏膜及黏膜下血管高度扩张充血和水肿, 并伴有出血, 其间有大量炎性细胞浸润, 以中性粒细胞为主. 7 d炎症镜下表现为节段性溃疡形成, 肠黏膜中度充血水肿, 大量嗜酸性白细胞浸润. 部分上皮坏死脱落、肠壁肉芽组织形成.14 d炎症期表现为结肠病变区仍有溃疡形成, 黏膜及黏膜下层慢性炎症细胞浸润, 小血管扩张, 肉芽组织形成, 另可见增生的纤维母细胞.结肠炎组大鼠MPO活性明显高于对照组(表1, P <0.05).
| 正常对 照组 | 结肠炎组 | |||||
| 1 d | 7 d | 14 d | 1 d | 7 d | 14 d | |
| TFF3/β-actin | 0.72±0.02 | 0.72±0.02 | 0.72±0.02 | 0.63±0.05a | 0.94±0.19a | 1.25±0.74a |
| DAI | 0 | 0 | 0 | 3.8±0.4a | 3.3±0.5b | 2.3±0.5b |
| mB | 4.7±2.2 | 10.9±0.23 | 0.5±2.9 | -3.2±0.7a | -7.2±2.0a | 2.9±0.4a |
| 大体评分 | 0 | 0 | 0 | 7.2±0.9b | 6.2±1.3b | 4.6±0.5b |
| 组织学评分 | 0 | 0 | 0 | 8.2±1.2b | 10.4±0.5b | 8.4±0.5b |
| MPO(nKat/g) | 303±21 | 315±20 | 313±35 | 1 745±55a | 1 789±77a | 1 736±127a |
TNBS/乙醇诱发的大鼠远端结肠炎病理表现与人类IBD类似. TNBS诱发结肠炎的确切机制尚未阐明, 可能是TNBS作为一种化学性半抗原, 与结肠上皮细胞大分子组织蛋白结合形成完全抗原, 使T淋巴细胞致敏, 溶解自身细胞所致. 此外, TNBS与抗坏血酸盐相互作用时, 被代谢生成活性氧及过氧化物, 对组织上皮细胞产生毒性而导致损伤[13]. 从对本实验结肠炎大鼠症状、大体及组织学的观察, 与上述免疫性炎症反应相符合. TFF3是一种含独特三叶草结构的小分子多肽[7,14]. 现有大量证据表明三叶肽在肠黏膜的保护和修复中发挥重要作用.目前认为TFF3对肠黏膜的保护作用与黏液的参与有关. TFF3空间结构中有一个0.8-1 nm的间隙能与黏液糖蛋白结合, 对黏液糖蛋白的分子结构起支架作用, 增强黏液糖蛋白的稳定性, 防止有害物质对肠黏膜细胞的损伤[15]. 此外, TFF3具有很强的促进细胞增生与移行的能力, 可促进受损区域上皮细胞重建并加快上皮细胞移行速度, 从而修复受损肠黏膜. Cook et al[5]观察到细菌胞壁内毒素脂多糖可诱导TFF3表达, 提示TFF3可能是单核细胞移行的刺激因子, 在肠道损伤的免疫应答中发挥作用. 本实验表明, TFF3 mRNA在正常肠黏膜可有表达, 致炎1 d后减少, 7和14 d可见显著升高(P <0.05), 提示TFF3在IBD损伤恢复期发挥重要作用.该结果与Loncar et al[16]的研究结果一致. Tran et al[17]显示TFF3mRNA在TNBS结肠炎8 wk内均有高表达.
本实验还表明, TFF3 mRNA表达与MPO、DAI等炎症指标呈线性相关, 提示TFF3表达与炎症有关. MPO是粒(单)细胞浆中所特有的糖蛋白颗粒. 当某些异物侵入或感染, 诱导产生炎症细胞因子如IL-1, IL-8, TNF-α等, 使中性粒细胞(PMN)趋化, 使原来处于静息的PMN内部的MPO向细胞表面移动释放, 故MPO含量的增高可以反映中性粒细胞在某一组织中的增高, 间接反映炎症组织的活动性. 本实验大鼠结肠炎肠黏膜MPO活性与TFF3表达同时增强, 提示肠黏膜免疫炎症反应存在促炎与抗炎的平衡.
总之, TNBS诱发的大鼠结肠炎肠黏膜有TFF3基因的表达, 提示TFF3在结肠炎黏膜损伤修复中发挥作用.
| 1. | Emami S, Le Floch N, Bruyneel E, Thim L, May F, Westley B, Rio M, Mareel M, Gespach C. Induction of scattering and cellular invasion by trefoil peptides in src- and RhoA-transformed kidney and colonic epithelial cells. FASEB J. 2001;15:351-361. [PubMed] [DOI] |
| 2. | Gouyer V, Wiede A, Buisine MP, Dekeyser S, Moreau O, Lesuffleur T, Hoffmann W, Huet G. Specific secretion of gel-forming mucins and TFF peptides in HT-29 cells of mucin-secreting phenotype. Biochim Biophys Acta. 2001;1539:71-84. [PubMed] [DOI] |
| 3. | Hahm KB, Im YH, Parks TW, Park SH, Markowitz S, Jung HY, Green J, Kim SJ. Loss of transforming growth factor beta signalling in the intestine contributes to tissue injury in inflammatory bowel disease. Gut. 2001;49:190-198. [PubMed] [DOI] |
| 4. | Taupin D, Pedersen J, Familari M, Cook G, Yeomans N, Giraud AS. Augmented intestinal trefoil factor (TFF3) and loss of pS2 (TFF1) expression precedes metaplastic differentiation of gastric epithelium. Lab Invest. 2001;81:397-408. [PubMed] [DOI] |
| 5. | Cook GA, Familari M, Thim L, Giraud AS. The trefoil peptides TFF2 and TFF3 are expressed in rat lymphoid tissues and participate in the immune response. FEBS Lett. 1999;456:155-159. [PubMed] [DOI] |
| 6. | Moro F, Levenez F, Durual S, Plaisancié P, Thim L, Giraud AS, Cuber JC. Secretion of the trefoil factor TFF3 from the isolated vascularly perfused rat colon. Regul Pept. 2001;101:35-41. [PubMed] [DOI] |
| 7. | Lin J, Nadroo AM, Chen W, Holzman IR, Fan QX, Babyatsky MW. Ontogeny and prenatal expression of trefoil factor 3/ITF in the human intestine. Early Hum Dev. 2003;71:103-109. [PubMed] [DOI] |
| 8. | Shirazi T, Longman RJ, Corfield AP, Probert CS. Mucins and inflammatory bowel disease. Postgrad Med J. 2000;76:473-478. [PubMed] [DOI] |
| 9. | Xia B, Han H, Zhang KJ, Li J, Guo GS, Gong LL, Zeng XC, Liu JY. Effects of low molecular weight heparin on platelet surface P-selectin expression and serum interleukin-8 production in rats with trinitrobenzene sulphonic acid-induced colitis. World J Gastroenterol. 2004;10:729-732. [PubMed] [DOI] |
| 10. | Porter SN, Howarth GS, Butler RN. An orally administered growth factor extract derived from bovine whey suppresses breath ethane in colitic rats. Scand J Gastroenterol. 1998;33:967-974. [PubMed] [DOI] |
| 11. | Bobin-Dubigeon C, Collin X, Grimaud N, Robert JM, Le Baut G, Petit JY. Effects of tumour necrosis factor-alpha synthesis inhibitors on rat trinitrobenzene sulphonic acid-induced chronic colitis. Eur J Pharmacol. 2001;431:103-110. [PubMed] [DOI] |
| 12. | Fabia R, Ar'Rajab A, Johansson ML, Willén R, Andersson R, Molin G, Bengmark S. The effect of exogenous administration of Lactobacillus reuteri R2LC and oat fiber on acetic acid-induced colitis in the rat. Scand J Gastroenterol. 1993;28:155-162. [PubMed] [DOI] |
| 13. | Grisham MB, Volkmer C, Tso P, Yamada T. Metabolism of trinitrobenzene sulfonic acid by the rat colon produces reactive oxygen species. Gastroenterology. 1991;101:540-547. [PubMed] [DOI] |
| 14. | Yu K, Jiang SF, Lin MF, Wu JB, Lin J. Extraction and purification of biologically active intestinal trefoil factor from human meconium. Lab Invest. 2004;84:390-392. [PubMed] [DOI] |
| 15. | Blanchard C, Durual S, Estienne M, Bouzakri K, Heim MH, Blin N, Cuber JC. IL-4 and IL-13 up-regulate intestinal trefoil factor expression: requirement for STAT6 and de novo protein synthesis. J Immunol. 2004;172:3775-3783. [PubMed] [DOI] |