修回日期: 2004-04-29
接受日期: 2004-05-11
在线出版日期: 2004-09-15
目的: 评价人大肠癌组织肝细胞生长因子(HGF)及其受体c-met的mRNA表达水平.
方法: 应用RT-PCR法检测人大肠癌组织中肝细胞生长因子及其受体c-met mRNA表达水平, 以正常大肠组织为对照.
结果: 大肠癌组织中肝细胞生长因子及其受体c-met mRNA过度表达(其中HGFmRNA表达1.063±0.179, c-metmRNA表达1.128±0.173, 对照组表达0.576±0.052), c-met表达与大肠癌分化程度(P<0. 05)、有无淋巴结转移(P<0. 05)有关.
结论: 肝细胞生长因子及其受体c-met mRNA表达与大肠癌有关, 高表达c-met组分化程度差, 淋巴结转移多, 更具浸润、转移潜能.
引文著录: 李宏武, 单吉贤. 人大肠癌组织肝细胞生长因子及其受体c-met的表达. 世界华人消化杂志 2004; 12(9): 2199-2201
Revised: April 29, 2004
Accepted: May 11, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2199-2201
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2199.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2199
大肠癌(colorectal carcinoma, CRC)是人类最常见的恶性肿瘤之一, 也是我省常见多发病, 占西方国家癌症死亡病因的第二位. 而且, 大肠癌肝脏转移率约为15-20%, 手术是治疗大肠癌最有效的手段, 根治切除率可达60%, 但仍有许多病例复发、转移, 严重危害广大患者的生命健康. C-met是原癌基因, 他的蛋白产物是肝细胞生长因子/离散因子(Hepatocyte growth factor/scatter factor, HGF/SF)的受体, 具有酪氨酸激酶活性, HGF/SF与其受体特异结合, 引起一系列跨膜信号通路的激活, 刺激上皮细胞的增生、迁移和形态发生. C-met基因异常在恶性肿瘤中多表现为过度表达, 在胃癌[1], 胰腺癌[2], 甲状腺癌[3], 肝外胆道癌[4], 肝细胞癌[5]中已有报告. 研究表明HGF/SF及其受体c-met在恶性肿瘤的发生、浸润、转移中发挥作用. 本实验我们采用半定量逆转录-聚合酶链反应(RT-PCR)技术研究肝细胞生长因子及其受体在大肠癌组织中的表达规律, 以探讨HGF/SFc-met与大肠癌细胞增生、浸润、转移的关系.
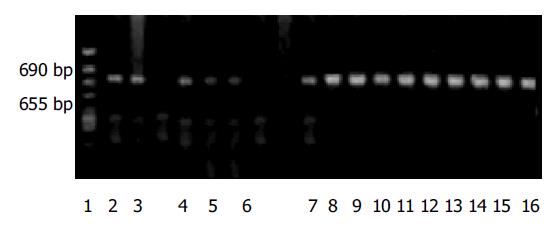
2003-07/2003-10手术切除并经病理证实为进展期大肠癌40例, 男24例, 女16例; 年龄30-76(平均53)岁, 其中高分化21例(52.5%), 中分化7例(17.5%), 低分化12例(30%); DukesA期4例(10%), B期22例(55%), C和D期14例(35%); 病变在升结肠6例(15%), 横结肠5例(12. 5%), 降结肠2例(5%), 乙状结肠9例(22.5%), 直肠18例(45%). 每例标本手术切除后立即取约200 mg, 同时取配对肠黏膜组织(距离肿瘤边缘3 cm以上), 正常大肠组织作为对照, 所有标本置于-80 ℃深低温冰箱中保存备用. RT-PCR试剂盒Ver1.1购于Takara公司; HGF, c-met, β-actin引物由北京奥科公司合成, 扩增片断大小分别为: 539 bp, 655 bp, 690 bp, 用β-actin基因作内对照扩增; Trizol试剂购于华美生物工程公司; 自动电泳凝胶成像分析仪为Olympus公司产品;PCR扩增仪PTC-100TM是美国PE公司产品; 低温超速离心机为德国HermleZ383k产品.
RT-PCR法检测大肠癌组织中HGFmRNA, c-metmRNA的表达. 总RNA提取参照Chomczynski et al[6]的异硫氰酸胍-酚-抽提一步法, 标本加入异硫氰酸胍裂解液后, 依次用酚、氯仿抽提, 异丙醇沉淀RNA, 乙醇洗涤沉淀, 紫外分光光度计检测RNA纯度及浓度. 引物序列如下: HGF/SF: sense, 5'-CAGCGTTGGGAT TCTCAGTAT-3' antisense, 5'-CCTATGTTTGTTCG TGTTGGA-3' c-met:sense, 5'-ACAGTGCATGTCA ACATCGCT-3'antisense: 5'-GCTCGGTAGTCTACAG ATT-3'β-actin: sense, 5'-GATTGCCTCAGGACATTT CTG-3'antisense: 5'-GATTGCTCAGGACATTTCTG-3'逆转录反应: 65 ℃ 1 min, 30-60 ℃ 20 min, 65℃ 30 min, 98 ℃ 5 min, 5 ℃ 5 min. PCR扩增参照试剂盒说明书操作, 循环条件: 94 ℃ 3 min, 94 ℃ 1 min, 60 ℃ 1 min, 72 ℃ 2 min, 72 ℃ 7 min, 循环45个周期. 使用含有溴化已啶的20 g/L琼脂糖凝胶电泳分析PCR产物, PCR电泳带存入1Dkodak凝胶成像分析系统, 以β-actin为参照标化HGF, c-met的mRNA含量, 计算灰度值, 灰度值=检测值/β-actin值×100%.
统计学处理 所得数据以均数±标准差表示, 采用SPSS12.0统计软件处理, 样本均数比较采用Dunnett t检验; 两样本率的比较用χ2检验, P <0.05判定差异有显著性.
RT-PCR扩增后HGF产物为539 bp, c-met为655 bp, β-actin为690 bp(图1, 2).以正常组织为对照, 其相对含量95%的可信区间为0.530-0.604, 当所测mRNA值/β-actin值>0.61为阳性表达. 40例大肠癌中, HGF/SF阳性表达21例(52.5%), c-met阳性表达32例(80.0%); 配对癌旁组织中HGF/SF阳性表达20例(50.0%), c-met阳性表达8例(20%)对照组均为阴性表达. 与对照组(0.576±0.052)比较, 大肠癌组织中HGFmRNA(1.063±0.179), c-metmRNA(1.128±0.173)表达有统计意义(P <0.05).
肝细胞生长因子(HGF/SF), 亦称离散因子, 是调节细胞、组织生命活动的多效作用分子, 能增强正常细胞和癌细胞的移动性[7],也是潜在的肝细胞[8]、胰腺细胞[9]、内皮细胞[10]的生长刺激因子, 也发挥血管形成因子的作用. HGF/SF是多效作用的生长因子, 可以诱导多种上皮细胞, 是上皮细胞形态发生的间叶细胞效应因子[11]. 体外实验表明, HGF/SF可以诱导增生、扩散、浸润和形态发生, 体内分析中, HGF/SF负责成人胚胎发生并参与多种活性调节, 这些活性与他在肿瘤形成和转移中的作用有关[12]. 1991年Battaro et al[13]首次报道了HGF/SF和c-met的关系, 原癌基因c-met的蛋白产物是HGF的酪氨酸受体, HGF与他的受体结合, 使受体酪氨酸激酶磷酸化, 引起细胞有丝分裂、形态发生等生物学效应. 体外实验中, HGF能够诱导表达c-met的靶细胞多种作用, 包括细胞增生、侵袭、转移等[14]. HGF受体是c-met原癌基因编码的酪氨酸激酶受体, 已发现c-met在胃癌、甲状腺癌、乳癌等 [1,3,15]实体瘤中有过度表达. 本结果表明, HGF在大肠癌中表达率为52.5%, 与正常组比较有差异, 但我们发现HGFmRNA表达与大肠癌相关病理因素无关, 这提示HGF可能通过旁分泌途径影响大肠癌的发生、发展. 我们的资料显示, 癌组织中c-metmRNA表达多, 癌旁组织中表达较低, 正常组中无表达. 如果以大肠癌组中平均表达值为界, 将c-met癌基因表达值分为高表达和低表达组表明, 高表达组分化低, 淋巴结转移多, 说明浸润转移机会更大. 提示高表达c-met的大肠癌病例, HGF促进癌细胞的运动, 并可能诱导转移的发生.
总之, c-met在大肠癌中有过度表达, HGF/SF-c-met系统在大肠癌浸润、转移中可能起重要作用. 对他们的不断深入研究有助于阐明大肠癌发生、发展的分子机制, 对大肠癌的防治亦有重要意义. 例如, 阻断HGF/SF诱导的信号通路可以抑制癌细胞的增生、迁移, 从而达到控制癌转移的目的, 该方面的相关研究将对人类攻克癌症有非常重要的意义.
| 1. | Amemiya H, Kono K, Itakura J, Tang RF, Takahashi A, An FQ, Kamei S, Iizuka H, Fujii H, Matsumoto Y. c-Met expression in gastric cancer with liver metastasis. Oncology. 2002;63:286-296. [PubMed] [DOI] |
| 2. | La Rosa S, Uccella S, Capella C, Erba S, Sessa F. Localization of Hepatocyte Growth Factor and Its Receptor met in Endocrine Cells and Related Tumors of the Gut and Pancreas: An Immunohistochemical Study. Endocr Pathol. 2000;11:315-329. [PubMed] [DOI] |
| 3. | de Luca A, Arena N, Sena LM, Medico E. Met overexpression confers HGF-dependent invasive phenotype to human thyroid carcinoma cells in vitro. J Cell Physiol. 1999;180:365-371. [PubMed] [DOI] |
| 4. | Hida Y, Morita T, Fujita M, Miyasaka Y, Horita S, Fujioka Y, Nagashima K, Katoh H. Clinical significance of hepatocyte growth factor and c-Met expression in extrahepatic biliary tract cancers. Oncol Rep. 1999;6:1051-1056. [PubMed] |
| 5. | Ueki T, Fujimoto J, Suzuki T, Yamamoto H, Okamoto E. Expression of hepatocyte growth factor and its receptor c-met proto-oncogene in hepatocellular carcinoma. Hepatology. 1997;25:862-866. [PubMed] [DOI] |
| 6. | Chomczynski P, Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal Biochem. 1987;162:156-159. [PubMed] [DOI] |
| 7. | Jiang WG, Lloyds D, Puntis MC, Nakamura T, Hallett MB. Regulation of spreading and growth of colon cancer cells by hepatocyte growth factor. Clin Exp Metastasis. 1993;11:235-242. [PubMed] [DOI] |
| 8. | Nakamura T, Nawa K, Ichihara A. Partial purification and characterization of hepatocyte growth factor from serum of hepatectomized rats. Biochem Biophys Res Commun. 1984;122:1450-1459. [PubMed] [DOI] |
| 9. | Vilá MR, Nakamura T, Real FX. Hepatocyte growth factor is a potent mitogen for normal human pancreas cells in vitro. Lab Invest. 1995;73:409-418. [PubMed] |
| 10. | Rosen EM, Meromsky L, Setter E, Vinter DW, Goldberg ID. Purified scatter factor stimulates epithelial and vascular endothelial cell migration. Proc Soc Exp Biol Med. 1990;195:34-43. [PubMed] [DOI] |
| 11. | Brinkmann V, Foroutan H, Sachs M, Weidner KM, Birchmeier W. Hepatocyte growth factor/scatter factor induces a variety of tissue-specific morphogenic programs in epithelial cells. J Cell Biol. 1995;131:1573-1586. [PubMed] [DOI] |
| 12. | Zhang YW, Vande Woude GF. HGF/SF-met signaling in the control of branching morphogenesis and invasion. J Cell Biochem. 2003;88:408-417. [PubMed] [DOI] |
| 13. | Bottaro DP, Rubin JS, Faletto DL, Chan AM, Kmiecik TE, Vande Woude GF, Aaronson SA. Identification of the hepatocyte growth factor receptor as the c-met proto-oncogene product. Science. 1991;251:802-804. [PubMed] [DOI] |
| 14. | Webb CP, Taylor GA, Jeffers M, Fiscella M, Oskarsson M, Resau JH, Vande Woude GF. Evidence for a role of Met-HGF/SF during Ras-mediated tumorigenesis/metastasis. Oncogene. 1998;17:2019-2025. [PubMed] [DOI] |
| 15. | Parr C, Watkins G, Mansel RE, Jiang WG. The hepatocyte growth factor regulatory factors in human breast cancer. Clin Cancer Res. 2004;10:202-211. [PubMed] [DOI] |