修回日期: 2004-05-02
接受日期: 2004-05-09
在线出版日期: 2004-09-15
目的: 研究三叶因子1在人胃黏膜中的表达及存在的分子形式, 探讨其胃黏膜保护作用的分子生物学机制.
方法: 采用western-blot方法观察三叶因子1在人胃黏膜中的存在形式, 并采用免疫组化方法了解三叶因子1在胃黏膜中的定位, 比较其在胃溃疡周边及距周边5 cm外胃黏膜中的表达改变.
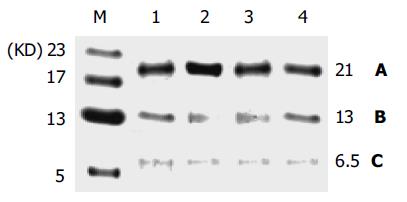
结果: (1)三叶因子1在人胃黏膜中以三种形式存在: 单聚体、二聚体及一种分子量约为21 kDa的TFF1与某种分子结合而成的复合物, 其中, TFF1复合物的含量最高. (2)三叶因子1主要在人胃体及胃窦黏膜上皮表面细胞胞质中表达, 核周聚集较明显, 越靠近腔面的细胞表达越强. (3)三叶因子1在胃溃疡周边黏膜的表达明显高于距溃疡周边5 cm外的黏膜(P<0.001).
结论: 三叶因子1主要在人胃体及胃窦黏膜上皮表面细胞胞质中表达, 其与某种分子结合形成的复合物是TFF1在胃黏膜中存在的主要形式, 这种TFF1复合物可能比TFF1单聚体及二聚体有更强的生物活性. TFF1在胃溃疡周边黏膜表达高于距溃疡周边5 cm外的黏膜, 说明其在胃黏膜保护及修护方面具有重要的作用.
引文著录: 任建林, 罗金燕, 卢雅丕, 王琳, 陈建民, 刘明, 施华秀. 三叶因子1在胃黏膜中的表达及存在的分子形式. 世界华人消化杂志 2004; 12(9): 2186-2188
Revised: May 2, 2004
Accepted: May 9, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2186-2188
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2186.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2186
TFF1是三叶因子家族成员之一. 三叶因子家族(trefoil factor family, TFF)是一群主要由胃肠道黏液细胞分泌的小分子多肽. 在正常组织中, TFF1主要在胃体及胃窦黏膜上皮表面细胞表达, 当胃肠道黏膜发生损伤时, 这种表达专一性消失, 他可在整个胃肠黏膜损伤部位表达, 且较正常黏膜表达明显升高. 本组试验将观察三叶因子1在人胃黏膜中的存在形式, 了解三叶因子1在胃黏膜中的定位, 比较其在胃溃疡周边及距周边5 cm外胃黏膜中的表达改变.
选取厦门大学医学院第一临床学院2003-06/2003-11期间行胃镜检查的患者80例, 均因腹痛、腹胀就诊行胃镜检查. 其中, 胃镜下未见胃及十二指肠黏膜有异常病变, 病理显示大致正常胃黏膜者42例, 取胃窦部黏膜2块液氮冻存; 胃溃疡患者38例, 取溃疡周边及距溃疡周边5 cm外黏膜各1块立即放入10%甲醛溶液中固定.
羊抗人TFF1多克隆抗体(一抗)及羊二抗(western blot用)购自北京中杉金桥生物技术有限公司, EDTA、SDS、b-mercaptoethanol购自Sigma公司, 丙烯酰胺、N, N-甲叉双丙烯酰胺、蛋白测定液、NC膜等购自Bio-Rad公司, ECL western blotting reagents购自Amersham公司, 鼠抗人TFF1单克隆抗体(免疫组化用)、S-P超敏试剂盒及DAB显色试剂盒购自福州迈新生物技术开发公司.
(1)Western blot: 将正常胃黏膜组织加入4 ℃预冷的匀浆缓冲液 (0.2 mmol/L蔗糖, 10 mmol/L Tris, 1.5 mmol/L EDTA, 20 mmol/L b-mercaptoethanol, 1% PMSF, 1% DTT)中, 充分匀浆后提取总蛋白, 测定蛋白浓度. 每个样品取120 ug蛋白质加入等体积加样缓冲液, 100℃煮沸5 min, 加样后于聚丙烯酰胺凝胶电泳(5%积层胶, 20%分离胶)分离蛋白. 积层胶电压70 V, 分离胶电压120 V, 电泳时间约5 h. 采用湿式转移法, 在冰浴中250 mA电转移90 min. 电转后的NC膜于封闭液中室温封闭30 min, 在1: 200一抗中室温孵育3 h, PBS-T洗膜, 加1:4000二抗孵育3 h, PBS-T洗膜, 暗室中ECL曝光显影. (2)免疫组化: 胃溃疡周边及距周边5 cm外黏膜经10%甲醛固定, 常规脱水、透明、渗蜡、包埋, 制成4 mm厚连续切片. 常规脱蜡至水, 采用SP法染色, DAB显色, 苏木素复染, 吹干, 具体操作按照S-P试剂盒说明书进行.
统计学处理 采用SPSS10.0统计分析软件进行分析, 实验数据以mean±SD表示, 采用t检验.
单聚体(6.5 kDa)、二聚体(13 kDa)及一种分子量约为21kDa的TFF1与某种分子结合而成的复合物, 其中, TFF1复合物的含量最高, 二聚体次之, 单聚体含量甚微(图1).
每张切片于100×高倍镜下显微照相, 阳性细胞胞质为棕黄色, 随机选取20个腺体, 采用Motic Images Advanced 3.0 图像分析软件检测其阳性信号平均光密度值以反映TFF1表达的强弱, 光密度值越高, TFF1的表达就越强. 三叶因子1主要在人胃体及胃窦黏膜上皮表面细胞胞质中表达, 核周聚集较明显, 越靠近腔面的细胞表达越强. 胃溃疡患者溃疡周边黏膜TFF1表达明显高于距溃疡周边5 cm外的黏膜, 二者差异具有显著性(0.51+0.06 vs 0.42+0.06, P <0.001).
三叶因子家族是一群主要由胃肠道黏液细胞分泌的小分子多肽. 目前在哺乳动物体内发现的三叶肽有3种, 即乳癌相关肽(the breast cancer- associated pS2 peptide, pS2/TFF1)、解痉多肽(spasmolytic polypeptide, SP/TFF2)和肠三叶因子(intestinal trefoil factor, ITF/TFF3). 3种三叶肽均含一特殊的P结构域, 由38-39个氨基酸通过6个高度保守的半胱氨酸残基经由3个分子内的二硫键相互联接, 使整个肽链扭曲、折叠形成三叶状结构, 由此命名. 国内外已有大量的实验证明, 三叶肽在胃肠道黏膜保护及修复中发挥了重要的作用.
TFF1是三叶因子家族成员之一, 于1982年由Masiakowski et al[1]在雌激素诱导的人乳腺癌细胞系MCF-7中获得. 每个TFF1分子由60个氨基酸组成, 分子量为6 674 Da, 含有7个半胱氨酸残基, 6个参与构成P结构域, 第7个半胱氨酸残基位于距羧基末端第3个碱基处, 即Cys58(图2). Chadwick et al用Ser58代替重组TFF1的Cys58, 将TFF1及含有Ser58的TFF1类似物, 经过平衡超速离心(equilibrium ultracentrifugation)、凝胶过滤、聚丙烯酰胺凝胶电泳及质谱分析, 发现TFF1形成同源二聚体, 而含Ser58的TFF1类似物则无法形成二聚体, 提示TFF1是通过Cys58形成分子间二硫键而构成二聚体的[2]. 本研究发现, TFF1在正常胃黏膜中存在3种分子形式: 单聚体(6.5 kDa)、二聚体(13 kDa)及一种分子量约为21 kDa的TFF1复合物. 其中, TFF1复合物的含量最高, 二聚体次之, 单聚体含量甚微, 表明TFF1生物活性的激活可能与同源二聚体的形成或与其他蛋白结合形成低聚体有关.
三叶肽的胃黏膜保护作用机制目前有2种假说: (1) 与黏液中的糖蛋白结合形成稳定的凝胶复合物, 加强黏液凝胶层, 减少胃表面有害物质及机械应力等因素对黏膜的损伤. 体内、外研究发现, 三叶肽可提高黏液凝胶层的黏性, 降低H+穿透胃黏液凝胶层的能力, 减少胃黏膜损伤[3]. (2) 三叶肽可能通过与其受体或转运蛋白结合而发挥生理功能. 寻找这种可能的受体或转运蛋白并探索其作用机制, 是当今国际上三叶肽研究的一大热点[4-6]. 本研究发现的TFF1复合物, 可能就是TFF1与其受体/转运蛋白或某种糖蛋白结合的复合物. 只是, 目前多位学者所发现的与三叶因子相结合的分子各不相同, 考虑原因: (1)实验条件的影响; (2)三叶肽可与多种分子结合; (3)与三叶肽结合的分子结构极不稳定, 各位学者所发现的分子都只是该分子的一部分. 究竟是何种原因所致, 目前尚无统一意见, 而寻找三叶因子家族的受体或转运蛋白的研究亦无法获得突破性的进展.
在人正常组织中, TFF1主要在胃体及胃窦黏膜上皮表面细胞表达, 但在病理条件下, 这种表达专一性消失[7-8], 他可在胃肠道黏膜损伤部位表达[9], 且在损伤部位的表达较正常黏膜明显升高. 我们已经发现, TFF1在人消化性溃疡、胃炎、胃癌旁黏膜及阿斯匹林诱导的兔应激性溃疡黏膜中的表达均较正常状态下明显升高[10-11]. 在本研究中, 我们进一步检测了同一患者胃溃疡周边及距溃疡周边5 cm外黏膜中TFF1的表达情况, 发现后者表达显著高于前者, 提示TFF1在胃黏膜保护及消化性溃疡修复方面具有重要的作用. 三叶因子是一种运动因子, 能与表皮生长因子(EGF)及转化生长因子α(TGF-α)协同作用, 参与损伤组织的上皮重建过程, 即促进受损黏膜周围完好的上皮细胞向损伤黏膜表面迁移覆盖, 促进损伤黏膜的修复, 但并不促进细胞分裂[12]. 许多学者研究发现, 在胃肠道慢性溃疡(如Crohn's病、溃疡性结肠炎、胃十二指肠溃疡等)周围有一种溃疡相关细胞系(ulcer associated cell lineage, UACL), 在此细胞系中三叶因子表达明显上调, 且与黏液素的表达明显相关[13]. 最近有研究表明, TFF1可通过延迟细胞从G1期向S期转变参与胃肠道细胞分化过程, 减少细胞凋亡(14). 另有学者研究发现缺乏TFF2大鼠的胃黏膜中, 活性壁细胞数目及胃酸分泌量升高2倍, 且NSAID所诱导的胃溃疡损伤级别明显升高[15], 说明三叶因子在抑制胃酸分泌方面亦有一定的作用.
三叶因子具有胃黏膜保护与上皮重建作用, 这使其具有重要的药理学价值. 国外有学者采用口服、皮下或静脉内给药的方式, 发现三叶因子蛋白对NSAID类药物诱导的鼠胃黏膜损伤具有明显的预防及治疗作用[15-17], 这为可能的生物制药提供了依据, 为消化性溃疡、胃炎、及炎症性肠病等胃肠黏膜损伤性疾病的预防和治疗开辟了一条新的途径. 只是, 其作用的分子生物学机制目前尚不明确, 需进一步研究探讨.
| 1. | Masiakowski P, Breathnach R, Bloch J, Gannon F, Krust A, Chambon P. Cloning of cDNA sequences of hormone-regulated genes from the MCF-7 human breast cancer cell line. Nucleic Acids Res. 1982;10:7895-7903. [PubMed] [DOI] |
| 2. | Chadwick MP, Westley BR, May FE. Homodimerization and hetero-oligomerization of the single-domain trefoil protein pNR-2/pS2 through cysteine 58. Biochem J. 1997;327:117-123. [PubMed] [DOI] |
| 3. | Ribieras S, Tomasetto C, Rio MC. The pS2/TFF1 trefoil factor, from basic research to clinical applications. Biochim Biophys Acta. 1998;1378:F61-F77. [PubMed] [DOI] |
| 4. | Tanaka S, Podolsky DK, Engel E, Guth PH, Kaunitz JD. Human spasmolytic polypeptide decreases proton permeation through gastric mucus in vivo and in vitro. Am J Physiol. 1997;272:G1473-G1480. [PubMed] |
| 5. | Thim L, Mørtz E. Isolation and characterization of putative trefoil peptide receptors. Regul Pept. 2000;90:61-68. [PubMed] [DOI] |
| 6. | Tan XD, Hsueh W, Chang H, Wei KR, Gonzalez-Crussi F. Characterization of a putative receptor for intestinal trefoil factor in rat small intestine: identification by in situ binding and ligand blotting. Biochem Biophys Res Commun. 1997;237:673-677. [PubMed] [DOI] |
| 7. | Newton JL, Allen A, Westley BR, May FE. The human trefoil peptide, TFF1, is present in different molecular forms that are intimately associated with mucus in normal stomach. Gut. 2000;46:312-320. [PubMed] [DOI] |
| 9. | Pera M, Heppell J, Poulsom R, Teixeira FV, Williams J. Ulcer associated cell lineage glands expressing trefoil peptide genes are induced by chronic ulceration in ileal pouch mucosa. Gut. 2001;48:792-796. [PubMed] [DOI] |
| 10. | 任 建林, 卢 雅丕, 王 琳, 陈 建民, 施 华秀, 叶 震世, 吴 艳环, 钟 燕, 林 逊汀, 林 辉. TFF1在正常及损伤胃黏膜中的表达改变. 世界华人消化杂志. 2003;11:1809-1810. [DOI] |
| 11. | 任 建林, 卢 雅丕, 陈 建民, 王 琳, 叶 震世, 施 华秀, 吴 艳环, 钟 燕, 罗 金燕. 三叶因子1表达与胃黏膜损伤及胃癌的关系. 中华消化杂志. 2003;23:671-673. |
| 13. | Longman RJ, Douthwaite J, Sylvester PA, Poulsom R, Corfield AP, Thomas MG, Wright NA. Coordinated localisation of mucins and trefoil peptides in the ulcer associated cell lineage and the gastrointestinal mucosa. Gut. 2000;47:792-800. [PubMed] [DOI] |
| 14. | Bossenmeyer-Pourié C, Kannan R, Ribieras S, Wendling C, Stoll I, Thim L, Tomasetto C, Rio MC. The trefoil factor 1 participates in gastrointestinal cell differentiation by delaying G1-S phase transition and reducing apoptosis. J Cell Biol. 2002;157:761-770. [PubMed] [DOI] |
| 15. | Farrell JJ, Taupin D, Koh TJ, Chen D, Zhao CM, Podolsky DK, Wang TC. TFF2/SP-deficient mice show decreased gastric proliferation, increased acid secretion, and increased susceptibility to NSAID injury. J Clin Invest. 2002;109:193-204. [PubMed] [DOI] |
| 16. | Cook GA, Thim L, Yeomans ND, Giraud AS. Oral human spasmolytic polypeptide protects against aspirin-induced gastric injury in rats. J Gastroenterol Hepatol. 1998;13:363-370. [PubMed] [DOI] |