修回日期: 2004-06-09
接受日期: 2004-06-17
在线出版日期: 2004-09-15
胃肠富集Kruppel样因子(GKLF)是一种新发现的真核锌指蛋白转录因子. 他通过调节其下游目标基因的转录表达而在细胞周期调控、细胞的增生分化中担任重要的角色, 他可能与肿瘤发生、发展有着密切的联系. 现就GKLF的结构、调节、功能及其与肿瘤的关系等方面的研究进展做一综述.
引文著录: 洪媛, 刘芝华. 胃肠富集Kruppel样因子的研究进展. 世界华人消化杂志 2004; 12(9): 2150-2152
Revised: June 9, 2004
Accepted: June 17, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2150-2152
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2150.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2150
转录因子是一类具有重要功能的序列特异性DNA结合蛋白, 他们通过激活或抑制其目标基因的转录来调控基因的时相性及细胞和组织的特异性表达, 而在细胞生长、分化、凋亡等生理过程的调节中担任重要的角色. 胃肠富集Kruppel样因子(Gut-enriched Kruppel like factor, GKLF, KLF4)是一种新发现的真核锌指蛋白转录因子, 他是Kruppel样转录因子家族的成员之一. 最初(1996年)是从小鼠去血清处理的NIH3T3细胞cDNA 文库中获得该基因, 因其主要表达在消化道, 故得名为胃肠富集Kruppel样因子(GKLF)[1]. 稍后, 从人血管内皮细胞cDNA 文库中也克隆出该基因, 并因其主要表达在上皮细胞, 具有锌指蛋白结构, 也命名为表皮锌指因子(EZF). 人的GKLF基因定位于染色体9q31, 其cDNA编码区长度为1 413 bp, 编码一个由470个氨基酸残基组成的多肽[2]. 他在消化道, 口腔, 食管上皮, 皮肤表皮等处表达丰富[3], 在胸腺上皮[4]及血管内皮中也有一定水平的表达[2]. 通过研究表明, GKLF通过调节下游靶基因的转录表达而在细胞的周期调控、细胞的增生分化中担任重要的角色, 他可能与肿瘤发生发展有着密切的联系.
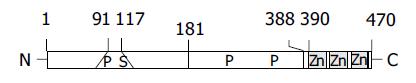
与一般的转录因子一样, GKLF含有一个DNA结合结构域和一个激活结构域. 其DNA结合结构域位于C末端, 含有三个锌指结构, 与Kruppel样家族成员中的LKLF和EKLF有着高度的同源性, 他也可通过结合基因启动子区的CACCC元件或SP1元件来调节其下游基因的转录活性[5]; 其激活结构域则位于N末端的第91-117氨基酸残基处, 富含脯氨酸和丝氨酸. 除此之外, 在其第181-388氨基酸残基处还含有一个富含脯氨酸残基的抑制性结构域. 因此, GKLF具有激活和抑制双重调节作用[2](图1). GKLF蛋白主要集中在细胞核内, 他含有两个有效的核定位信号: 一个位于锌指结构的氨基端, 另一个则存在于第一个锌指结构域的前方并与之紧密相邻. 实验表明, 这两个核定位信号中的任何一个都能单独有效地将GKLF转移至核内[6].
GKLF的表达具有组织的特异性, 他主要在消化道, 口腔, 食管上皮及皮肤表皮等处表达. 在这些组织的上皮各层中, GKLF在基底层快速生长的细胞中表达很低, 而在上层分化成熟的细胞中表达较高. 目前对GKLF表达的调节机制了解甚少, 通过对GKLF基因上游的调控序列分析表明, 他含有SP1, AP1, CDX, GAPA, USF和GKLF自身的顺式反应元件, 提示他可受这些转录因子的调控[7]. 在体外培养的细胞中, 一些与细胞生长抑制有关的条件如血清饥饿, 接触抑制, DNA损伤能使GKLF的表达上调[1]. 在HT-29人结肠癌细胞系中, IFN-γ通过不依赖蛋白的从头合成途径快速地诱导GKLF的转录表达, 这种诱导作用与IFN-γ的剂量及作用时间成正相关[8], 并且依赖STAT1的磷酸化[9]. 另外, 在RKO人结肠癌细胞系中发现, APC可通过CDχ2激活GKLF启动子从而促进其转录表达[10], 提示GKLF可能是受APC, CDχ2调控的下游因子, 参与APC信号传导通路.
GKLF是近年新发现的一个转录因子, 他通过调节其下游目标基因的转录表达而影响细胞整体的生理功能. 迄今为止, 人们对GKLF生理功能还不甚了解, 只有少数的几个GKLF的下游目的基因被研究发现, 已被研究证实的有: GKLF可激活P21[11]、角蛋白4[12]、角蛋白19[13]及EBV ED-L2[12]基因的启动子, 而对细胞周期素Cyclin D1[14], b-球蛋白[2]及细胞色素P450 CYPIA1[15]启动子有抑制作用. 最初研究发现, 在一些抑制细胞生长的条件下如血清饥饿, 接触抑制及DNA损伤时GKLF的表达上调, 外源性GKLF表达可抑制DNA的合成[1]及细胞的生长[8]. 随后的研究发现, GKLF可直接激活细胞周期蛋白依赖激酶抑制因子P21的启动子而促使其转录表达. P21通过抑制细胞周期蛋白-细胞周期蛋白依赖激酶复合体如Cyclin D1-Cdk4, Cyclin E1-Cdk2, Cyclin A-Cdk2 而抑制细胞从G1期进入S期. DNA损伤时, GKLF对P21的诱导激活依赖于P53, GKLF基因的启动子区含有P53的结合元件, DNA损伤后P53表达的上调导致GKLF表达增加. 另外, P53还能与GKLF相互作用促进其对P21的诱导表达[11].
此外, 细胞周期循环中的另一重要因子Cyclin D1 也受GKLF的转录调控, Cyclin D1是细胞周期循环得以顺利进行的重要因子, 他通过与细胞周期依赖激酶结合从而促使细胞从G1期进入S 期. 这些结果表明GKLF通过调节其下游靶基因P21及Cyclin D1的表达而在G1/S 细胞周期检验点的调节中担任重要的角色. Yoon et al最近的研究还发现, GKLF能通过与Cyclin B1启动子中特殊的富含GC的元件结合而抑制其转录活性. Cyclin B1在细胞从G2期进入M期过程中起着重要的作用. 这表明GKLF还在维持G2/M细胞周期检验点的完整性中担任着重要的作用[16].
鉴于GKLF主要在胃肠上皮及皮肤表皮中表达, 尤其是其表达主要集中在分裂后终末分化的上皮中, 因此人们推测其可能在与细胞分化相关的基因表达调节中担任着重要的角色. 通过小鼠基因敲除实验发现, GKLF基因缺失的小鼠尽管其皮肤的组织学特征没有明显的变化, 但皮肤的通透性明显增高, 并致新生小鼠脱水死亡, 这表明GKLF是皮肤屏障的必须成分[17]. Katz et al[18]研究发现GKLF基因缺失的小鼠, 其肠上皮中杯状细胞明显缺乏而其他类型的细胞均正常, 这结果表明GKLF在肠道上皮杯状细胞的分化成熟中起重要的作用. 此外, GKLF可调节一些与分化相关的基因如角蛋白4、角蛋白19和Lama1[19]. 所有的这些结果表明GKLF在细胞的分化中可能担任着重要的角色. 最近Chen et al[20]利用cDNA微阵列分析发现, 在对GKLF进行诱导表达的RKO细胞中, 有84个基因发生明显的上调, 有107个基因发生明显的下调. 在这些基因中很大一部份是和细胞周期调控有关的基因. 其中上调的有P21、P57KIP、IGFBP6及SFN等抑制细胞周期循环的基因, 下调的有Cyclin D1、 CDC2/CDK1、KIA及MCM2等促进细胞周期循环的基因. 在上调的基因中还包括9个角质蛋白在内的与分化相关的基因. 这些结果进一步表明GKLF通过调节一些细胞周期调控及分化有关基因的表达而在细胞的增生、分化及周期调控中担任重要的角色.
肿瘤的一个显著的生物学特征是细胞的过度增生和异常分化, 而GKLF在细胞的增生及分化中担任着重要的角色, 因此他可能与肿瘤的发生发展有着密切的联系. 在小鼠自发性胃肠道肿瘤模型中, 其在肿瘤发生期的胃肠上皮中表达下调. 在MIN鼠中, GKLF的表达随着肿瘤的增大而降低[21], 在人FAP患者的结肠腺瘤中GKLF表达下调[22]. 同样在散发性结肠腺瘤及结肠癌中GKLF的表达也明显下调[23], 除了在这些胃肠道的肿瘤中表达下调外, 最近研究发现他还在膀胱癌[24]及食管癌[25]中表达下调.
目前对于其在这些肿瘤中表达下调的机制了解甚少. 在结肠癌的研究中表明, GKLF的甲基化并非是引起GKLF下调的原因, 而CDχ2的异常表达可能参与这些肿瘤组织GKLF的下调. 鉴于MIN鼠及FAP患者是由于抑癌基因APC功能的丢失所致, 而在MIN鼠及FAP患者腺瘤中GKLF表达明显下调, 因此人们推测GKLF可能受抑癌因子APC的调节. Dang et al[10]的研究发现, APC诱导GKLF的表达, 而这种诱导依赖于有功能的CDχ2对GKLF启动子激活的能力, 而以前的研究已证实CDχ2是受APC激活的. 因此, Dang et al[10]认为这三个蛋白可能构成一个肠细胞特异的肿瘤抑制通路的一部分: APC→CDχ2→GKLF→生长抑制. 因此, 在正常的肠上皮分化成熟过程中, 当肠上皮细胞转移至肠绒毛处并失去其扩增潜力进行分化时, 这条通路就有可能被激活. 有趣的是, 在调控基因转录和细胞扩增方面与GKLF、CDχ2功能相反的蛋白KLF5、CDX1, 主要在肠基底部具有增生扩增潜力的细胞中表达[26-29]. 此外, Wnt, 作为原癌基因的产物, 在b-catenin的调控方面与APC有着相反的作用, 他能上调cdx1而不是cdχ2的表达[30]. 鉴于以上这些, 这些蛋白可能形成一个相互作用的网络来调节肠上皮基底层细胞的增生与上层细胞的分化, 死亡之间的动态平衡, 因此这些蛋白的异常就会打破这种平衡, 从而导致肿瘤的发生. 这表明GKLF不但能调节肠的生长与分化, 还能在其肿瘤的发生发展中起一定的作用.
GKLF在肿瘤中的表达具有类型特异性, 他在结肠等肿瘤中表达下调, 但在口腔上皮异常增生, 口腔癌及乳腺癌[31]中, GKLF却在其全层上皮过度弥漫表达. 目前对于GKLF在这些肿瘤中表达上调的具体机制还不了解, 有待于进一步的研究.
| 1. | Shields JM, Christy RJ, Yang VW. Identification and characterization of a gene encoding a gut-enriched Krüppel-like factor expressed during growth arrest. J Biol Chem. 1996;271:20009-20017. [PubMed] [DOI] |
| 2. | Yet SF, McA'Nulty MM, Folta SC, Yen HW, Yoshizumi M, Hsieh CM, Layne MD, Chin MT, Wang H, Perrella MA. Human EZF, a Krüppel-like zinc finger protein, is expressed in vascular endothelial cells and contains transcriptional activation and repression domains. J Biol Chem. 1998;273:1026-1031. [PubMed] [DOI] |
| 3. | Garrett-Sinha LA, Eberspaecher H, Seldin MF, de Crombrugghe B. A gene for a novel zinc-finger protein expressed in differentiated epithelial cells and transiently in certain mesenchymal cells. J Biol Chem. 1996;271:31384-31390. [PubMed] [DOI] |
| 4. | Panigada M, Porcellini S, Sutti F, Doneda L, Pozzoli O, Consalez GG, Guttinger M, Grassi F. GKLF in thymus epithelium as a developmentally regulated element of thymocyte-stroma cross-talk. Mech Dev. 1999;81:103-113. [PubMed] [DOI] |
| 5. | Shields JM, Yang VW. Identification of the DNA sequence that interacts with the gut-enriched Krüppel-like factor. Nucleic Acids Res. 1998;26:796-802. [PubMed] [DOI] |
| 6. | Shields JM, Yang VW. Two potent nuclear localization signals in the gut-enriched Krüppel-like factor define a subfamily of closely related Krüppel proteins. J Biol Chem. 1997;272:18504-18507. [PubMed] [DOI] |
| 7. | Mahatan CS, Kaestner KH, Geiman DE, Yang VW. Characterization of the structure and regulation of the murine gene encoding gut-enriched Krüppel-like factor (Krüppel-like factor 4). Nucleic Acids Res. 1999;27:4562-4569. [PubMed] [DOI] |
| 8. | Chen ZY, Shie J, Tseng C. Up-regulation of gut-enriched krüppel-like factor by interferon-gamma in human colon carcinoma cells. FEBS Lett. 2000;477:67-72. [PubMed] [DOI] |
| 9. | Chen ZY, Shie JL, Tseng CC. STAT1 is required for IFN-γamma-mediated gut-enriched Krüppel-like factor expression. Exp Cell Res. 2002;281:19-27. [PubMed] [DOI] |
| 10. | Dang DT, Mahatan CS, Dang LH, Agboola IA, Yang VW. Expression of the gut-enriched Krüppel-like factor (Krüppel-like factor 4) gene in the human colon cancer cell line RKO is dependent on CDχ2. Oncogene. 2001;20:4884-4890. [PubMed] [DOI] |
| 11. | Zhang W, Geiman DE, Shields JM, Dang DT, Mahatan CS, Kaestner KH, Biggs JR, Kraft AS, Yang VW. The gut-enriched Kruppel-like factor (Kruppel-like factor 4) mediates the transactivating effect of p53 on the p21WAF1/Cip1 promoter. J Biol Chem. 2000;275:18391-18398. [PubMed] [DOI] |
| 12. | Jenkins TD, Opitz OG, Okano J, Rustgi AK. Transactivation of the human keratin 4 and Epstein-Barr virus ED-L2 promoters by gut-enriched Krüppel-like factor. J Biol Chem. 1998;273:10747-10754. [PubMed] [DOI] |
| 13. | Brembeck FH, Rustgi AK. The tissue-dependent keratin 19 gene transcription is regulated by GKLF/KLF4 and Sp1. J Biol Chem. 2000;275:28230-28239. [PubMed] [DOI] |
| 14. | Shie JL, Chen ZY, Fu M, Pestell RG, Tseng CC. Gut-enriched Krüppel-like factor represses cyclin D1 promoter activity through Sp1 motif. Nucleic Acids Res. 2000;28:2969-2976. [PubMed] [DOI] |
| 15. | Zhang W, Shields JM, Sogawa K, Fujii-Kuriyama Y, Yang VW. The gut-enriched Krüppel-like factor suppresses the activity of the CYP1A1 promoter in an Sp1-dependent fashion. J Biol Chem. 1998;273:17917-17925. [PubMed] [DOI] |
| 16. | Yoon HS, Yang VW. Requirement of Krüppel-like factor 4 in preventing entry into mitosis following DNA damage. J Biol Chem. 2004;279:5035-5041. [PubMed] [DOI] |
| 17. | Segre JA, Bauer C, Fuchs E. Klf4 is a transcription factor required for establishing the barrier function of the skin. Nat Genet. 1999;22:356-360. [PubMed] [DOI] |
| 18. | Katz JP, Perreault N, Goldstein BG, Lee CS, Labosky PA, Yang VW, Kaestner KH. The zinc-finger transcription factor Klf4 is required for terminal differentiation of goblet cells in the colon. Development. 2002;129:2619-2628. [PubMed] |
| 19. | Piccinni SA, Bolcato-Bellemin AL, Klein A, Yang VW, Kedinger M, Simon-Assmann P, Lefebvre O. Kruppel-like factors regulate the Lama1 gene encoding the laminin alpha1 chain. J Biol Chem. 2004;279:9103-9114. [PubMed] [DOI] |
| 20. | Chen X, Whitney EM, Gao SY, Yang VW. Transcriptional profiling of Krüppel-like factor 4 reveals a function in cell cycle regulation and epithelial differentiation. J Mol Biol. 2003;326:665-677. [PubMed] [DOI] |
| 21. | Ton-That H, Kaestner KH, Shields JM, Mahatanankoon CS, Yang VW. Expression of the gut-enriched Krüppel-like factor gene during development and intestinal tumorigenesis. FEBS Lett. 1997;419:239-243. [PubMed] [DOI] |
| 22. | Dang DT, Bachman KE, Mahatan CS, Dang LH, Giardiello FM, Yang VW. Decreased expression of the gut-enriched Krüppel-like factor gene in intestinal adenomas of multiple intestinal neoplasia mice and in colonic adenomas of familial adenomatous polyposis patients. FEBS Lett. 2000;476:203-207. [PubMed] [DOI] |
| 23. | Shie JL, Chen ZY, O'Brien MJ, Pestell RG, Lee ME, Tseng CC. Role of gut-enriched Krüppel-like factor in colonic cell growth and differentiation. Am J Physiol Gastrointest Liver Physiol. 2000;279:G806-G814. [PubMed] |
| 24. | Ohnishi S, Ohnami S, Laub F, Aoki K, Suzuki K, Kanai Y, Haga K, Asaka M, Ramirez F, Yoshida T. Downregulation and growth inhibitory effect of epithelial-type Krüppel-like transcription factor KLF4, but not KLF5, in bladder cancer. Biochem Biophys Res Commun. 2003;308:251-256. [PubMed] [DOI] |
| 25. | Wang N, Liu ZH, Ding F, Wang XQ, Zhou CN, Wu M. Down-regulation of gut-enriched Kruppel-like factor expression in esophageal cancer. World J Gastroenterol. 2002;8:966-970. [PubMed] [DOI] |
| 26. | Adam PJ, Regan CP, Hautmann MB, Owens GK. Positive- and negative-acting Kruppel-like transcription factors bind a transforming growth factor beta control element required for expression of the smooth muscle cell differentiation marker SM22alpha in vivo. J Biol Chem. 2000;275:37798-37806. [PubMed] [DOI] |
| 27. | Conkright MD, Wani MA, Anderson KP, Lingrel JB. A gene encoding an intestinal-enriched member of the Krüppel-like factor family expressed in intestinal epithelial cells. Nucleic Acids Res. 1999;27:1263-1270. [PubMed] [DOI] |
| 28. | Silberg DG, Swain GP, Suh ER, Traber PG. Cdx1 and cdχ2 expression during intestinal development. Gastroenterology. 2000;119:961-971. [PubMed] [DOI] |
| 29. | Sun R, Chen X, Yang VW. Intestinal-enriched Krüppel-like factor (Krüppel-like factor 5) is a positive regulator of cellular proliferation. J Biol Chem. 2001;276:6897-6900. [PubMed] [DOI] |
| 30. | Lickert H, Domon C, Huls G, Wehrle C, Duluc I, Clevers H, Meyer BI, Freund JN, Kemler R. Wnt/(beta)-catenin signaling regulates the expression of the homeobox gene Cdx1 in embryonic intestine. Development. 2000;127:3805-3813. [PubMed] |
| 31. | Foster KW, Frost AR, McKie-Bell P, Lin CY, Engler JA, Grizzle WE, Ruppert JM. Increase of GKLF messenger RNA and protein expression during progression of breast cancer. Cancer Res. 2000;60:6488-6495. [PubMed] |