修回日期: 2004-06-09
接受日期: 2004-06-17
在线出版日期: 2004-09-15
目的: 利用转基因技术将HepG2细胞改建为具有生理性胰岛素分泌能力的"胰岛代理细胞".
方法: 以携葡萄糖激酶(glucokinase, gk)基因的逆转录病毒及携人胰岛素原基因突变体(mutant proinsulin gene, mpin)的逆转录病毒共同感染肝母细胞瘤细胞系HepG2, G418选择培养基挑选抗性细胞集落, 放免法、SDS-PAGE、Western-blot及反转录酶聚合酶链反应(RT-PCR)鉴定HepG2细胞中两个目的基因的转录及表达; 选取联合表达葡萄糖激酶及成熟胰岛素的HepG2细胞进行葡萄糖反应性胰岛素分泌的检测, 以单独表达成熟胰岛素的HepG2细胞作对照.
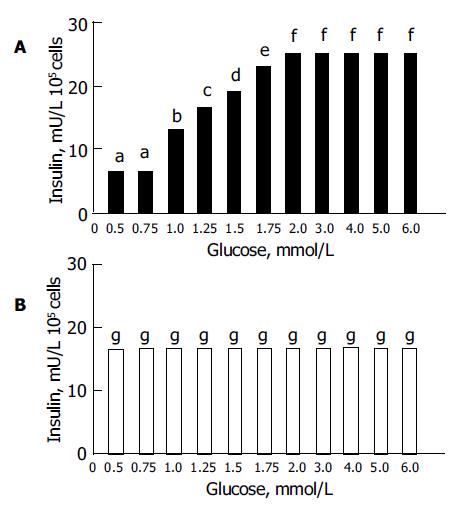
结果: 在G418选择培养基中3 wk获阳性细胞克隆, 采用放免法、SDS-PAGE、Western-blot从20个细胞克隆中挑选出联合表达葡萄糖激酶及成熟胰岛素的HepG2细胞4株, 其中1株2个目的基因表达均较强, 命名为细胞克隆"b"; 经RT-PCR检测证实细胞"b"中已有两个目的基因的转录. 在细胞"b"中, 葡萄糖浓度为0.5 mmol/L和0.75 mmol/L时, 胰岛素的分泌无显著性差异(P >0.05); 葡萄糖浓度为2.0 mmol/L, 3.0 mmol/L, 4.0 mmol/L, 5.0 mmol/L及6.0 mmol/L时, 胰岛素的分泌无显著性差异(P >0.05); 其余葡萄糖浓度条件下, 胰岛素的分泌差异均有显著性意义(P <0.05). 在单独表达胰岛素的HepG2细胞中, 各葡萄糖浓度条件下, 胰岛素的分泌均无显著性差异(P >0.05). 说明在细胞"b"中获得了葡萄糖反应性胰岛素分泌, 葡萄糖浓度约1.75-2 mmol/L时出现胰岛素分泌高峰.
结论: 成功构建了具有生理性胰岛素分泌能力的"胰岛代理细胞"系.
引文著录: 郑宏庭, 邓华聪, 兰丽珍, 方芳. "胰岛代理细胞"的构建: 在HepG2细胞中获得胰岛素分泌. 世界华人消化杂志 2004; 12(9): 2103-2106
Revised: June 9, 2004
Accepted: June 17, 2004
Published online: September 15, 2004
AIM: To construct an "artificial beta cell" which exhibit glucose-stimulated insulin secretion from a human hepatoma cell line.
METHODS: HepG2 cells were infected with recombinant retrovirus carrying glucokinase (gk) gene and mutant proinsulin (mpin) gene, then selectively cultured with G418 to obtain the positive clones. gk gene and mpin gene transcription and expression were identified by radio-immunity, SDS-PAGE, Western-blot and RT-PCR techniques. At last, we tested the dose-response effect of glucose on insulin secretion from the "artificial beta cell", and HepG2 cells with mpin gene transferred as control.
RESULTS: HepG2 cells with gk gene and mpin gene transferred were selectively cultured with G418 and the positive clones were obtained in 3 weeks. Four clones with gk gene and mpin gene expression were selected out by radio-immunity, SDS-PAGE, Western-blot from 20 positive clones. We picked up one clone with strong gk gene and mpin gene expression and named it clone "b". It was proved that the clone "b" had gk gene and mpin gene transcription by RT-PCR. In the clone "b", the differences in the insulin secretion at 0.5 mmol/L and 0.75 mmol/L glucose concentration were not significant (P >0.05), and the differences in the insulin secretion at 2.0 mmol/L, 3.0 mmol/L, 4.0 mmol/L, 5.0 mmol/L and 6.0 mmol/L glucose concentration were also not significant (P >0.05), while there were significant differences in the insulin secretion at the other glucose concentration(P <0.05). In HepG2 cells with mpin gene transferred, there were no significant differences in the insulin secretion at any glucose concentration(P >0.05). The "artificial beta cell" obtained a glucose-stimulated insulin secretion with maximal insulin secretion at 1.75-2 mmol/L glucose concentration.
CONCLUSION: An "artificial beta cell" is successfully constructed.
- Citation: Zheng HT, Deng HC, Lan LZ, Fang F. Construction of an "artificial beta cell": Modulation of glucose-stimulated insulin secretion from HepG2 cell. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2103-2106
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2103.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2103
胰腺疾病(如胰腺炎、创伤/胰腺切除术、肿瘤、纤维钙化性胰腺病等)均可导致胰岛细胞破坏、胰岛素绝对缺乏, 从而引发糖尿病[1-13]. 针对这一类型的糖尿病, 细胞移植治疗是近来研究的热点, 植入体内的胰岛b细胞可按机体需要分泌胰岛素, 纠正糖代谢紊乱. 但由于胰岛b细胞分离技术难度较大、代价昂贵, 如何得到大量可供移植的细胞仍是该方法亟待解决的问题. "胰岛代理细胞"是指应用转基因技术构建具有模拟正常胰岛b细胞功能的工程细胞系. 肝细胞是胰岛素作用的靶细胞之一, 其细胞内含有多种与葡萄糖代谢相关的酶类, 故是构建"胰岛代理细胞"的理想靶细胞. 我们运用基因共转染技术, 构建了联合表达葡萄糖激酶(glucokinase, GK)与成熟胰岛素的HepG2细胞. 该细胞具有模拟正常胰岛b细胞的葡萄糖反应性胰岛素分泌能力, 并能通过GK促进葡萄糖磷酸化, 以协同胰岛素控制血糖及其他代谢紊乱. 进一步动物体内移植实验, 可望提供一种更符合生理要求的内源性胰岛素替代疗法.
携gk基因的逆转录病毒已先行构建, 携人胰岛素原基因突变体(mutant proinsulin gene, mpin)的逆转录病毒由本室兰丽珍博士构建, HepG2细胞由第三军医大学蹇锐博士惠赠. Polybrene购自Sigma公司; DMEM, G418购自Gibco公司; TriPure TM Isolation Reagent Kit 购自Boehringer Mannheim公司; RT-PCR试剂盒购自Promega公司; 引物由上海申友公司合成. 羊抗鼠GKIgG由Dr. Magnuson Mark(Vanderbilt University Medical School)惠赠; 兔抗羊IgG购自Southern Biotechnology公司.
1. 2 方法
1.2.1 gk基因与mpin共转染: HepG2细胞在含100 mL/L FBS的高糖型DMEM培养基中, 37 ℃, 50 mL/L CO2培养至对数生长期, 加入携gk基因的逆转录病毒(滴度为1.8×109CFU/L)3.6×105CFU, 携mpin的逆转录病毒(滴度为2.6×108CFU/L )2.6×105CFU, 并加polybrene至终浓度8 mg/L, 黏附4 h后, 换用DMEM培养基培养12 h; 而后用携目的基因的逆转录病毒同前再度感染HepG2细胞3次, 最后1次黏附4 h后, 换用DMEM培养基培养24 h. 将感染后的HepG2细胞按1:20分传, 用含G418 (1 g/L)的选择培养基筛选, 直至抗性细胞集落形成, 用克隆环挑取分隔良好的细胞克隆扩大培养并进行产物鉴定. 挑取的细胞克隆移至24孔板, 换含G418(600 mg/L )的选择培养基扩大培养. 细胞计数, 测定上清胰岛素浓度, 以HepG2细胞及转了空载体(PLXSN)的HepG2细胞对照. 胰岛素浓度在新桥医院内分泌科实验室以放免法测定.
1.2.2 SDS-PAGE和Western-blot: 测出胰岛素表达的各细胞克隆转入中号瓶培养, 取5×106个细胞悬于150 mL PBS中, 加入等体积缓冲液, 超声破碎, 按"精编分子生物学实验指南" 的方法进行SDS-PAGE和Western-blot分析, ECL显色, 检测GK表达. 并用Hela细胞、HepG2细胞及转了空载体(PLXSN)的HepG2细胞对照.
1.2.3 RT-PCR: 用TriPure TM Isolation Reagent Kit提取共表达GK及成熟胰岛素的HepG2细胞总RNA及转了空载体(PLXSN)的HepG2细胞总RNA, 分别用大鼠gk基因及mpin特异性引物进行RT-PCR, 方法按Promega公司说明. 取5%的反应产物于15g/L琼脂糖凝胶电泳, EB染色, 紫外透射仪观察.
1.2.4 葡萄糖刺激胰岛素的分泌: 先吸去共表达GK及成熟胰岛素的HepG2细胞的原培养液, 用基础液(含1 mmol/L CaCl2的PBS, 20 mmol/L HEPES和2g/L BSA, 0.5 mmol/L葡萄糖)彻底清洗细胞2次, 然后接种于12孔板(3×105个/孔), pH7.4, 用基础液培养3 h, 稳定基础胰岛素分泌. 将各孔中的葡萄糖浓度调整为既定值(0.5 - 6 mmol/L)培养1 h, 每一既定葡萄糖浓度设定6个孔(n = 6), 同前测定胰岛素浓度, 数据用mean±SD表示. 同时以单独表达成熟胰岛素的HepG2细胞对照.
统计学处理 采用SPSS10.0分析软件, 数据用mean±SD表示, 组间差异采用F检验, 显著性差异标准为P <0.05.
在G418选择培养基中, 约3 wk可见抗性细胞集落形成, 挑选20个分隔良好的细胞克隆扩大培养并行产物鉴定. 细胞计数约2-3×105个/孔, 共12个细胞克隆测出胰岛素表达, 分别为76.5, 75.9, 51.6, 36.4, 24.3, 21.2, 19.4, 37.5, 55.8, 18.4, 66.4, 55.6 mU/L; 另8个克隆以及对照的HepG2细胞及PLXSN-HepG2细胞测不出胰岛素表达, 记为"0".
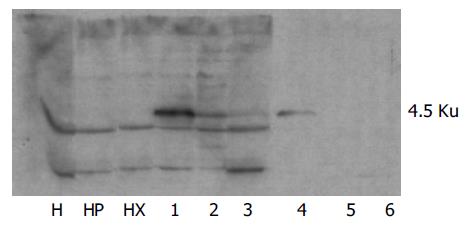
测出胰岛素表达的12个细胞克隆分两组进行SDS-PAGE和Western-blot, 每组6个样本, Hela细胞、HEPG2细胞及PLXSN-HEPG2细胞3个对照. 第1组4个细胞克隆测出GK表达(克隆1, 2, 3, 4), 对照的Hela细胞、HepG2细胞及PLXSN- HepG2细胞均为阴性, 第2组所有样本均为阴性. 挑选出胰岛素和GK表达均较强的克隆1, 命名为细胞克隆"b"(图1).
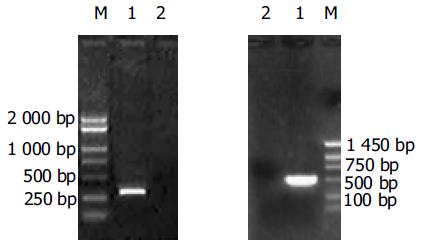
mpin特异性引物的RT-PCR结果: 以细胞"b"总RNA为模板阳性扩增, 产物286 bp; 以PLXSN- HepG2细胞总RNA为模板阴性扩增. 大鼠gk基因特异性引物的RT-PCR结果: 以细胞"b"总RNA为模板阳性扩增, 产物498 bp; 以PLXSN- HepG2细胞总RNA为模板阴性扩增(图2). 证明在细胞"b"中已有两个目的基因的转录表达.
细胞"b"中以及单独表达胰岛素的HepG2细胞中各葡萄糖浓度引起的胰岛素分泌(图3). 同一葡萄糖浓度条件下胰岛素的检测结果用mean±SD表示(n = 6), 组间进行F检验(k = 11), 细胞"b"中1, 2组间, 7, 8, 9, 10, 11组间无显著性差异(P >0.05); 在单独表达胰岛素的HepG2细胞中, 各组间均无显著性差异(P >0.05).
胰腺疾病引起的继发性糖尿病具有明显的酮症酸中毒倾向[14-19], 目前其治疗方法是每日多次注射胰岛素或使用胰岛素泵, 不但剂量难以掌控, 且易出现血糖波动和剂量不当引起的相关并发症. 如何获得生理条件下的胰岛素替代一直是研究者关注的焦点, 目前已经证明在体内植入胰岛b细胞或工程细胞系可解决这一问题. 工程细胞系作为胰岛素释放的载体比胰岛b细胞具有更多的优点: 可以大量生产, 成本较低. 因此, 近年国外在应用细胞工程转基因技术构建"胰岛代理细胞系"方面已经开展了一些研究工作. GK和葡萄糖转运蛋白-2(glucose transporter-2, GLUT-2)是胰岛素分泌的葡萄糖传感器, 其活性直接或间接受血糖浓度的调节, 从而改变葡萄糖在胰岛b细胞内的代谢率, 调节胰岛素分泌[20-23]. 基于这一原理, Hughes et al[24]将glut-2基因转入AtT-20ins细胞后, 该细胞获得了在葡萄糖浓度为10-50 mmol/L时的胰岛素最大分泌, 这一浓度约是生理性胰岛素分泌高峰时葡萄糖浓度(5 mmol/L)的1/50. Clark et al[25-26]将glut-2基因转入放射诱导胰岛素瘤细胞(RIN)后, 该细胞获得了在葡萄糖浓度为0.5-1.0 mmol/L时的胰岛素最大分泌, 约为生理性浓度的1/10. 进一步在培养体系中加入6-磷酸-2脱氧葡萄糖以阻止己糖激酶的表达, 获得了葡萄糖浓度5 mmol/L引起的最大胰岛素分泌, 并推测这一作用与GK和己糖激酶的比值增加有关.
我们构建的联合表达GK及成熟胰岛素的HepG2细胞, 获得葡萄糖浓度约1.75-2 mmol/L时的胰岛素分泌高峰, 比上述两种工程细胞系更接近于生理条件. 但该细胞系仍不能获得生理浓度(5 mmol/L)时的最大胰岛素分泌, 我们认为这是由于HepG2细胞中主要表达GLUT-1, 而GLUT-2的表达偏低. GLUT-2能与其他细胞成分相互作用产生葡萄糖代谢所必需的重要信号, 诸如G蛋白和K+或Ca++通道的激活等, 从而影响b细胞内的葡萄糖代谢率及胰岛素分泌反应的强度[27]. 在进一步的研究工作中, 我们将在该细胞系中转入glut-2基因, 可望获得完全符合生理条件的胰岛素分泌.
同时, GK还可以促进肝糖原合成及催化葡萄糖转变为6-磷酸葡萄糖, 在糖代谢中发挥重要的作用. 研究发现, 在糖尿病个体中普遍存在GK活性下降. Caro et al[28]对肥胖型糖尿病患者以及糖耐量正常的肥胖个体进行肝活检, 结果糖尿病患者组肝脏GK活性较对照组下降50%. 在一些动物模型中, 如饥饿鼠、高脂饮食诱导的2型糖尿病大鼠, 肝脏细胞GK活性均比正常明显下降. 另外, 提高GK活性可显著降低血糖. Niswender et al[29]利用转基因技术增加小鼠中的gk基因拷贝数, 与对照组相比, 小鼠血糖明显下降. 肝脏中因c-myc表达增多而增强GK表达的STZ(链脲佐菌素, streptozotocin)-糖尿病鼠, 血糖也明显降低. 而Ferre et al[30]利用gk转基因更可逆转糖尿病鼠的某些代谢紊乱, 使血糖、酮体、血脂及血自由脂肪酸恢复正常. 因此, 将本研究构建的细胞系植入体内, 除可获得近似生理条件的胰岛素分泌外, 还可以通过GK促进葡萄糖磷酸化及糖原合成, 以协同胰岛素控制血糖及其他代谢紊乱.
目前, 该细胞系还不能获得完全生理条件下葡萄糖激发的胰岛素分泌, 他对升糖激素的反应可能与正常胰岛b细胞也有区别, 这是否会引起糖代谢自稳态发生改变尚不清楚. 其产生胰岛素的量能否满足机体的需要, 细胞在体内如何逃避免疫攻击及其他生物效应, 这一系列问题尚待解决. 随着研究的进一步深入, 我们可能为患者提供一种有效、持久的基因治疗手段.
感谢Dr. Magnuson Mark, 蹇锐博士, 陈雪涛博士对本研究的支持.
| 1. | Sánchez-Lozada R, Soriano-Rosas J, Gutiérrez-Vega R. [Acute pancreatitis, diabetes, and sacoidosis. Case report and review of the literature]. Gac Med Mex. 2004;140:343-345. [PubMed] |
| 2. | Dobson L, Sheldon CD, Hattersley AT. Understanding cystic-fibrosis-related diabetes: best thought of as insulin deficiency? J R Soc Med. 2004;97 Suppl 44:26-35. [PubMed] |
| 3. | Damiano J, Bordier L, Le Berre JP, Margery J, Dupuy O, Mayaudon H, Bauduceau B. Should pancreas imaging be recommanded in patients over 50 years when diabetes is discovered because of acute symptoms? Diabetes Metab. 2004;30:203-207. [PubMed] [DOI] |
| 4. | Iglesias A, Murga M, Laresgoiti U, Skoudy A, Bernales I, Fullaondo A, Moreno B, Lloreta J, Field SJ, Real FX. Diabetes and exocrine pancreatic insufficiency in E2F1/E2F2 double-mutant mice. J Clin Invest. 2004;113:1398-1407. [PubMed] [DOI] |
| 6. | Charpentier KP, Brentnall TA, Bronner MP, Byrd D, Marsh C. A new indication for pancreas transplantation: high grade pancreatic dysplasia. Clin Transplant. 2004;18:105-107. [PubMed] [DOI] |
| 7. | Egawa S, Takeda K, Fukuyama S, Motoi F, Sunamura M, Matsuno S. Clinicopathological aspects of small pancreatic cancer. Pancreas. 2004;28:235-240. [PubMed] [DOI] |
| 10. | Connolly EM, Osborne H, Hickey DP. A novel treatment for chronic pancreatitis. Ir J Med Sci. 2003;172:202-203. [PubMed] [DOI] |
| 11. | Krechler T, Novotný J, Zeman M, Krska Z, Svestka T, Sváb J, Lukás M, Filipová R, Zák A. [Pancreatic carcinoma and diabetes mellitus]. Cas Lek Cesk. 2004;143:97-100. [PubMed] |
| 12. | Helling TS. Surgical management of chronic pancreatitis and the role of islet cell autotransplantation. Curr Surg. 2003;60:463-469. [PubMed] [DOI] |
| 13. | Gruessner RW, Sutherland DE, Dunn DL, Najarian JS, Jie T, Hering BJ, Gruessner AC. Transplant options for patients undergoing total pancreatectomy for chronic pancreatitis. J Am Coll Surg. 2004;198:559-567; discussion 568-569. [PubMed] [DOI] |
| 14. | Kim KP, Kim M, Lee YJ, Song MH, Park DH, Lee SS, Seo DW, Lee SK, Min YI, Song DE. [Clinical characteristics of 17 cases of autoimmune chronic pancreatitis]. Korean J Gastroenterol. 2004;43:112-119. [PubMed] |
| 15. | Banzo J, Velilla J, Abós MD, Prats E, Razola P, García F, Ubieto MA. [Diabetes mellitus and pancreatic tumor]. Rev Esp Med Nucl. 2004;23:33-38. [PubMed] [DOI] |
| 16. | Romatowski JA, Szałaj W, Stasiewicz J. [The influence of the development of diabetes mellitus in patients with chronic pancreatitis on exocrine pancreatic function measured by secretin-caerulein test]. Pol Arch Med Wewn. 2003;110:981-987. [PubMed] |
| 17. | Endlicher E, Völk M, Feuerbach S, Schölmerich J, Schäffler A, Messmann H. Long-term follow-up of patients with necrotizing pancreatitis treated by percutaneous necrosectomy. Hepatogastroenterology. 2003;50:2225-2228. [PubMed] |
| 18. | Bruttocao A, De Santis L, Militello C, Martella B, Terranova O. [Therapeutic strategy in neoplasia of the pancreas and ampulla]. Ann Ital Chir. 2003;74:269-274. [PubMed] |
| 19. | 姚 新生, 孙 万邦, 方 传发, 谢 政军. 急性胰腺炎患者血浆PAF、PAF-AH的变化及外周血 PBMC上PAF-R的表达. 世界华人消化杂志. 2002;10:369-370. [DOI] |
| 20. | Al-Hasani H, Tschöp MH, Cushman SW. Two birds with one stone: novel glucokinase activator stimulates glucose-induced pancreatic insulin secretion and augments hepatic glucose metabolism. Mol Interv. 2003;3:367-370. [PubMed] [DOI] |
| 21. | Maassen JA, 'T Hart LM, Van Essen E, Heine RJ, Nijpels G, Jahangir Tafrechi RS, Raap AK, Janssen GM, Lemkes HH. Mitochondrial diabetes: molecular mechanisms and clinical presentation. Diabetes. 2004;53 Suppl 1:S103-S109. [PubMed] [DOI] |
| 22. | Lopes Da Costa C, Sampaio De Freitas M, Sanchez Moura A. Insulin secretion and GLUT-2 expression in undernourished neonate rats. J Nutr Biochem. 2004;15:236-241. [PubMed] [DOI] |
| 23. | Abe N, Watanabe T, Ozawa S, Masaki T, Mori T, Sugiyama M, Ishida H, Nagamatsu S, Atomi Y. Pancreatic endocrine function and glucose transporter (GLUT)-2 expression in rat acute pancreatitis. Pancreas. 2002;25:149-153. [PubMed] [DOI] |
| 24. | Hughes SD, Quaade C, Johnson JH, Ferber S, Newgard CB. Transfection of AtT-20ins cells with GLUT-2 but not GLUT-1 confers glucose-stimulated insulin secretion. Relationship to glucose metabolism. J Biol Chem. 1993;268:15205-15212. [PubMed] |
| 25. | Clark SA, Burnham BL, Chick WL. Modulation of glucose-induced insulin secretion from a rat clonal beta-cell line. Endocrinology. 1990;127:2779-2788. [PubMed] [DOI] |
| 26. | Clark SA, Chick WL. Islet cell culture in defined serum-free medium. Endocrinology. 1990;126:1895-1903. [PubMed] [DOI] |
| 27. | Miralles F, Czernichow P, Scharfmann R. Follistatin regulates the relative proportions of endocrine versus exocrine tissue during pancreatic development. Development. 1998;125:1017-1024. [PubMed] |
| 28. | Caro JF, Triester S, Patel VK, Tapscott EB, Frazier NL, Dohm GL. Liver glucokinase: decreased activity in patients with type II diabetes. Horm Metab Res. 1995;27:19-22. [PubMed] [DOI] |
| 29. | Niswender KD, Postic C, Shiota M, Jetton TL, Magnuson MA. Effects of altered glucokinase gene copy number on blood glucose homoeostasis. Biochem Soc Trans. 1997;25:113-117. [PubMed] [DOI] |
| 30. | Ferre T, Pujol A, Riu E, Bosch F, Valera A. Correction of diabetic alterations by glucokinase. Proc Natl Acad Sci USA. 1996;93:7225-7230. [PubMed] [DOI] |